Caspase/AIF/apoptózis útvonal: a puerarin új célpontja a diabetes mellitus terápiában
Absztrakt
Bevezetés
A T2DM egy endokrin betegség, amely gyakran más anyagcserezavarokkal is jár, amelyek potenciálisan életveszélyesek [1]. Az inzulinrezisztencia (IR) a T2DM korai stádiumában jelentkezik, és fokozatosan a β-sejtek inzulinszekréciós képességének csökkenéséhez vezet a strukturális károsodások miatt, ami végül glükóz- és lipid-anyagcsere-rendellenességeket eredményez [2]. Mint ismert, a mitokondriális oxidatív stressz kulcsfontosságú tényező az IR és a β sejtek diszfunkciójában. A túlzott reaktív oxigénfajok (ROS) aktiválhatják a lefelé áramló apoptotikus faktorokat, ideértve a citokróm C-t (Cyto-C) és az AIF-et, és kiválthatják a β-sejtek apoptózisát [3, 4]. Korábbi vizsgálataink során felfedeztük, hogy a PR csökkentheti az STZ által kiváltott diabéteszes egerek FBG szintjét az oxidatív stressz enyhítésével és a gyulladásos tényezők expressziójának csökkentésével a nukleáris faktor kappa B (NF-κB) és a Cyto-C [5]. Ezért nekiláttunk a hasnyálmirigy apoptózisának PR mechanizmusát feltárni T2DM egerekben.
Hagyományosan az apoptózist a kaszpáz proteáz-fehérje család hajtja végre, amelyek az exogén halálreceptor-útvonalon és az endogén mitokondriális úton aktiválódnak. A kaszpáz család fehérjéi megnövelik a mitokondriumok permeabilitását, ami ezután kiváltja a Cyto-C felszabadulását a mitokondriumokból, és Appaf-1, ATP és pro-kaszpáz-9 alkalmazásával apoptózist kiváltó komplexet képez. [6, 7]. Korábbi tanulmányok azt találták, hogy a mitokondriális apoptózist kiváltó faktor (AIF) közvetítheti a nukleáris apoptózist [8, 9]. Úgy gondolják, hogy az AIF központi szerepet játszik a kaszpáz-független apoptózis útvonalában. Az AIF pro-apoptotikus hatása a saját pozitív visszajelzésében is megmutatkozik, vagyis a citoplazmába engedett AIF más mitokondriumokra is képes hatni, növelve azok permeabilitását és tovább elősegítve az AIF felszabadulását. Az AIF elősegíti a Cyto-C felszabadulását is, végül aktiválja a kaszpáz-3-at. Előzetes tanulmányunkban felfedeztük, hogy a PR indukálhatja az AIF szabályozó faktorának, a Bcl-2-nek az aktiválódását, ami azt jelzi, hogy a PR gátolhatja az apoptózist az AIF expressziójának szabályozásával. Ezért ennek a hipotézisnek a tesztelését tűztük ki célul, hogy tovább tisztázzuk a PR mechanizmusát a T2DM-en.
Az STZ egy klasszikus gyógyszer cukorbetegség kiváltására egerekben. A magas zsírtartalmú étrenddel táplált és STZ-vel kezelt egerek hyperglykaemia, hyperlipidaemia, elhízás és hyperinsulinaemia klinikai megnyilvánulásait mutatják [10]. Az instabilitása miatt az STZ oldatot frissen kell elkészíteni, és egy éjszakán át éheztetett egerekbe közvetlenül be kell fecskendezni a farokvénán keresztül.
PR, az egyik aktív vegyület Pueraria lobata, az STZ-indukálta diabéteszes egerekben az inzulin expresszió növelésében és a metabolikus homoeostasis fenntartásában játszott szerepe révén a DM terápiájaként népszerűsítették. Jelen tanulmányban a PR hatását vizsgáljuk a T2DM-re. Először bizonyítottuk, hogy a PR gátolhatja a hasnyálmirigy sejtek apoptózisát T2DM egerekben a kaszpáz család fehérjéinek és az AIF expressziójának szabályozásával.
Anyagok és metódusok
Állatok
Az összes állati protokollt a Guangxi Orvostudományi Egyetem Intézményi Etikai Bizottsága hagyta jóvá (jóváhagyási szám: 2012011121). Valamennyi állatkísérletet a kísérleti állatok kezeléséről és a laboratóriumi állatok gondozásáról és felhasználásáról szóló iránymutató vélemények irányelveivel összhangban végzik. Körülbelül 18–22 g tömegű egészséges hím kunmingi egereket vásároltak a Guangxi Orvostudományi Egyetem Kísérleti Állatközpontjából (nyilvántartási szám: SCXK 2010-0002). Az állatokat szabályozott hőmérsékletű (22–25 ° C) laboratóriumi körülmények között, 12 órás világos-sötét ciklus alatt akklimatizálták, és szabad hozzáférést biztosítottak a csapvízhez és a szokásos rágcsáló-chow-hoz.
Anyagok
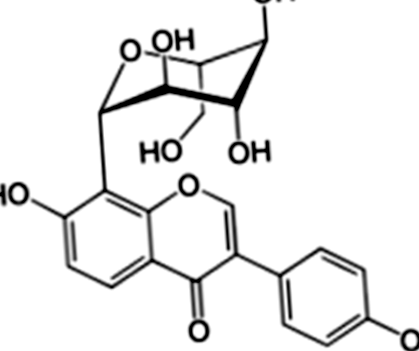
Puerarin készítményt (tisztaság> 99%) a Guangxi Orvostudományi Egyetem Gyógyszerészeti Kémiai Tanszéke (Nanning, Kína) biztosított. A metformint a Zhongxin Pharmaceutical Co., Ltd.-től (Tianjin, Kína) vásároltuk. A sztreptozotocint (STZ) a Sigma Co., Ltd.-től (Missouri, USA) szereztük be. A PR molekuláris szerkezetét az 1. ábra mutatja. Az FBG-t és a vérkémiát a Roche ACCU-CHEK® Performa (Strip lot: 470664, Svájc) és egy automatikus biokémiai analizátorral (Hitachi Model 7100 Automatic Analyzer) mértük. A többi anyagot a következő szakaszok mutatják be.
Az izolált puerarin kémiai szerkezete P. lobata (Willd.)
Kísérleti tervezés [11]
A 2-es típusú cukorbeteg egereket magas zsírtartalmú étrendes etetéssel és STZ injekcióval hozták létre. Az egészséges hím kunmingi egereket 1 hónapig magas zsírtartalmú étrendben táplálták, és intravénásán 80 mg kg -1 testtömegű STZ-t injektáltak hozzájuk 12 órás böjt után. A frissen elkészített STZ-oldatot hűtött sóoldatban oldottuk fénymentesen. A metformint pedig közvetlenül sóoldatban oldják szájon át történő szoptatáshoz. Hetvenkét óra múlva megmértük az FBG-t, és azokat az egereket, amelyek FBG-értéke ≥ 11,1 mmol L -1, T2DM-egereknek tekintették. Ezenkívül az egészséges hím Kunming egerek normál rágcsáló chow-val etették a normál kontrollokat. A kísérleti állatokat a következő csoportokba osztottuk:
1. csoport sós oldattal szondával kezelt egészséges egerek: normál kontroll.
2. csoport 2. típusú cukorbeteg egerek, amelyeket sóoldattal kezeltek szondával: modellkontroll.
3. csoport 2. típusú diabéteszes egerek, amelyeket 320 mg kg -1 metforminnal kezeltek szondával: pozitív kontroll.
4. csoport 2-es típusú cukorbeteg egerek, akiket 80 mg kg-1 PR-vel kezeltek szondával (korábbi tanulmányunk szerint 80 mg kg-1 PR hatékony dózis [5]).
A metformint és a PR-t naponta egyszerre adták, legfeljebb 15 napig.
Biokémiai mérések
Az FBG szinteket a kísérlet során a kezelés 0., 7. és 15. napján detektáltuk a Roche ACCU-CHEK® Performa alkalmazásával farokvénás vérrel. A szérummintákat teljes vérből centrifugálással gyűjtöttük 1300x-nálg 10 percig a kimutatáshoz. A szérum FINS-tartalmat Cusabio egér ELISA készlettel (Huamei Biotech Co., Ltd., Hubei, Kína) mértük. A TC, TG, LDL és HDL szérumszintjét kereskedelemben kapható készletekkel elemeztük (Jiancheng Bioengineering Institute, Nanjing, Kína).
Kóros vizsgálat
A hasüreg betakarításához hasi bemetszést végeztek. A hasnyálmirigy szöveteit 10% paraformaldehidben rögzítettük 24 órán át, majd paraffinba ágyazottuk. A metszeteket (5 μm) rendszeres haematoxilin-eozin (HE) festésnek vetettük alá, és fénymikroszkóppal figyeltük meg Olympus CX4 (Japán).
Transzmissziós elektronmikroszkópia
Az elektronmikroszkópos vizsgálatra használt hasnyálmirigy-szöveteket 0 ° C alatt eltávolítottuk, apró darabokra vágtuk és azonnal 2,5% -os, előre lehűtött glutáraldehidbe rögzítettük. Az ultravékony metszeteket (70 nm) uranil-acetáttal és ólom-citráttal festettük. Végül a mintákat transzmissziós elektronmikroszkóppal figyeltük meg (Hitachi H-7650).
Hasnyálmirigy β sejt apoptózis vizsgálata
Az in situ sejthalál-detektáló készletet (Roche, Németország) a hasnyálmirigy szövetére helyeztük a terminális dezoxinukleotidil-transzferáz által közvetített dUTP nick end jelzés (TUNEL) festésre. Az apoptotikus sejteket fénymikroszkóp megfigyelésével detektáltuk a színreakción keresztül.
Western blot elemzés
A hasnyálmirigy-mintákat lízispufferben homogenizáltuk, és az összes fehérjét kivontuk. A fehérjekoncentrációkat protein assay reagenssel (Bio-Rad) határoztuk meg. A Western blot elemzéshez a fehérje lizátumokat SDS – poliakrilamid gélelektroforézissel választottuk el, és polivinil-difluorid membránokra vittük át. A membránokat PBST pufferrel (1% Tween-20, PBS) blokkoltuk 2 órán át szobahőmérsékleten, majd inkubáltuk kaszpáz-3, 8, 9 és AIF (1: 1000 Santa Cruz, USA) elsődleges antitestekkel egy éjszakán át 4 ° C-on. ° C. Három mosás után a blotokat kecske nyúlellenes és/vagy kecske egér torma peroxidázzal konjugált másodlagos IgG-vel (Boster Biotechnology) inkubáltuk 2 órán át szobahőmérsékleten. Az immunreaktív sávokat diaminobenzidinnel tettük láthatóvá. A reprezentatív sávokat Scion képszoftverrel (Scion Corp., Frederick, MD) mértük. A fehérje szintet a β-aktin szintjére normalizáltuk.
statisztikai elemzések
Az adatokat átlag ± S.E. A csoportok közötti szignifikáns különbségeket egyirányú ANOVA-val elemezték, majd Tukey-tesztek követték az összehasonlítást az SPSS16.0 alkalmazással. P-értékek
Eredmények
A PR hatása az FBG és az inzulin szérumszintjére T2DM egerekben
A PR T2DM egerekre kifejtett hipoglikémiás hatásának vizsgálatához 80 mg kg -1 PR-t adtunk be szájon át 15 napig magas zsírtartalmú étrenddel táplált és STZ-indukált T2DM Kunming egereknek. Amint a 2. ábrán és az 1. táblázatban látható, a PR orális beadása hatékonyan csökkentette az FBG szintet a T2DM egerekhez képest a modell kontrollcsoporthoz, valamint a metforminnal kezelt csoporthoz képest. A metformint beadó T2DM egerekben a modellkontrollokhoz képest a FINS-tartalom szignifikánsan csökkent. A PR-ek csökkentek a PR-vel kezelt egerekben, amelyek különbséget mutattak (3. ábra és 1. táblázat).
A PR hatása a szérum lipidprofilokra T2DM egerekben
A hiperglikémiát gyakran hyperlipidaemia kíséri. Így megmértük a TC, TG, LDL és HDL szinteket is, hogy megfigyeljük a lipid metabolizmus változását a T2DM egerekben. A TC, TG és LDL szérumszintje PR kezeléssel csökkent a kezeletlen diabéteszes egerekhez képest. Ezenkívül a PR kezelés növelte a HDL szintet a diabéteszes egerekben a modellkontrollokhoz képest (4. ábra és 2. táblázat).
A PR hatása a T2DM egerek hasnyálmirigyének morfológiai változásaira
A HE-vel festett hasnyálmirigy-szövet azt mutatta, hogy egészséges egerekben a sejtszerkezet fennmaradt. A normál minták szigeteihez képest a modell kontrollcsoportban ritkulást és kavitációkat figyeltünk meg az STZ injekció által okozott károk miatt. A kárt a PR beadásával enyhítették, amint azt az 5. ábra és a 3. táblázat mutatja.
A PR hatása a hasnyálmirigy ultrastruktúrájára T2DM egerekben
Az ultrakonstrukció megfigyelése világos és közvetlen képet nyújt az organellákról. Amint azt a 6. ábra és a 4. táblázat mutatja, a diabéteszes egerek szigetsejtjeiben megfigyelték az apoptózis, valamint a mitokondriális kavitáció nukleáris piknózisát és deformációs jellemzőit. Ezzel szemben a PR-vel kezelt T2DM egerek viszonylag kevesebb magdeformációt és kavitált mitokondriumot mutattak.
A PR hatása a hasnyálmirigy apoptózisára T2DM egerekben
A TUNEL festést, amelyben a pozitív sejtek barnának tűnnek, a hasnyálmirigy apoptózisának vizsgálatára végeztük. Amint a 7. ábrán és az 5. táblázatban látható, a pozitív sejtek száma nagyobb volt a T2DM egerekben a normál kontrollokhoz képest. A PR-vel és a metforminnal végzett kezelés jelentősen gyengítette a sejtek életképességének csökkenését.
A PR hatása a kaszpáz-3, 8, 9 és AIF fehérje expressziójára T2DM egerekben
A fehérjék kaszpáz családja részt vesz az apoptózis kiváltásában. Az AIF a mitokondriális apoptózisért is döntő tényező. Ezért megvizsgáltuk, hogy a PR befolyásolta-e a kaszpáz család fehérjéinek és az AIF expresszióját a T2DM egerekben. Amint azt a 8. ábra és a 6. táblázat mutatja, megnövekedett kaszpáz-3, 8, 9 és AIF értékeket figyeltek meg a hasnyálmirigy szöveteiben diabéteszes egereknél. A PR kezelés hatékonyan szüntette meg a kaszpáz család fehérjéinek és az AIF emelkedett fehérje expressziós szintjét.
Vita
A relatív inzulinhiány a T2DM progressziójának jól ismert döntő tényezője, amely hozzájárul a szigeti β-sejtek károsodásához és apoptózisához [12]. Tehát a szigeti β sejtek helyreállítása hatékony terápiás célpont a T2DM kezelésben. Jelen tanulmányban bebizonyítottuk, hogy a PR a kaszpáz család fehérjéinek és az AIF expressziójának gátlásával képes csillapítani az STZ által kiváltott hasnyálmirigy sejt apoptózist.
A PR, egy izoflavonoid, a fő aktív komponense P. lobata. Beszámoltak arról, hogy a PR antioxidáns, hipotenzív és hipoglikémiás aktivitással rendelkezik [13,14,15]. Korábbi vizsgálatok kimutatták, hogy a PR protektív hatást gyakorolt a diabéteszes vesekárosodásra, a szívelégtelenségre, a diabéteszes kardiomiopátiára, a szív fibroblaszt proliferációjára, a vázizomzat energiacseréjére és a máj lipidanyagcseréjére [16,17,18,19,20,21,22]. A PR hipoglikémiás hatását a diabetes mellitusra korábbi vizsgálatok igazolták [15, 23, 24]. Korábbi tanulmányunkban a PR kezelés csökkentette az FBG szintet a diabéteszes nephropathia egerekben az oxidatív stressz csillapításával. Egy másik korábbi tanulmány megállapította, hogy a PR eloszlik a hasnyálmirigyben, ami megmagyarázhatja a PR cukorbetegségben kifejtett hipoglikémiás megnyilvánulását [25].
A cukorbetegségben a magas glükóz által kiváltott oxidatív stressz hatással lehet az inzulin szabályozására, ami az inzulinszintézis csökkenéséhez vezethet, és elősegítheti a β-sejtek diszfunkcióját. A mitokondrium károsodik, ha túlzott oxigén szabad gyököknek vannak kitéve, amelyek megzavarják a légzési energia útjait [26]. A vércukorszint-szabályozás a DM kezelés alapja. Ezenkívül a β sejtkárosodás terápiás célpont lehet. A PR hasnyálmirigyre gyakorolt hatásának kimutatásához megvizsgáltuk a hasnyálmirigy ultrastruktúráját és megmértük az apoptózissal kapcsolatos fehérjék expresszióját.
A PR apoptózisra gyakorolt védő hatását kóros és ultrastrukturális megfigyelések is megerősítették. A PR kezelés gyengítette a kóros szigetek morfológiáját, beleértve a sejtek alakját és integritását. Konkrétan a mag deformációja és a mitokondriális kavitáció csökkent a PR kezelést követően. Ezek a hatások a kaszpáz-3, 8, 9 és az AIF útvonal gátlásának köszönhetők; azonban az AIF downstream jelátviteli útvonala még további ellenőrzésre szorul.
Összességében megállapításaink új betekintést nyújtanak a hasnyálmirigy sérülésének kórokozó folyamatába, és a PR-t a kaszpáz/AIF/apoptózis útvonalat célzó új terápiaként azonosítják.
- A cukorbetegség orvosi táplálkozási terápiájának alakulása Posztgraduális orvosi folyóirat
- A cukorbetegség diétás kezelése, fókuszálva Nigéria Udogadi International Journal of
- Az elhízás-terápia kudarcainak elmagyarázása akaraterő-csillapítást, céltévesztést vagy
- Cukorbetegség története - A cukorbetegség története
- Az epekő kiújulása a sikeres oldódási terápia után SpringerLink