A Chaperone Sigma1R az afobazol neuroprotektív hatását közvetíti a Parkinson-kór 6-OHDA modelljében
Tárgyak
Absztrakt
Bevezetés
A Parkinson-kór neurodegeneratív állapot, amelyet az agy dopamintermelő régióiban bekövetkező sérülés okoz, különösen a substantia nigra pars compacta (SNc) neuronjaiban és azok axonális vetületeiben a striatumba. A Parkinson-kórra progresszív mozgáskárosodás, beleértve a bradykinesiát, a pihenő remegést, a merevséget és a testtartási instabilitást jellemzi Az epidemiológiai adatok e betegség prevalenciájának kétszeres növekedését mutatták ki az elmúlt 25 évben, amelyet csak az Alzheimer-kór lép fel az összes neurodegeneratív betegség között 2. A környezeti és genetikai tényezők szerepére utaló számos tanulmány ellenére a Parkinson-kór etiológiája még mindig rosszul ismert 3. A betegség fő patogenetikai összetevői a mitokondriumok károsodása, a fehérje proteazomális lebomlásának károsodása, hibás hajtogatás, oxidatív stressz és ideggyulladás 1,4,5,6. A levodopa, a MAO-B és a COMT inhibitorok, a dopamin agonisták, a β-blokkolók és az NMDA receptor antagonizmussal rendelkező adamantán származékok a leggyakrabban alkalmazott kezelési lehetőségek 7,8. Ezeknek a gyógyszereknek a hatásmechanizmusa megkönnyíti a dopaminerg transzmisszió megkönnyítését a kompromittált idegsejtekben vagy az egyensúlyhiány korrekcióját a neuromediator rendszerekben.
Az afobazol (etoxi-2- [2- (morfolino) -etiltio] benzimidazol-dihidroklorid) szorongásoldó gyógyszert az FSBI „Research State Zakusov Farmakológiai Intézetében” 37 fejlesztették ki és farmakológiailag tanulmányozták. A gyógyszer affinitással rendelkezik a Sigma1R-ekhez (Ki = 5,9E-6 M), valamint az NQO2 (Ki = 9,7E-7 M) és a MAO A (Ki = 3,6E-06 M) szabályozó helyeihez 38 . In vitro és in vivo az afobazollal végzett kísérletek a 39,40,41,42 gyógyszer citoprotektív és neuroprotektív tulajdonságait tárták fel. Legfrissebb eredményeink azt mutatták, hogy az afobazol képes megakadályozni a striatális dopamin csökkenését a 6-OHDA által kiváltott parkinsonizmus modelljében 43; az afobazol fent említett molekuláris célpontjainak szerepét azonban még nem határozták meg. Jelen vizsgálat célja a Sigma1R-ek szerepének meghatározása volt a striatum dopamin-tartalmának afobazol-mediált normalizáló hatásában egy striatumban. in vivo a 6-OHDA elváltozások által kiváltott Parkinson-kór egérmodellje.
Eredmények
A DOPAC-tartalomhoz hasonlóan a HVA-tartalom is csökkent a hordozóval kezelt egerek elváltozott striatumában, és az afobazolnak nem volt szignifikáns hatása erre az értékre (3. ábra). A PRE-084-kezelt egerek 6-OHDA-elváltozású striatumában a HVA-tartalom alacsonyabb volt, mint az ép striatumban, de szignifikánsan magasabb volt, mint a hordozóval kezelt egerek elváltozott striatumában. A BD-1047 Sigma1R antagonista előzetes beadása az afobazollal és a PRE-084-del kezelt egereket érinti, megakadályozva a HVA növekedését (3. ábra). Az intakt striatumban nem észleltünk szignifikáns különbséget a DA, DOPAC és HVA tartalomban a kísérleti csoportok között (1-3. Ábra). A DOPAC/DA, HVA/DA és (DOPAC + HVA)/DA metabolikus arányok szignifikánsan megemelkedtek a hordozóval kezelt egerek 6-OHDA elváltozású striatumában. Az afobazol-kezelés csökkentette a HVA/DA és (DOPAC + HVA)/DA arányokat, míg a PRE-084-nek nem volt kimutatható hatása (1. táblázat).
Hosszan tartó, 2,5 mg/kg dózisú afobazollal végzett megőrzött DA-tartalom a 6-OHDA léziós striatumban a TH + idegsejtek relatív számának jelentős növekedésével járt együtt az SNc-ben (4. ábra) és a késleltetési késéssel a rotarodban. teszt (S. 1. ábra). Erős pozitív korrelációt tártunk fel a DA szint és az SNc TH + neuronok száma között (R = 0,85, p 4. ábra
A TH + idegsejtek korrelációs elemzése a striatum ipsilaterális SNc és DA tartalmában. Világos kör - áloperált vivőanyaggal kezelt állatok (n = 6); sötét kör - 6-OHDA-elváltozású vivőanyaggal kezelt állatok (n = 7); világos négyzet alakú - 6-OHDA-elváltozású afobazollal kezelt állatok 2,5 mg/kg dózisban (n = 9); kék szín - 2. klaszter, piros szín - 1. klaszter; R = 0,85 p = 0,000001; a legjobban illeszkedő egyenlet vonal DA = 14,395 + 5,6337 * x.
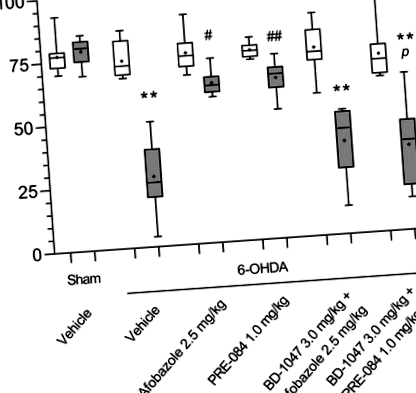
A rotarod-tesztben a 6-OHDA elváltozással hordozóval kezelt egerek mediáns késési késése ötszörösére csökkent az áloperált állatokénál (6. ábra). Az afobazol és a PRE-084 szignifikánsan növelte az esés késését a hemiparkinsonikus állatokban. A BD-1047 előzetes beadása antagonizálta az afobazol hatást. Hasonlóképpen, a BD-1047-gyel történő előkezelés csökkentette a PRE-084-kezelt egerek esési késését a színlelt műtétű vagy PRE-084-tel kezelt egerekéhez képest (6. ábra). Nem figyeltünk meg szignifikáns különbséget az esés késleltetésében a rotarod tesztben naiv, ép és vivőanyaggal kezelt állatokban, szemben az áloperált egerekkel (S. 2. ábra). A Sigma1R ligandumai és kombinációi nem befolyásolták a naiv egerek teljesítményét a rotarod tesztben (S. 2. ábra). Adataink erős pozitív korrelációt mutatnak a striatum DA tartalma és az esési késés között (R = 0,77, p 6. ábra
A striatális DA-tartalom és a rotarod teszt esési késése közötti összefüggés korrelációja és klaszteranalízise. Világos kör - ál-működtetett járművel kezelt állatok; sötét kör - 6-OHDA-elváltozású vivőanyaggal kezelt állatok; világos négyzet alakú - 6-OHDA-elváltozású afobazollal kezelt állatok 2,5 mg/kg dózisban; sötét négyzet alakú - 6-OHDA-elváltozású afobazollal kezelt állatok 2,5 mg/kg dózisban, BD-1047 előkezeléssel 3,0 mg/kg dózisban; könnyű háromszög - 6-OHDA-elváltozású PRE-084-kezelt állatok 1 mg/kg dózisban; sötét háromszög - 6-OHDA-elváltozású PRE-084-kezelt állatok 1,0 mg/kg dózisban, BD-1047 előkezeléssel 3,0 mg/kg dózisban; kék szín - 2. klaszter, piros szín - 1. klaszter. A K-jelentésű adatcsoportok kimutatták, hogy az első klaszter ál-működtetett és afobazol- vagy PRE-084-kezelt egerekből állt (kivéve a 28. esetet). A második klaszter hordozóval kezelt vagy BD-1047 előkezelt egerekből állt (kivéve a 12., 42., 48., 55. és 56. eseteket). R = 0,77 p = 0,000000; a legjobban illeszkedő egyenlet vonal DA = 21,2193 + 0,4532 * x. A kísérleti csoportok 10 egérből álltak, kivéve csak az afobazollal kezelt csoportot, amely 9 volt.
A K-jelentésű adatcsoportosítás bemutatta a kísérleti egerek két fő csoportra osztását. Az első klaszter színlelt módon működtetett és afobazollal vagy PRE-084-tel kezelt egerek voltak (a 28. eset kivételével), míg a második klaszter hordozóval kezelt vagy BD-1047 előkezelt egerekből állt (kivéve a 12., 42. esetet)., # 48, # 55 és # 56). Azok az állatok, amelyek kísérleti jellemzői kiemelkedtek a csoportétól, és kiderült, hogy az ellenkező fürtben vannak, a maximális távolságban voltak a fürtjük közepétől (7. ábra).
Vita
A mostani tanulmány először jellemzi a Sigma1R-ek hozzájárulását az afobazol neuroprotektív hatásaiban egy in vivo A Parkinson-kór 6-OHDA-modellje. A 6-OHDA egyoldalú intrastriatalis injekciója a striatum DA-tartalmának csökkenéséhez vezet, amely keresztkorrelációban áll az SNc-ben lévő TH + idegsejtek halálával és a rotarod teszt alacsony esési idejével. Ezek a fenotípusos jellemzők a Parkinson-kór patogenetikai mechanizmusait képviselik, és összhangban vannak a 44,45 modellben korábban közölt eredményekkel. A 2,5 mg/kg dózisban beadott afobazol megakadályozza a neurotoxicitás által okozott rendellenességek kialakulását, ezért demonstrálja neuroprotektív aktivitását, amelyet a striatum DA-tartalma és a rotarod-teszt vagy a TH + -szám csökkenésének késése közötti magas keresztkorreláció bizonyít. A Parkinson-kór 6-OHDA modelljében a neuroprotektálást a TH + idegsejtek halálának megelőzése és a striatum DA tartalmának normalizálása és a 13,46,47 mozgásaktivitás jellemzi. Az afobazol okozta DA metabolikus arányok szignifikáns csökkenése összhangban van a kísérleti adatokkal, amelyek a neuroprotekciót jellemzik a Parkinson-kór modelljeiben 11,48 .
Az afobazol és az 1,0 mg/kg dózisban beadott PRE-084 Sigma1R agonista hatása sok hasonlóságot mutat, amit a klaszteranalízis megerősít. A kísérleti állatok két csoportjának egyikét ál-operált egerek és csak afobazolt vagy PRE-084-et kapó egerek képviselték. Az afobazol megfigyelt hatása összhangban áll a PRE-084 korábban leírt neuroprotektív hatásával C57BL/6 egerekben a Parkinson-kór 6-OHDA modelljében 11 .
Összességében a jelenlegi tanulmány bemutatja a Sigma1R-ek fontos szerepét az afobazol neuroprotektív hatásában a Parkinson-kór 6-OHDA modelljében, és azt sugallja, hogy a Sigma1R agonisták alkalmazása hasznos lehet Parkinson-kór kezelésében.
Mód
Vegyszerek
A következő vegyszereket használtuk: afobazol (5-etoxi-2- [2- (morfolino) -etiltio] benzimidazol-dihidroklorid) (FSBI „Zakusov Research State Institute of Pharmacology”), PRE-084 (Tocris), BD-1047 (Tocris ), 6-hidroxi-dopamin-hidroklorid (6-OHDA), aszkorbinsav, NaCl, szacharóz, paraformaldehid (PFA), tirozin-hidroxiláz T8700 (Sigma-Aldrich) elleni poliklonális antitestek, CF488 fluorokrómmal konjugált szekunder antitestek SAB4600045 (Sigma-Aldrhield Fluor), 4 ', 6-diamidino-2-fenil-indol, Triton X-100, klór-hidrát, 3,4-dihidroxi-benzil-amin-hidrobromid (DHBA), dopamin (DA), 3,4-dihidroxi-fenil-ecetsav (DOPAC), homovanillinsav (HVA), KH2PO4, H3PO4, HClO4, citromsav, EDTA-Na2, oktánszulfonsav, acetonitril és Tissue Tek OCT közepes.
Kísérleti állatok
A vizsgálatot hím ICR (CD-1) egereken (25–30 g, n = 152) végeztük, amelyeket a Pushchino Tenyésztési Központtól (Orosz Tudományos Akadémia Bioorganikus Kémiai Intézetének fióktelepe) nyertünk. Az állatokat standard vivárium körülmények között (20–22 ° C, 30–70% páratartalom, 12 órás fény/sötét ciklus) fűrészporos ágyú műanyag ketrecekben és ketrecben 10 állatot tartottak.
Etikai jóváhagyás
Az összes kísérleti eljárást az FSBI „Kutatási Zakusov Farmakológiai Intézet” bioetikai bizottsága hagyta jóvá. A kísérleti állatok gondozására és felhasználására vonatkozó valamennyi vonatkozó 73 és nemzetközi 74 irányelvet betartották.
6-OHDA elváltozás
Harminc perccel a műtét előtt az állatokat 45,75 klór-hidráttal (400 mg/kg intraperitoneálisan) altattuk. Az érzéstelenített állatokat a sztereotaxiás keretbe helyeztük (Stoelting Co., Egyesült Királyság), és 6-OHDA-t injektáltunk a jobb striatumba az A = 0,4, L = 1,8 és V = -3,5 koordinátáknak megfelelően a bregma 45-höz viszonyítva. A 6-OHDA-t 5 μg/1 μl koncentrációban oldjuk 0,9% NaCl-ot és 0,02% aszkorbinsavat tartalmazó oldatban. A kísérleti állatoknak 1 μl 6-OHDA oldatot adtunk be 0,5 μl/perc sebességgel, egy 30-as méretű rozsdamentes acél tűvel ellátott Hamilton-fecskendő segítségével. A tűt 2 perccel az injekció beadása után kivették. Az áloperált állatoknak 1 μl sóoldatot és 0,02% aszkorbinsavat injektáltunk ugyanazon koordinátákon.
Gyógyszeres kezelés
Valamennyi állatot ugyanazon dózisú, vizsgált vegyületekkel kezeltük 14 napig, kivéve a naiv intakt állatokat.
Rotarod teszt
A motor viselkedését hím ICR egerekben Rota-rod/RS LE 8500 készülékkel (Panlab/Harvard készülék) vizsgálták. Két, 24 órás különbséggel elrendezett edzést hajtottak végre, hogy a kísérleti állatokat hozzáigazítsák a készülékhez és kizárják a hipodinamikus állatokat a vizsgálatból. Az első edzést a műtétet követő tizenkettedik napon hajtották végre. Mindegyik állatot kétszer tettük a rúdra, miközben 4 fordulat/perc sebességgel forgott, az ülések között 1 órás intervallummal. A második ülés során a forgási sebességet 10 fordulat/perc értékre növelték. Azokat az állatokat, akik nem voltak képesek 1 percnél tovább ragaszkodni a rúdon, kizárták a 44 vizsgálatból. A jelen vizsgálatban minden állat képes volt egy percnél tovább ragaszkodni a rúdhoz, így egyiküket sem zárták ki a kísérletből.
A műtétet követő 14. napon az egereket egy 20 fordulat/perc sebességgel forgó rúdra helyeztük, és mértük az esés késését. Minden állatot háromszor teszteltünk, a kísérletek között 30 perces időközökkel. Ha a kísérleti állat 120 másodpercig képes volt ragaszkodni a rúdhoz, az idő mérését leállítottuk. A statisztikai elemzéshez a három kísérlet maximális idejét használtuk. Az edzéssel és a rotarod teszttel töltött napokon gyógyszereket adtak be előképzés vagy tesztelés után.
HPLC-ED technika
Immunhisztokémiai elemzés
A szeletsíkban lévő magokkal rendelkező TH-pozitív (TH +) idegsejtek sűrűségét 40-szeres nagyítással számoltuk meg ImageJ szoftver segítségével (Nemzeti Egészségügyi Intézet). A számlálást az SNc (rostralis, medialis és caudalis régiók) 3–6 szeletében végeztük minden állatból, ugyanazon mikroszkópos körülmények között, azaz a 800 ms expozíciós idő alatt, az 1.1. Mindegyik állatban 5–7 látómezőben (0,044 mm2) számláltuk az ipsi- és az kontralaterális oldal sejtjeit a 6-OHDA injekcióhoz viszonyítva, és kiszámítottuk az átlagot. Az SNc neuronok sűrűségét az ipsilateralis oldalon az ellenoldali oldal százalékában fejeztük ki.
Statisztikai analízis
A kísérleti adateloszlás típusának értékeléséhez D’Agostino-Pearson és Shapiro-Wilk teszteket alkalmaztunk. Mivel a rotarod tesztben a DA-tartalom és a késés csökkenésére vonatkozó adatok nem illeszkedtek a Gauss-eloszláshoz a csoportok többségében, a Wilcoxon-tesztet és a Dunn post hoc tesztjével végzett Kruskal-Wallis-tesztet használták. Az ANOVA-t Holm-Sidak post hoc teszttel alkalmaztuk a TH + idegsejtek statisztikai szignifikanciájának értékelésére. A striatum DA-tartalmának lineáris kapcsolási elemzését a relatív TH + idegsejtszámmal vagy a rotarod teszt esési késleltetésével a Spearman-korrelációs analízissel végeztük. A táblázatos adatokat mediánként mutatjuk be alsó és felső kvartilisekkel (Mdn (q25-75)). A hisztogrammban szereplő adatokat a minimum és a maximum (Mdn (min-max)) és az átlag mediánjaként adjuk meg. Az állatokat a striatum DA-tartalma alapján k-átlagolással klaszterezéssel és a rotarod tesztben bekövetkező késés késleltetésével osztályoztuk változóként. A populációt két csoportra osztották. A nyers adatok statisztikai elemzését és a kapott eredmények vizualizálását a GraphPad Prism 8.0.1-es verziójával Windows, GraphPad Software, La Jolla California USA, www.graphpad.com és Statistica (StatSoft, Inc.) segítségével végeztük el.
Az adatok elérhetősége
Az ebben a tanulmányban elemzett adatkészletek ésszerű kérésre a megfelelő szerzőtől kaphatók.
- Jó forma, fogyás, karcsúsító PNG átlátszó háttér, női modell képek vektor, PSD fájlok
- Feszesítő, karcsúsító és a cellulit gél ellen - intenzív hármas akció; Kallisti Natural
- Grace Carney Fitness modell interjú és fotók
- Cselekvési terv készítése a sikeres fogyáshoz - ellenállhatatlan jegesedés
- Kaukázusi csomó KChR kamionosai végtelen tiltakozó akciót hirdetnek