A fehér rizs és a fehér kenyér mint alapvető élelmiszer hatása a bél mikrobiotájára és a gazdaszervezet anyagcseréjére
Társított adatok
Absztrakt
Ennek a tanulmánynak az volt a célja, hogy megvizsgálja két főbb japán vágott étel, a fehér rizs és a fehér kenyér, a bél mikrobiotára gyakorolt hatását azzal a háttérrel, amelyben a résztvevők közös köreteket fogyasztanak. Hét egészséges alany teljesítette az étrendi beavatkozást két 1 hetes tesztperiódussal, 1 hetes átmosási periódussal, keresztbe tervezve (UMIN regisztráció UMIN000023142). A tesztperiódus alatt fehér kenyeret vagy fehér rizst és 21 fagyasztott elkészített köretet fogyasztottak. A kiinduláskor és az egyes periódusok végén éhomi vérmintákat, leheletmintákat és székletmintákat gyűjtöttünk. A székletmintákhoz 16S rRNS gén szekvenálást használtak a bél mikrobiota elemzésére. A kenyéridőszak után a széklet Bifidobacterium nemzetségének bősége (19,2 ± 14,5 vs. 6,2 ± 6,6 (%), p = 0,03), éhomi glükagonszerű peptid 1 (GLP-1) (13,6 ± 2,0 vs. 10,5 ± 2,9 ( pg/ml), p = 0,03) és a lehelet hidrogénje (23,4 ± 9,9 vs. 8,2 ± 5,5 (ppm), p = 0,02) szignifikánsan magasabb volt, mint a rizsidőszak után. A plazma SCFA-k általában magasabbak voltak a kenyéridőszak után is. A fehér kenyér több élelmi rostot tartalmaz, mint a finomított rövid szemű rizs. Ezek a megállapítások azt sugallják, hogy a rövid szemű rizs fő élelmiszerként emészthetetlen szénhidrát-bevitele kisebb lehet, mint a fehér kenyér.
1. Bemutatkozás
A rizs a japán étrend hagyományos étele, de az egy főre jutó rizsfogyasztás Japánban az elmúlt 50 évben csökkent [1,2]. Eközben Japánban nőtt a kenyérfogyasztás, és ma a rizs és a kenyér a két fő élelmiszer, amely a japán energiafogyasztás legnagyobb részét biztosítja [3].
A rizs főételként való fogyasztásának étrendi szokása magában foglalja az alacsonyabb zsír- és telített zsír- és magasabb élelmi rost-bevitelt, mint a búzalisztből készült termékek főételként történő fogyasztása [4]. Egy korábbi keresztmetszeti tanulmány azt mutatja, hogy a magasabb rizsbevitel és az alacsonyabb kenyérbevitel a funkcionális székrekedés alacsonyabb előfordulásával jár együtt [5]. Nem világos azonban, hogy ez a hatás elsősorban a vágott ételek vagy az étrendi alkotóelemek, köztük a köretek különbségének köszönhető-e.
A bevitt szénhidrátok körülbelül 10% -a ellenáll a hasnyálmirigy-amiláznak, elkerüli az emésztést a vékonybélben, és továbbra is a vastagbél fermentációjának fő szubsztrátja marad [6]. Ezen emészthetetlen szénhidrátok fermentálása során a bél mikrobiota rövid láncú zsírsavakat (SCFA) termel [7,8]. Néhány korábbi tanulmány szerint a bél mikrobiotája által termelt SCFA-k összefüggenek a lipid anyagcserével [9] és a glükóz anyagcserével emberben [10,11,12].
Mindennapi ételeink során a köretek étkezésenként különböznek, de a vágott ételeket ismételten fogyasztják. Feltételeztük, hogy a vágott élelmiszerekből származó emészthetetlen szénhidrátok étrendi bevitele a bél mikrobiotájának összetételén keresztül hatással lesz a gazda anyagcseréjére. A jelenlegi kísérleti tanulmányban a vágott élelmiszerek különbségére és azok hatására a bél mikrobiota összetételére, valamint a glükóz- és lipid-anyagcserére koncentrálunk egy két periódusú keresztezett kialakításban, kereskedelemben kapható köretek csomagolásával.
2. Módszer
2.1. Tárgyak
Ehhez a tanulmányhoz egészséges önkénteseket vettek fel kutatási osztályunkról (hallgatók, műszaki és kutató személyzet). A felvételi kritériumok a következők voltak: (1) akik jelenleg nem szedtek gyógyszert; (2) azok, akiknek az elmúlt évben nem volt rendellenességük a fizikai ellenőrzés során. Azokat az alanyokat, akiknél a kutatási időszak alatt láz, hasmenés vagy felső légúti gyulladás volt, kizárták az elemzésből. A protokollt (UMIN regisztráció UMIN000023142) a Kiotói Egyetemi Doktori Iskola és az Orvostudományi Kar Etikai Bizottsága hagyta jóvá. A vizsgálatot a kiotói egyetemi kórházban végezték a Helsinki Nyilatkozat elveinek megfelelően. Minden alany írásbeli tájékozott beleegyezést adott.
2.2. Dizájnt tanulni
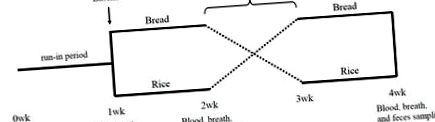
A vizsgálat randomizált, keresztezett vizsgálat volt. 1 hetes befutási periódust követően az alanyokat 1: 1 módon randomizálták a két beavatkozási szekvencia egyikére: Kenyér periódus mellékelt köretekkel 1 hétig, majd rizsi periódus mellékelt köretekkel 1 hétig, vagy rizs periódus mellékelt köretekkel 1 hétig, majd kenyér periódus mellékelt köretekkel 1 hétig (1. ábra). Egy hetes kimosási periódust építettünk be a két tesztperiódus közé. Az alapvonalon és az egyes vizsgálati periódusok végén a vér-, lélegzet- és székletmintákat gyűjtöttük (1. ábra).
A befutási és a lemosási időszakban az alanyokat arra utasították, hogy kerüljék a probiotikumok, joghurt, oligoszacharidok és a tenyésztett tejitalok fogyasztását. A tesztidőszak alatt az alanyok nem fogyasztottak mást, mint vágott ételt (fehér kenyeret vagy fehér rizst) és a mellékelt köreteket. A piacon lévő fehér kenyeret és fehér rizst minden alany elkészítette. A mellékelt köretek a fagyasztott 21 kész köretkészlet csomagjai voltak (TOKATSU FOODS Corporation, Yokohama, Japán). Az alanyok minden étkezéshez egy köretet választottak az első 6 napban kedvelt sorrendben, de az utolsó napon három köretet rögzítettek mindkét időszakban. Az alanyok feljegyezték az első tesztperiódusban elfogyasztott kenyér vagy rizs mennyiségét, a második tesztidőszakban pedig a rizs vagy a kenyér egyenértékű energiáját ették. A kenyér és a rizs tápértékét a japán Oktatási, Kulturális, Sport-, Tudományos és Technológiai Minisztérium által kiadott Élelmiszer-összetétel adatbázis alapján számították ki [13], a köretek tápértékét pedig a gyártó adta meg.
2.3. A székletminták értékelése
A székletmintákat az alanyok otthon gyűjtötték. Az alanyokat arra utasították, hogy székletmintákat helyezzenek a csövekbe, és azonnal helyezzék őket száraz jéggel (–78 ° C) ellátott dobozokba, és vigyék el a dobozokat a laboratóriumba. Az összegyűjtött székletmintákat az elemzésig -80 ° C-on tároltuk.
A székletminták mikrobiális közösségének 16S rRNS-génszekvenálási elemzését MiSeq (Illumina, San Diego, Kalifornia, USA) segítségével végeztük a TechnoSuruga Laboratory Co., Ltd.-nél (Shizuoka, Japán) a korábban leírt módszer szerint [14]. Röviden: a PCR-amplifikációt 341F (5′-CCTACGGGAGAGCAGCAG-3 ’) [15] és 806R (5′-GGACTACHVGGGTWTCTAAT-3’) [16] felhasználásával hajtottuk végre, amelyek primerek voltak a V3 – V4 régió amplifikálásához a 16S baktériumban. rDNS. A V3 – V4 specifikus primer régiók mellett ezek a primerek komplementerek voltak a szokásos Illumina előre és hátra primerekkel. A fordított primer 6 bp indexelő szekvenciát is tartalmazott (CAGATC, ACTTGA, GATCAG, TAGCTT, GGCTAC, CTTGTA, ATCACG, CGATGT, TTAGGC és TGACCA) a multiplexelés lehetővé tétele érdekében. A termikus ciklushoz a touchdown PCR módszert alkalmaztuk egy GeneAmp PCR rendszerrel 9700 (ABI, Foster City, CA, USA). Minden PCR reakcióelegy (25 μL) 20 ng genomiális DNS-t, 2 × MightyAmp Buffer Ver.2 (Takara, Otsu, Japán), 0,25 μM minden primert és 1,25 egység MightyAmp DNS polimerázt (Takara, Otsu, Japán) tartalmazott. Minden egyes PCR-reakciót és az amplikonkészlet előkészítését a korábban leírtak szerint hajtottuk végre [14].
Mindegyik multiplexelt könyvtári készletet 12,5% -os phiX vezérléssel egészítették ki, hogy javítsák a bázis hívást a szekvenálás során, ahogy az Illumina két könyvtár összevonására ajánlotta [14]. A szekvenálást páros végű, 2 × 281 bp-os ciklus alkalmazásával hajtottuk végre egy Illumina MiSeq szekvenáló rendszeren és a MiSeq Reagent Kit 2. verziójú (500 ciklusú) kémiai módszerrel. Párosított szekvenálást hajtottunk végre 281 bp olvasási hosszúsággal. Demultiplexelés után egyértelmű átfedést figyeltünk meg a páros végű leolvasásokban. Ez az átfedés lehetővé tette a párosított olvasások összekapcsolását a fastq-join programmal (http://code.google.com/p/ea-utils/). A szekvenciák minőségi szűrésének módszere a következő volt: További elemzésekhez csak azokat az olvasmányokat vontuk ki, amelyek minőségi (QV) pontszáma ≥20 volt a szekvencia több mint 99% -ánál.
A Metagenome @ KIN szoftvert (World Fusion Co., Ltd., Tokió, Japán) használtuk a meghatározott 16S rDNS-szekvenciákkal történő homológiai kereséshez a TechnoSuruga Lab mikrobiológiai azonosító adatbázis DB-BA10.0 (TechnoSuruga Laboratory, Co., Ltd) ellen. ., Tokió, Japán), amely csak a taxonómiai nómenklatúrában álló baktériumokat tartalmazza [17,18]. A baktériumfajokat a DB-BA 10.0 97% -os hasonlósági szakaszának adatai alapján azonosítottuk [17,18].
2.4. Vérminták mérése
A vérmintákat egy éjszakai böjt (12 óra) után vettük. A plazma glükóz mérésére szolgáló vérmintákat minden pillanatban nátrium-fluoridot (NaF) és etiléndiamin-tetraecetsavat (EDTA) tartalmazó csövekbe gyűjtöttük; vérszérum inzulin, szérummentes zsírsavak (FFA) és szérum triglicerid (TG) vérmintáit véralvadás-gyorsítót tartalmazó csövekbe gyűjtötték; és az inkretin vérmintáit dipeptidil-peptidáz-4 (DPP-4) gátlót (BD P800; Becton Dickinson, San Jose, Kalifornia, USA) tartalmazó csövekbe gyűjtöttük. Ezeket a vérmintákat centrifugáltuk (3000 fordulat/perc, 20 perc, 4 ° C), és az összegyűjtött plazma- és szérummintákat az elemzésig -80 ° C-on tároltuk. A rövid láncú zsírsavak (SCFA) vérmintáit EDTA-t tartalmazó jéghűtésű csövekbe gyűjtöttük, és azonnal centrifugáltuk (3000 fordulat/perc, 10 perc, 4 ° C). Az összegyűjtött plazmamintákat azonnal folyékony nitrogénben lefagyasztották, és az elemzésig -80 ° C-on tárolták.
A plazma glükózszintet ultraibolya abszorpciós spektrofotometriával mértük a SRL, Inc., Tokió, Japán cégnél. A szérum inzulint kemilumineszcens enzim immunvizsgálattal határoztuk meg, SRL, Japán. A szérum FFA-t és a szérum trigliceridet enzimatikus kolorimetriás készletekkel és glicerin-3-foszfát-oxidáz módszerrel határoztuk meg, SRL, Japán. Az összes glükagonszerű peptid 1-et (GLP-1) humán totális GLP-1 (2. verzió) vizsgálati készlettel (K150JVC-1; Mesoscale Discovery, Gaithersburg, MD, USA) mértük; az összes glükózfüggő inzulininotróp polipeptidet (GIP) humán GIP (teljes) ELISA-val (EZHGIP-54K; Merck Millipore, Darmstadt, Németország) mértük. A plazma SCFA-t folyadékkromatográfiával mértük tandem tömegspektrometriával (LC-MS/MS) párosítva az LSI Medience Corporationnél, Tokió, Japán.
2.5. A légzési hidrogén elemzése
Az endtidális légzésmintákat alumínium tasakokba gyűjtötték a vérmintavételezéssel egyidejűleg a vastagbél fermentációjának mutató légzési hidrogén mérésére [10,11,19,20,21]. A légzési hidrogént egyszerű gázkromatográfiával (Breath Gas Analyzer BGA1000D) mértük a lejárati biokémiai táplálkozási anyagcsere Co., Ltd., Nara, Japán laboratóriumban [22,23].
2.6. Statisztikai analízis
A minta méretének kiszámítása egy korábbi vizsgálat alapján becsült 2,5 (lehelet hidrogén) standardizált hatásméreten alapult [10]. Öt mintaméret szükséges a 80% -os teljesítmény biztosításához, hogy ezt a különbséget kétfarkú szignifikancia szinten, 0,05-en észleljük.
Minden adatot átlagban fejezünk ki, szórással. A kenyérperiódus végén és a rizsperiódus végén lévő minták összehasonlítását páros t teszttel végeztük. Kétfarkú p 2) 21,0 ± 1,5 (18,6–23,1 tartomány) elemeztük. Valamennyi alany plazma glükóz és szérum inzulin normális határokon belül volt (91,2 ± 2,9 mg/dl, 5,2 ± 1,6 µIU/ml) (1. táblázat). A hét alany közül ötöt (két férfit és három nőt; átlagos (± SD) életkor 36,2 ± 3,9 év és BMI (kg/m 2) 20,4 ± 1,3) elemeztek plazma SCFA, lehelet hidrogén és bél mikrobiota szempontjából.
Asztal 1
A kiindulási alanyok jellemzői.
- Fehér kenyér vs fehér rizs - Az ítélet elfogyott; Clear Cut Fitness
- 2. típusú cukorbetegség diéta Barna kenyér vs fehér kenyér- itt a legjobb kenyér a cukorbetegek számára a vér csökkentésére
- Az állítás, hogy a fűszeres ételek fokozzák az anyagcserét - The New York Times
- Az aszalt szilva hatása a széklet kimenetére, a bél tranzitidejére és a gasztrointesztinális mikrobiotára A randomizált
- Mit; s A legegészségesebb rizs útmutató a barna, fehér, vad rizs, stb