A fiatal olasz autista gyermekek vizelet metabolomikája támogatja a kóros triptofán és purin anyagcserét
Absztrakt
Háttér
Az autizmus spektrum rendellenességet (ASD) továbbra is viselkedésmegfigyeléssel diagnosztizálják, a laboratóriumi biomarkerek hiánya miatt, ami nagyban segítheti a klinikusokat a korábbi és megbízhatóbb diagnózisok felállításában. Az emberi biofolyadékok metabolizmusa érzékeny eszközt jelent az ASD biomarkerként potenciálisan felhasználható metabolitprofilok azonosítására. Az első metabolomikai vizsgálatok, amelyek az ASD és a kontroll személyek vizeletét és plazmáját elemezték, arra utaltak, hogy az autista betegeknél előfordulhat, hogy egyes anyagcserezavarok vannak, annak ellenére, hogy a technika, az etnikai hovatartozás, az életkor és a „kontroll” státus meghatározása különbségekből fakad.
Mód
Az ASD-specifikus vizelet metabolomikus mintázatát korai életkorban vizsgálták 30 ASD gyermeknél és 30 egyeztetett kontrollnál (2–7 éves korosztály, M: F = 22: 8) hidrofil interakciós kromatográfia (HILIC) -UHPLC és tömegspektrometria alkalmazásával, egy nagyon erősen érzékeny, pontos és elfogulatlan megközelítés. A metabolitokat ezután többváltozós statisztikai elemzésnek vetettük alá, és anyagcsere út szerint csoportosítottuk.
Eredmények
A fiatal ASD és a kontroll gyermekek között a legnagyobb különbségeket mutató vizelet-metabolitok a triptofán és a purin metabolikus útvonalaihoz tartoztak. Emellett a B6-vitamin, a riboflavin, a fenilalanin-tirozin-triptofán bioszintézise, a pantotenát és a CoA, valamint a pirimidin metabolizmusa jelentősen eltért. Az ASD-s gyermekek a triptofánt előnyösen átalakítják xanthurénsavvá és kinolinsavvá (a kinureninút két katabolitja), a kinurénsav és különösen a melatonin rovására. Ezenkívül a bél mikrobioma hozzájárul a megváltozott triptofán anyagcseréhez, megnövekedett indolil-3-ecetsavat és indolil-laktátot eredményezve.
Következtetések
A fiatal olasz autista gyermekek legjellegzetesebb metabolikus útjai nagyrészt átfedik azokat, amelyek az anya immunaktiválását vagy genetikai manipulációkat követően az ASD rágcsálómodelljeiben találhatók. Ezek az eredmények összhangban vannak a purin-vezérelt sejtveszélyre adott válasz javaslatával, amely az epileptogén és az excitotoxikus kinolinsav túltermelésével, a melatonin szintézisének jelentős csökkenésével és a bél dysbiosisával jár együtt. Ezek az anyagcsere-rendellenességek számos, az ASD-hez társuló társbetegség hátterében állhatnak, például rohamok, alvászavarok és gyomor-bélrendszeri tünetek, és hozzájárulhatnak az autizmus súlyosságához. Diagnosztikai érzékenységük, betegség-specifitásuk és interetnikus változékonyságuk további vizsgálatokat igényel.
Háttér
Az autizmus spektrum rendellenessége (ASD) a neurodevelopmentális állapotok rendkívül heterogén gyűjteményét jelenti, amelyet szociális és kommunikációs hiányosságok, sztereotip és merev viselkedési minták, korlátozott érdeklődési körök és szokatlan érzékszervi feldolgozás jellemez, amelyek kora gyermekkorban jelentkeznek [1]. Az autizmus elterjedtsége az elmúlt két évtizedben jelentősen megnőtt: 2–5/10 000 gyermekről 1:68 gyermekre [2, 3]. A diagnosztikai kritériumok megváltozása és az orvosi közösség fokozott figyelme minden bizonnyal hozzájárult ehhez a tendenciához [4]. Ugyancsak kimutatták, hogy a fogamzáskor növekvő szülői életkor ASD kockázatot jelent [5], valamint néhány környezeti tényezőt, különösen a prenatális/korai posztnatális neurodevelopment kritikus időszakaiban [6]. Végül, a genetikai fogékonyság komplex és heterogén alapokon keresztül kiemelkedő szerepet játszik az ASD patogenezisében, a teljes behatolással felruházott ritka variánsoktól kezdve a közös változatokig, amelyek mindegyike magyarázza a teljes fenotípusos variancia nagyon kis hányadát, akár önmagában, akár gén × környezet interakciók révén [7, 8].
Az ASD patofiziológiájának megértésében elért jelentős előrelépések ellenére ez a bonyolultsági szint és az egyének közötti heterogenitás nagymértékben akadályozta a tudományos ismeretek hatékonyabb klinikai gyakorlatokká való fordítását. Az ASD-t továbbra is kizárólag megfigyelés, standardizált viselkedési skálák és szülői interjúk segítségével diagnosztizálják; Az ASD gyermekek fejlődési pályáit rendszeresen figyelemmel kísérjük, de különösen korai életkorban nem lehet megbízhatóan megjósolni őket. A laboratóriumi, agyi képalkotó és/vagy elektrofiziológiai technikákkal mérhető érzékeny és specifikus kvantitatív biomarkerek nagymértékben segíthetik a klinikusokat a korábbi diagnózis felállításában, a viselkedési beavatkozási programok időben történő továbbításában és a bizonyítékokon alapuló prognosztikus előrejelzésekben [9].
Figyelembe véve ezeket a módszertani kérdéseket, annak érdekében, hogy maximalizálhassuk a vizeletanyagcsere-minták különbségeinek megbízható felismerésének valószínűségét, az autista és független, jellemzően fejlődő, 2–8 éves gyermekekre összpontosítottunk, szorosan illeszkedve életkoruk, nemükhöz, olasz származásukhoz és városukhoz. országon belüli származás [20]. Az emberi sejtek és a bél mikrobiomja által generált molekulákat tartalmazó vizeletminták széles körű metabolit-kimutatási lefedettségének biztosítása érdekében hidrofil kölcsönhatás-kromatográfiát (HILIC) -LC-elektrospray-ionizációt (ESI) -MS alkalmaztunk, amely technológia különösen alkalmas az egyszerű sejtek elkülönítésére. és szénhidrátok, aminosavak, glikozidok és más természetes poláris termékek keverékei biológiai folyadékokban, például emberi vizeletben és plazmában [26, 27]. Ezt a kísérleti megközelítést alkalmazva kiderült, hogy a vizelet metabolitjai, amelyek leginkább megkülönböztetik az autistát a tipikusan fejlődő gyermekektől, elsősorban a triptofán és a purin metabolikus útvonalába esnek.
Mód
Tárgyak
Harminc idiopátiás ASD-s gyermeket és harminc tipikusan fejlődő kontrollt vettek fel Közép- és Észak-Olaszországban. Ezek képviselik a vizeletvizsgálat szempontjából értékelt 64 és 3–7 éves kontroll esetek túlnyomó részét o-krezol előző tanulmányunkban [20]. Demográfiai és klinikai jellemzőiket az 1. kiegészítő fájl foglalja össze: S1. Táblázat. A diagnosztikai értékeléseket és az orvosi szűréseket korábban leírták [20] (lásd még a 2. kiegészítő fájlt kiegészítő módszerekkel). Szigorú nem- és életkor-egyeztetést alkalmaztak (± 1 év) a klinikai/tudományos személyzet utódai között tipikusan fejlődő, nyilvánvaló ASD-tünetektől mentes gyermekek toborzásához [20]. Az esetek és a kontrollok átlagéletkora (± SEM) 4,83 ± 0,30 és 5,03 ± 0,32 év volt (Student's t = −0,459, 58 df, P = 0,648, ns), és az M: F arány 22: 8. Minden eset és kontroll olasz származású volt, és földrajzi terület vagy származási város szerint egyeztetett.
Vizeletgyűjtés és metabolitkivonás
Az első reggeli vizeleteket a szülők tartósítószerekkel kezeletlen steril tartályok segítségével otthon gyűjtötték össze, és ugyanazon reggel vizes jégen minden klinikai központba szállították. A vizeletmintákat ezután lefagyasztották, szárazjégbe szállították, és az elemzésig folyamatosan -80 ° C-on tárolták.
A vizelet fajsúlyát refraktometriával mértük 13 000-es centrifugálást követőeng 10 percig), korábban LC-MS minőségű vízzel kalibrált digitális refraktométerrel (Euromex Clinical Digital Refractometer RD.5712, NL).
A vizelet alikvot részeit (200 μl) összekevertük 200 μl metanol: acetonitril: víz (50:30:20) elegyével, 30 percig vortexeltük 4 ° C-on maximális sebességgel, majd 16 000-nél centrifugáltuk.g 15 percig 4 ° C-on. A felülúszókat összegyűjtöttük metabolomikus elemzés céljából. A minőségellenőrzéseket (QC) az összes vizeletminta 10 μl-es alikvotumainak egyesített keverékéből nyertük, és ezeket 15 mintánként elemeztük.
HILIC-UHPLC
A metabolit szétválasztást a korábban leírt módon [28] hajtottuk végre, hidrofil interakciós kromatográfiával (HILIC) Ultimate 3000 Rapid Resolution HPLC rendszer (Dionex, Sunnyvale, CA) felhasználásával, bináris szivattyúval és vákuumgáztalanítóval, jól lemezt tartalmazó automatikus mintavevővel hatos portos mikrokapcsoló szelep és egy termosztátos oszloptér. Phenomenex Luna 3 μm HILIC 200 A (150 × 2,0 mm) oszlopot, amelyet HILIC 4 × 2,0 mm ID védőoszlop (Phenomenex, Torrance, CA) védett, alkalmaztunk a metabolit szétválasztására a B-fázis A szakaszában. 35 percig tartó gradiens. A HILIC elválasztásához az „A” mozgófázis 50 mM ammónium-acetátból áll, amelyet acetonitrillel (95: 5) keverünk., v/v), míg a „B” eluens 50 mM ammónium-acetát: víz és acetonitril (95: 5) keverékéből állt., v/v). Acetonitrilt, hangyasavat és HPLC minőségű vizet a Sigma-Aldrich-től (St. Louis, MO) vásároltak.
Tömegspektrometria
Az MS elemzését egy elektrospray hibrid quadrupol repülési időtartamú MicroTOF-Q (Bruker-Daltonik, Bremen, Németország) műszeren végeztük, amely ESI ionforrással volt felszerelve, a korábban leírtak szerint [29]. A metabolitokkal kivont minták tömegspektrumát pozitív és negatív ion módokban is megszereztük; csak a negatív módban előállított adatokat mutatják be, mert erősebbek a vizeletminták elemzésében. Az ESI kapilláris feszültségét 4500 V (-) ion módban állítottuk be. A folyékony porlasztót 27 psi-re állítottuk, és a nitrogént szárító gázt 6 l/perc áramlási sebességre állítottuk. A száraz gáz hőmérsékletét 200 ° C-on tartjuk. Az adatokat centroid módban tároltuk, és 50–1200 tárolt tömegtartomány mellett gyűjtöttük őket m/z. A műszer kalibrálását minden nap külsőleg végeztük 10 mM nátrium-hidroxiddal 50% izopropanol: víz, 0,1% hangyasav oldatban. Automatikus belső tömegmérleg kalibrálást végeztek a kalibrációs oldat közvetlen automatizált injektálásával minden egyes menet elején és végén egy hatportos terelőszeleppel.
Adatok kidolgozása és statisztikai elemzés
Az adatokat a vizelet fajlagos súlya normalizálta, mert az ASD gyermekeknél a kreatinin kiválasztása rendellenesen csökkenhet [30]. A replikátumokat mzXML fájlként exportálták és a MAVEN.52-en keresztül dolgozták fel (elérhető a http://genomics-pubs.princeton.edu/mzroll/index.php?show=index címen) [31]. Tömegspektrometriás kromatogramokat dolgoztunk ki a csúcsok összehangolására, a szülő- és fragmensionok illesztésére és összehasonlítására, valamint a kísérleti metabolit-azonosításra (a megfigyelt és a várható eredmények közötti 10 ppm tömegeltérési tartományon belül az importált Kyoto Encyclopedia of Genes and Genomes (KEGG) adatbázissal szemben). . A kinurenin, a melatonin és a triptofán tömegmeghatározási és MS/MS fragmentációs grafikonjainak reprezentatív példái a 3. kiegészítő fájlban: S1. Ábra. Többváltozós statisztikai elemzéseket végeztünk a teljes metabolomikai adatsoron a MetaboAnalyst 3.0 szoftver (http://www.metaboanalyst.ca) [32] felhasználásával, amely szintén felügyelet nélkül áttekintette az adatvariancia szerkezetét, és szórási ábrákat készített.
Az ortogonális részleges legkisebb négyzetekkel megkülönböztető elemzés (OPLS-DA), amely meghatároz egy prediktív modellt, amely leírja az adatkészlet közötti maximális kovariancia irányát (x) és osztálytagság (Y), majd az esetek és a kontrollok közötti metabolikus profilok közötti különbség maximalizálására használták [33, 34]. Az OPLS-DA-t az Excel többfunkciós bővítmény segítségével (Numerical Dynamics, Japán; http://www.numericaldynamics.com/) ortogonális jelkorrekcióval hajtottuk végre az eltolt metabolitkoncentrációkra, log10 transzformálva, központosítva és egységre méretezve variancia.
Az optimális modell teljesítményét a vevő működési jellemzőinek (ROC) görbe elemzésével és az érvényesítési adatsorral teszteltük, a MetaboAnalyst 3.0 szoftver segítségével (http://www.metaboanalyst.ca) [32].
Az egyes vizelet-metabolitok eset-kontroll kontrasztjai esetében a szignifikancia küszöbértéket nominális értéken tartották P
Eredmények
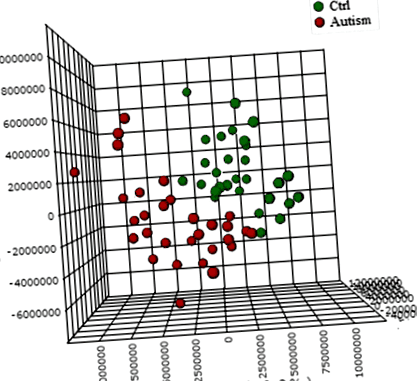
A fiatal autista és tipikusan fejlődő gyermekek vizelet metabolomjai nagyrészt megkülönböztethetőek az első három fő komponenst (PC) ábrázoló háromdimenziós OPLS-DA ábrán, amelyek együttesen a teljes variancia 31,4% -át magyarázzák (1. ábra; pontosság, Q2 és Az R2 adatok a 6. kiegészítő fájlban láthatók. Mintánként hozzávetőlegesen 10 000 csúcsot kaptunk a KEGG adatbázisra hivatkozva; közülük 202 metabolitot elemeztek és azonosítottak pontosabban. Az esetek és a kontrollok között a 25 legkülönbözőbb metabolitot tovább határoztuk a „változó befolyás a vetítésre” (VIP)> 1-es pontszámok alapján (2. ábra). A 25 metabolitkészlet felhasználásával végzett ROC elemzés AUC = 0,893 (95% CI 0,72–0,96) eredményt adott, amint azt a 7. kiegészítő fájl is mutatja. A metabolikus útelemzéssel (MetPA) kapott „metabolom áttekintés” a triptofán anyagcserét, a purin metabolizmusát, a vitamint mutatja. A B6 metabolizmus és a fenilalanin-tirozin-triptofán bioszintézis, mint az ASD négy legjobban zavaró metabolikus útja (3. ábra).
OPLS-DA 3D diagram, normalizált és átlagközpontú adatok alapján. Minden adatpont egyetlen egyén metabolomját képviseli. Egyes adatpontok egymásra helyezhetők
A kontrollok közül a 25 legjobban megkülönböztető metabolit ASD-eset, a vetítési (VIP) pontszámok változó fontossága és KEGG biokémiai útja szerint rangsorolva. A> 1,0-nél magasabb VIP-pontszámokat szignifikánsnak tekintették
Metabolikus út elemzési diagram. Színintenzitás (fehér nak nek piros) növekvő statisztikai szignifikanciát tükrözi, míg kör átmérője kovariák útvonalhatással. A grafikont a y tengely a −log o értékek az útgazdagodás elemzéséből és a x tengely a pálya topológiai elemzéséből származtatott hatásértékek
Tekintettel a triptofánból származó vegyületek sok idegi funkcióban betöltött jelentőségére, a triptofán metabolizmusát részletesebben értékelték a specifikus köztitermékek szintjén (4. ábra):
A kinurenin útvonal növekedést mutat a xanthurénsavban és főleg a kinolinsavban, a kinurénsav jelentős csökkenésével párhuzamosan (4. ábra, A út).
A szerotonin útvonal jelentős csökkenést mutat a melatoninban és katabolitjában lévő N-acetil-5-metoxi-triptaminban, amelyek azonos molekulatömegűek és így ugyanazon MS csúcs alá esnek (4. ábra, B út).
A triptofán baktériumbontása az ASD-ben, összehasonlítva a kontrollokkal, az indoxil-szulfát és más indol-származékok, köztük az indolil-3-ecetsav és különösen az indolil-laktát szembetűnően nagyobb vizeletkoncentrációja (4. ábra, C és D út).
A purin metabolizmusa jelentős diszkriminatív hatást közvetített, mivel az ASD esetek sok purin metabolit magasabb vizeletkoncentrációját mutatják a kontrollokhoz képest, beleértve többek között az inozint, a hipoxantint és a xantozint (5. ábra).
Vita
Következtetések
- Amikor a kisgyermekek túlsúlyosak, az iskolai szülők
- A világhírű Kígyóember sportember 22 évig van börtönben kisgyermekek elleni nemi bűncselekmények miatt
- Húgyúti fertőzések (UTI) a gyermekek Johns Hopkins orvostudományában
- Miért köp a babám ennyi anyatejet a Texas Gyermekkórházba?
- A mexikói őslakos iskolás gyermekek és fiatalok soványsága, túlsúlya és elhízása Annals of Human