A gemcitabin és az ínymasztix kombinációja hatásos növekedésgátlást és apoptózist okoz a hasnyálmirigyrák sejtjeiben
Xin-yu Huang
1 Sebészeti Osztály, a Hatodik Népi Kórház, Sanghaj Jiaotong Egyetem, Sanghaj 200233, Kína
Hong-cseng Wang
1 Sebészeti Osztály, a Hatodik Népi Kórház, Sanghaj Jiaotong Egyetem, Sanghaj 200233, Kína
Zhou Yuan
1 Sebészeti Osztály, a Hatodik Népi Kórház, Sanghaj Jiaotong Egyetem, Sanghaj 200233, Kína
Ang Li
2 Élettudományi és Technológiai Iskola, Tongji Egyetem, Sanghaj 200092, Kína
Mei-lan He
2 Élettudományi és Technológiai Iskola, Tongji Egyetem, Sanghaj 200092, Kína
Kai-xing Ai
1 Sebészeti Osztály, a Hatodik Népi Kórház, Sanghaj Jiaotong Egyetem, Sanghaj 200233, Kína
Qi Zheng
1 Sebészeti Osztály, a Hatodik Népi Kórház, Sanghaj Jiaotong Egyetem, Sanghaj 200233, Kína
Huan-hosszú Qin
1 Sebészeti Osztály, Sanghaj Jiaotong Egyetem, Hatodik Népi Kórház, Sanghaj 200233, Kína
Absztrakt
A gemcitabin és az ínymasztixis kombinációjának antiproliferatív és apoptotikus hatásainak, valamint az emberi hasnyálmirigy rákos sejtvonalak mögöttes mechanizmusainak vizsgálata.
Mód:
A sejtproliferációt és az apoptózist metil-tiazolil-tetrazolium (MTT) vizsgálattal, illetve propídium-jód festéssel vizsgáltuk. A Bcl-2, Bax, NF-KB p65 alegység és IκBα fehérje expresszióját Western-blot alkalmazásával mértük.
Eredmények:
A 0,01−100 μg/ml gemcitabin gátolta a sejtproliferációt és apoptózist indukált mind a hasnyálmirigyrák BxPC-3, mind a COLO 357 sejtekben. A 40 μg/ml mézgamasztix jelentősen felerősítette a 10 μg/ml gemcitabin antiproliferatív és apoptotikus hatásait 72 órás kezelés után. Amikor a sejteket gemcitabinnal és gumimasztikussal kombinálva kezeltük, az IκBα szint megemelkedett, míg az NF-KB aktivációja blokkolt volt; a Bax fehérje expressziója lényegesen megnövekedett, de a Bcl-2 fehérje alacsonyan szabályozott.
Következtetés:
A gemcitabin az ínymasztikussal kombinálva erős apoptózist okoz a hasnyálmirigyrák sejtjeiben. A kombináció hatékony terápiás stratégia lehet a hasnyálmirigyrák kezelésében.
Bevezetés
A hasnyálmirigyrák világszerte a negyedik vezető daganatos halálozási ok, egyéves túlélési aránya mindössze 10%, és a betegek csak 5% -a él túl öt évet 1. Az 5 éves túlélés a gyógyító reszekció után is csak 10–20% 2. A hagyományos kemoterápia és sugárterápia, akár önmagában, akár kombinációban, korlátozott hatást gyakorol a hasnyálmirigyrákban szenvedő betegek teljes túlélésére 3. Az elmúlt évtizedben számos terápiás szer elérhetősége ellenére a gemcitabin (2 ′, 2′-difluorodeoxycytidin) továbbra is a lokálisan előrehaladott és áttétes hasnyálmirigyrák 4, 5, 6, 7, 8 első vonalbeli kezelése. A gemcitabint egyetlen daganatellenes szerként vagy más citotoxikus szerekkel kombinálva alkalmazzák szilárd daganatokban, például petefészek-, nem kissejtes tüdő- és hasnyálmirigyrákokban 9, 10, 11. A gemcitabin hatékonysága azonban nem kielégítő 12, 13, és daganatellenes citotoxikus hatásainak javítása az elmúlt években nagy érdeklődést váltott ki.
Az ínymasztixot, a Pistacia lentiscus fák szárából és leveleiből nyert természetes gyantát évszázadok óta széles körben használják mediterrán és közel-keleti országokban, mind étrend-kiegészítőként, mind gyógynövényként. Orvosi vizsgálatok azt mutatják, hogy az ínymasztikusoknak citoprotektív vagy savcsökkentő hatása lehet a gyomor-bél rendszerre. Azt is beszámolták róla, hogy antioxidáns 14 és antibakteriális 15 aktivitással rendelkezik. Nemrégiben a sejtproliferáció és a sejtciklus progressziójának hatékony gátlójaként azonosították a humán prosztatarák 16, 17 sejtjeiben, valamint az apoptózis induktoraként a humán HCT116 vastagbélrákos sejtekben 18 .
Jelen tanulmányban a gemcitabin és az ínymasztixis kombinációjának antiproliferatív és apoptotikus hatásait és mechanizmusait vizsgáltuk emberi hasnyálmirigy-sejtvonalakban.
Anyagok és metódusok
Sejtkultúra
Humán BxPC-3 és COLO 357 (American Type Culture Collection, Manassas, VA, USA) hasnyálmirigy sejtvonalakat növesztettünk RPMI-1640-ben, illetve DMEM-ben, és kiegészítettük 10% hő-inaktivált szarvasmarha-magzati szérummal (FBS) 37 ° C-on. C 5% szén-dioxiddal. A sejteket hetente kétszer passzáltuk az exponenciális növekedés biztosítása érdekében.
Sejtproliferációs vizsgálat
3- (4,5-dimetil-tiazol-2-il) -2,5-difeniltetrazolium-bromid (MTT) vizsgálatokat végeztünk a sejtnövekedés és a sejtek életképességének értékelésére gemcitabinnal (Lilly, Franciaország) és/vagy gumimaszttal (Sigma) való kezelés után. (St Louis, MO, USA, G0878 sz.). A sejteket beoltottuk (BxPC-3, 1 × 104 sejt/üreg; COLO 357, 5 × 104 sejt/mélyedés) 96-lyukú lemezekre RPMI-1640-ben 10% FBS-sel 72 órán át 37 ° C-on, 5% -kal. CO2. MTT (Sigma Chemicals) reagenst (5 mg/ml) adtunk a sejtnövekedés kiértékelésekor, és az inkubálást további 4 órán át folytattuk. A reakciót lyukanként 150 μl dimetil-szulfoxiddal (DMSO, Sigma Chemicals) fejeztük be. Az abszorbancia értékeket ELISA olvasóval (Model 680, Bio-Rad) határoztuk meg 490 nm-en.
A sejt apoptózisának elemzése áramlási citometriával
A sejteket (4x105 sejt/üreg) oltottuk 6 lyukú lemezeken RPMI-1640 táptalajban 24 órán át. A táptalajt eltávolítottuk, a sejteket PBS-sel mostuk, majd gemcitabint (10 μg/ml) és/vagy gumimasztixot (40 μg/ml) adtunk hozzá. 48 óra elteltével a sejteket tripszinezzük és egy éjszakán át fixáljuk 70% jéghideg etanolban 4 ° C-on. Az áramlási citometriás elemzés előtt a rögzített sejteket centrifugáltuk, kétszer PBS-sel mostuk, és 5 μg/ml PI-t és 250 μg/ml RNáz A-t tartalmazó (PI Sigma Chemicals) PI-festőoldatban újraszuszpendáltuk. FACSCalibur áramlási citométer (FCM-500, Beckman Coulter) alkalmazásával a sejtciklus analízist minden mintán 10 000 sejten végeztük. A sejtciklus eloszlás számszerűsítését CellQuest szoftverrel végeztük.
Western blot elemzés
A sejtes lizátumokat 10% SDS-PAGE-vel elválasztottuk és elektrotranszferrel vittük át nitrocellulóz membránokra. Miután 5% zsírmentes tejjel blokkoltuk TBST-ben (20 mmol/l Tris, 150 mmol/l NaCl, 0,2% Tween-20, pH 7,6), a membránokat specifikus anti-NF-κB p65, anti-anti-N Bcl-2, anti-Bax, anti-IBBα vagy anti-β-aktin (Santa Cruz) antitestek szobahőmérsékleten 2 órán át, majd 1: 4000 tormaperoxidáz (HRP) -konjugált második antitesttel (Santa Cruz) 1 órán át. h. Az immunreaktív sávokat egy fokozott kemilumineszcens készlet segítségével (ECL, Santa Cruz Biotechnology Inc, USA) tettük láthatóvá. β-aktint használtunk a fehérje mennyiségének normalizálására a bloton.
Statisztikai analízis
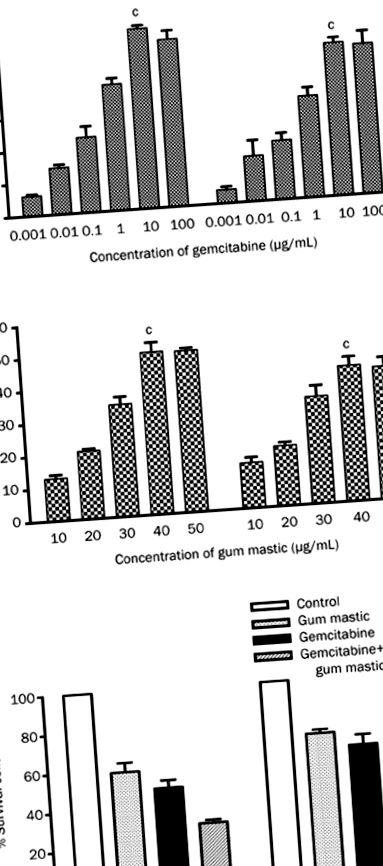
Minden kísérletet legalább háromszor hajtottak végre. Az adatokat adott esetben átlag ± SD-ként tüntettük fel, és a különbségeket Student t-tesztjeivel értékeltük. Az 1A. Ábra valószínűsége, hogy a sejtproliferációt gemcitabin vagy gumi masztix kezelés dózisfüggő módon gátolta. Összességében 10 μg/ml gemcitabin vagy 40 μg/ml gumimasztix okozta maximális 55,55% -os növekedésgátlást (P Az 1A. Ábra azt mutatja, hogy a természetes gyanta gumimasztix gátolhatja in vitro a hasnyálmirigyrák sejtjeinek növekedését. Ezt követően a hatás MTT vizsgálattal a sejtszaporodás során gemcitabinnal és gumimaszttal való együttes kezelést figyeltünk meg. A sejteket mind 10 μg/ml gemcitabin, mind 40 μg/ml gumimasztix jelenlétében tenyésztettük 72 órán keresztül. e két ágens esetében a sejtproliferáció sokkal nagyobb mértékben gátolt, mint bármelyik szer önmagában (P 1B ábra) .Ezek az eredmények arra utalnak, hogy a gemcitabin és az ínymasztix kombinációja hatásos növekedésgátlást vált ki.
A sejtszaporodás gátlása akár gemcitabinnal (0,01–100 μg/ml), akár gumimaszttal (10–50 μg/ml) önmagában (A) vagy kombinációval (B). Az 1B. Ábrán használt gemcitabin (10 μg/ml) és gumimasztix (40 μg/ml) koncentrációja az 1A. Ábra eredményén alapul. Az eredmények 3 független kísérletre vonatkoznak. c P 2. ábra: BxPC-3 sejtekben a sejtek 30,40% ± 3,477% és 31,37% ± 1,662% -a volt apoptotikus a gumimasztix csoportban, illetve a gemcitabin csoportokban. A COLO 357 sejtekben a sejtek 29,45% ± 1,750% és 30,07% ± 1,358% -a volt apoptotikus a két csoportban. Az egy ágenses kezeléshez képest a gemcitabin és a gumimasztix kombinációja sokkal nagyobb százalékban apoptózist eredményezett (BxPC-3, 45,13% ± 4,005%, P 5 sejt lyukanként) és COLO 357 sejteket (3 × 105 sejt/per vagy gemcitabinnal (10 μg/ml) vagy gumimaszttal (40 μg/ml) vagy kombinációval inkubáltuk. 48 óra elteltével a sejtek apoptózisát az Annexin V-PI kettős jelöléssel és FACS analízissel vizsgáltuk. b P c P 19, 20 kimutatták, hogy a hasnyálmirigy rákos sejtjeiben a gemcitabin indukálhatja az NF-κB aktiválódását. A kísérletet megismételtük, és ugyanazokat az eredményeket kaptuk (3A-3B. Ábra, 2. sáv). Annak kimutatására, hogy az ínymasztix BxPC-3 sejtproliferációra gyakorolt gátló hatását az NF-κB inaktiválása okozta-e, Western-blot-vizsgálatot végeztünk az NF-κB p65 fehérje expressziójának változásainak tesztelésére. Amint a 3B. Ábrán látható (3. sáv), a gumi masztix önmagában elnyomta az NF-KB expressziót. Ami a legfontosabb, hogy az ínymasztikussal való együttes kezelés gátolta a gemcitabin által kiváltott NF-KB aktivációt (3B. Ábra, 4. sáv). Hasonló jelenséget találtunk a COLO 357 sejtekben (3B. Ábra).
Az NF-κB aktiváció gátolható gemcitabinnal és gumimaszttal kombinált kezeléssel. (A) Western blot-analízis az NF-κB-re 10xg/ml gemcitabinnal kezelt BxPC-3 sejtek magkivonataiban különböző időpontokban. (B) Western blot-analízis mind az NF-KB p65 alegységre mind a BxPC-3, mind a COLO 357 sejtek magkivonataiban 48 órás kezelés után sejtközeggel (1. sáv), gumimasztix (2. sáv), gemcitabin (3. sáv) vagy ezek kombináció (4. sáv). Belső kontrollként a β-aktin fehérjét használtuk. Az NF-KB p65 fehérjeszintek denzitometriai mérését a belső kontrollra normalizáltuk, és relatív értékként fejeztük ki.
A gemcitabin kezelése gumimaszttal kombinálva csökkentette a Bcl-2 expresszióját, növelte a Bax expresszióját és megakadályozta az IκBα lebomlását.
A gemcitabin kezelése gumimasztikussal kombinálva megváltoztatja a Bcl-2, Bax és IκBα expresszióját. A Bcl-2, Bax és IκBα expresszióját Western-blot-analízissel analizáltuk. A BxPC-3 sejteket sejtközeggel, 40 μg/ml gumi maszttal, 10 μg/ml gemicitabinnal vagy ezek kombinációjával 48 órán át kezeltük. Belső kontrollként β-aktint használtunk. Ezen fehérjeszintek denzitometriai mérését a belső kontrollra normalizáltuk, és relatív értékként fejeztük ki.
Vita
Az elmúlt évtizedben a lokálisan előrehaladott és áttétes hasnyálmirigyrák kezelésének alapszere továbbra is a gemcitabin 21. Hatékonysága azonban gyakran korlátozott. Daganatellenes citotoxikus hatásának javítása és a hasnyálmirigyrák kezelésének új kezelési módjainak azonosítása érdekében megvizsgáltuk a gemcitabin és egy új szer, a gumimasztix kombinációjának hatását a sejtproliferációra, valamint az apoptózisra az emberi hasnyálmirigyrák sejtvonalaiban, és feltártuk a mechanizmust. ezekre a hatásokra.
A gyógyszer daganatellenes aktivitása a tumorsejtek proliferációjának gátlásával, a sejtek differenciálódásának elősegítésével és az apoptózis indukciójával jár együtt. A gumimasztix a Pistacia lentiscus fák természetes kivonata, és rákellenes tulajdonságait újonnan azonosították 16, 17, 18, 22. In vitro bizonyítottan az ínymasztikus gátolja a prosztatarák sejtjeinek növekedését és a vastagbélrák sejtjeinek apoptózisát váltja ki. Ebben a tanulmányban értékeltük az ínymasztix hatásait a hasnyálmirigyrák sejtjeiben. Megállapítottuk, hogy az ínymasztikumok in vitro antiproliferatív és apoptotikus hatással voltak az emberi hasnyálmirigyrák sejtjeire (BxPC-3). Ami a legfontosabb, hogy az ínymasztikumok szinergikusak voltak, amikor gemcitabinnal alkalmazták. Ezzel a két ágenssel egyidejű kezelés után a sejtek szaporodása nagymértékben elnyomódott, és a sejtek apoptózisának aránya szignifikánsan magasabb volt, összehasonlítva a bármelyik szerrel önmagában kezelt sejtekkel.
Hasonlóképpen, a BxPC-3 és COLO357 sejtvonalakban az NF-κB gumi masztix gátlása a gemcitabin fokozott apoptotikus hatásával járt együtt. Megállapítottuk, hogy amikor a sejteket gemcitabinnal és gumimasztixmal kezelték, az NF-KB p65 expressziója erősen elnyomódott, míg az IκBα expresszió növekedett. A Bcl-2 expressziója szignifikánsan csökkent, a Bax pedig felfelé szabályozott volt a kombinációs csoportban, összehasonlítva az egyedi szerkezeléssel és a kezeletlen kontrollal. Tehát feltételezhető, hogy a gumimasztix hozzáadása a gemcitabinhoz növelte az NF-KB jelátviteli út gátlását a sejtnövekedésen és a BxPC-3 sejtek apoptózisát. A megnövekedett IκBα expresszió gátolhatja az NF-κB expressziót és aktivációt, amely sejt apoptózist indukál. Az NF-κB útvonal gátlása lefelé szabályozott anti-apoptotikus Bcl-2-t, de felfelé szabályozta a pro-apoptotikus Bax expresszióját.
Ezért a gemcitabin az ínymasztikussal kombinálva a hasnyálmirigyrák sejtjeinek proliferációját és apoptózisát hatékonyan elnyomja. Azt azonban, hogy gyakori jelenség-e, több hasnyálmirigy-sejtvonal, például a PANC-1 29, 30 tesztelésével kell meghatározni. Eredményeink azt sugallják, hogy a gemcitabin és a gumimasztix együttes alkalmazása potenciális klinikai értékkel bír, és hatékony terápiás stratégiaként működhet a hasnyálmirigyrák klinikai kezelésében.
Szerző hozzájárulás
Xin-yu HUANG felügyelte a projektet és megtervezte a kísérleteket; Hong-cheng WANG, Zhou YUAN, Ang LI, Mei-lan HE és Kai-xing AI végezték a kísérleteket; Qi ZHENG és Huan-long QIN írta a lapot; Az LI kritikus átdolgozta a kéziratot.
- A gemcitabin és az ínymasztix kombinációja hatásosan gátolja a hasnyálmirigy növekedését és apoptózist okoz
- A növekedési hormon hiányának okai, tünetei; Diagnózis
- Gyarapodás elmulasztása Mi ez, mi okozza, hogyan kezelik és hogyan kell hozzáadni az allergia-barát
- Cervicitis tünetei, okai és kezelése
- Cervicitis okai, tünetei, kezelése Legjobb OBGYN Los