A genetikai kölcsönhatások feltérképezése a rákban: a racionális kombinált terápiákhoz vezető út
Absztrakt
Háttér
A teljes genom és az exomszekvenálás olyan programok részeként készített enciklopédiát, amelyek részt vesznek a rák kialakulásában és progressziójában, például a The Cancer Genome Atlas (TCGA) program részeként. Ezek a hősies erőfeszítések feltárták, hogy sok rákos sejt elrabolja a meghatározott aláírási rákpályákat megszerzett mutációk révén, amelyek aktiválják az onkogéneket vagy inaktiválják a tumorszuppresszorokat [1]. Mégis, ezek az erőfeszítések azt is bizonyították, hogy a különböző típusú rákok genetikai háttere rendkívül heterogén, ami nagyszámú pontatlan prognózissal és hatástalan kemoterápiás kezeléssel járó esetet eredményez. Célzott és ígéretes megközelítés a precíziós rákterápia, amelynek célja, hogy a kezelési rendet az egyes betegségek egyedi genetikai hátteréhez igazítsa. Ez a stratégia bizonyos mutánsok megcélzásán alapszik, amikor genetikai függőségüket kiaknázzák a tumorgenezisben, a kezelési válaszban és a gyógyszerrezisztencia kialakulásában szerepet játszó genetikai kölcsönhatások azonosításán és mechanisztikus jellemzésén keresztül.
Ebben a cikkben nemrégiben célzott, az egész genomot átfogó és nagy áteresztőképességű szűrővizsgálatokat tárgyalunk, amelyek kettős funkcióvesztést, kémiai – genetikai interakciót, valamint a génaktivációs és -gátlási módszerek kombinációit alkalmazták a releváns genetikai kölcsönhatások azonosítására. Áttekintjük a nagy áteresztőképességű genetikai interakciós szűrőkön használt klaszterezési és elemzési csővezetékeket is a generált adatok gyors rákkezelési terápiákká történő gyors fordítására. Továbbá javasoljuk, hogy a genetikai interakciós képernyők ortogonális kvantitatív megközelítésekkel történő kombinálása globális hálózatok létrehozása megkönnyítse a racionális kombinációs terápiák kialakítását.
A genetikai kölcsönhatások, mint terápiás célpontok a rákban
A PARP1 inhibitorok alkalmazása monoterápiában a BRCA-mutált rák demonstrálja, hogy a szintetikus-halálos képernyők mennyire hatékonyak lehetnek a gyógyszerfejlesztésben. Mégis, mint sok más terápiánál, a PARP1-gátlókkal szembeni rezisztencia előrehaladott betegségben is felmerül, ami arra utal, hogy a PARP1-gátlókkal történő kezelésre adott leghatékonyabb válaszok kiválthatók akár korai stádiumú betegségben, akár racionális gyógyszerkombinációk kifejlesztésével [16]. Mindkét probléma megoldása érdekében jelenleg számos klinikai vizsgálatban értékelik azoknak a terápiáknak a hatékonyságát, amelyek kombinálják a PARP1 inhibitorokat kemoterápiával vagy mutációspecifikus inhibitorokkal (ClinicalTrials.gov referencia NCT02576444) [17]. A PARP-gátló niraparibot platinaérzékeny petefészekrákban fenntartó terápiaként is tesztelték, tekintet nélkül BRCA1 állapot [18]. A progresszió nélküli túlélés medián időtartama szignifikánsan hosszabb volt a niraparibot kapó betegeknél. Ezek az eredmények, valamint az a megfigyelés, hogy a hám petefészekrákos betegek kb. 50% -a nem BRCA1 mutációk hibás homológ rekombinációt mutatnak, már jelzik ezen PARP inhibitor terápiák potenciális szélesebb körű elérését [19].
A nagyteljesítményű genetikai interakciós képernyők kidolgozása robusztus elemzéssel és fürtöző csővezetékekkel tehát elengedhetetlen az új, gyógyszeres szintetikus-halálos vagy más genetikai kölcsönhatások azonosításának felgyorsításához, valamint a kábítószer-szinergiák és az ésszerű kombinált gyógyszeres terápiák jobb előrejelzéséhez.
Rákmodellek emlős sejtekben és alkalmazásuk a rákellenes gyógyszerek felfedezésében
Az onkogenezist okozó kulcsfontosságú mozgató mutációk és a rákos sejtek terápiás válaszként történő újbóli bekötésében szerepet játszó tényezők nem tisztázottak. Ezeknek a funkcionálisan összekapcsolt utak boncolásának szisztematikus és nagy áteresztőképességű megközelítései klinikailag hasznosak lehetnek. A genetikai interakciók nagy áteresztőképességű platformon történő azonosítására irányuló legutóbbi erőfeszítések két gén kombinatorikus, páronkénti perturbációját tartalmazzák tömbben vagy egész genomban (2. táblázat). A mai napig a legelterjedtebb megközelítés a páronkénti génkiütés vagy a génkiütés és a gyógyszer gátlás kombinációja. Újabb és kevésbé feltárt megközelítés a génaktiváció és a géngátlás kombinálása, bár egy mutált gén aktiválása a klinikán jelenleg nem kivitelezhető.
Kettős funkcióvesztéses módszerek
Kémiai – genetikai kölcsönhatások feltérképezése
A kvantitatív kémiai-genetikai vizsgálatok, amelyekben egy vegyület általi gátlást kombinálnak egy gén leütéssel vagy kiütéssel, alternatívát jelentenek a páronkénti gén-zavaroknak [34, 35]. Például a 612 DNS-javító és a rák szempontjából releváns gén leütésének 31 kemoterápiás vegyületre adott válaszra gyakorolt hatásának vizsgálata kimutatta, hogy a funkcióvesztés mutációi ARID1A és GPBP1 hozzájárulnak a PARP-gátlóhoz és a platina rezisztenciához az MCF10A-ban, egy nem tumorigén emberi emlő hámsejtvonalban [34]. Ez az eredmény ellentétben áll egy másik kémiai-genetikai szűrővizsgálat eredményeivel, amelyek során izogén ARID1A-hiányos MCF10A sejteket vizsgáltak kemoterápiás gyógyszerek és DNS-javítás gátlók csoportjával szemben [36]. Ez a képernyő az ARID1A-hiányos sejtek fokozott érzékenységét jelezte az ionizáló sugárzás és a PARP gátlás kombinációjával szemben [36]. Inaktiváló mutációk a ARID1A az emberi rákos megbetegedések több formájában is kimutatták. Az ARID1A az SWI/SNF kromatin-átalakító komplexum egyik összetevője, és szerepet játszik a nem homológ végcsatlakozásban (NHEJ), ami azt sugallja, hogy ez a PARP inhibitorokra és a kombinált terápiákra adott válasz fontos modulátora lehet.
A genetikai kölcsönhatások irányultságának feltérképezése
A genetikai interakciós módszerekkel nyert funkcionális és moduláris adatok nem elégségesek az irány- és szabályozási függőségekről. Az ortogonális megközelítéseket, amelyek beépíthetők a genetikai interakciós adatokkal e korlát leküzdésére, a következő szakaszokban tárgyaljuk. Erre a hiányosságra számos tanulmány foglalkozott. Például a Drosophila sejtek szabályozási és időbeli irányultságát matematikai modellezéssel és a differenciális genetikai interakciók időfüggő elemzésével vezették le [50, 51].
A robusztus elemzési folyamat szempontjai
Az emberi sejtekben végzett nagymértékű genetikai hálózat feltérképezéséből származó funkcionális adatok következtetéséhez robusztus és alapos adatelemzési folyamatokra van szükség. Ebben az összefüggésben egy adatelemzési munkafolyamat figyelembe veszi a kísérleti tervezés, a minőségellenőrzés és a matematikai pontozás szempontjait. A legkorábbi tanulmányok a genetikai interakciós térképezés használatáról a fehérjekomplexek funkcióinak boncolására E-MAP-kat használtak élesztőben [47, 53, 54], amint azt korábban említettük. Ezek a tanulmányok meghatározták a kísérleti tervezés alapvető szabályait a találatok izolálásához és egy megbízható genetikai interakciós térkép felépítéséhez. Az adatok elemzéséhez használt számítási pontozási és klaszterezési algoritmusok statisztikai elemzéseket tartalmaznak az egyes genetikai kölcsönhatások erősségéről, a replikátumok közötti korrelációról és a biológiai komplexek csoportosulásáról [55]. Hasonló számítási pontozási algoritmusok alkalmazhatók emlős rendszereken is.
Emlős rendszerekben számos nagy áteresztőképességű genetikai interakciós szűrővizsgálatot végeztek célzott megközelítés alkalmazásával, némi előzetes ismerettel a gének interakciós hálózatairól vagy a vizsgálandó utakról [30,31,32, 34, 49]. Ez a fajta megközelítés csökkenti a zajt és minimalizálja az adatokban a hamis negatív lehetőségeket, lehetővé téve az enyhébb fenotípusok kimutatását. Annak ellenére, hogy ezek az enyhébb fenotípusok nem biztos, hogy jó célpontok a monoterápiában, nyomokat adhatnak a kombinatorikus gyógyszertervezéshez és a rákos sejtek funkcionális redundanciájához. A kombinatorikus gyógyszerfelfedezés ígéretes stratégiája a kompenzációs utak megcélzása a funkcionális redundanciák blokkolására. A jelenlegi módszerekkel a genom egészére kiterjedő trigén kölcsönhatás feltérképezése nem triviális, de ezek az enyhébb fenotípusok felhasználhatók a kombinatorikus gyógyszerek céljelöltjeinek előrejelzésére, és kombinatív, trigén összefüggésekben tesztelhetők [56]. A célzott képernyőkhöz képest a genom egészére kiterjedő elemzés lehetővé teszi a genetikai interakciók elfogulatlan meghatározását a fizikai vagy funkcionális hálózatok előzetes ismerete nélkül [45, 57, 58]. A genom egészére kiterjedő képernyők váratlan kölcsönhatásokat tárhatnak fel a korábban nem jellemzett génpárok között (2. táblázat).
Bármely CRISPR-Cas9 alapú genetikai interakciós elemzés három fő szempontot tartalmaz. Először is, a különböző sgRNS-ek által biztosított szerkesztési hatékonyságban heterogenitás figyelhető meg. Ez a megfontolás CRISPR-Cas9 alapú képernyőkre vonatkozik, tömb formátumban vagy összevont könyvtárként. Amellett, hogy minden egyes megcélzott génhez legalább három sgRNS-t használnak, a génszerkesztési hatékonyság kvantitatív értékelését el kell végezni tömbös kiütési kísérletekben, olyan eszközök alkalmazásával, mint a TIDE (Indels követése bomlás útján) vagy az ICE (a CRISPR szerkesztéseinek következtetése) elemzésével. Sanger szekvenálás [59,60,61]. Amint az egyes sgRNS-ek génszerkesztési hatékonysága meg van erősítve, a genotípus – fenotípus korreláció tömb formátumban egyenesen halad. Összehasonlításképpen: a genom egészére kiterjedő összesített képernyők elemzése a következő generáció-szekvenálás (NGS) technológiák használatát igényli a genotípus – fenotípus korrelációhoz.
A második szempont a sejtvonal variabilitása. A Cancer Genome Atlas (TCGA) adatkészlet azt jelzi, hogy a daganatok 89% -a, 33 ráktípus esetén, legalább egy szomatikus hajtómű-változást tartalmaz tíz olyan kánonikus jelátviteli útvonalban, amelyekről ismert, hogy a rákban erősen mutálódnak [1]. Ezek az adatok a különböző ráktípusok közötti közös vonásokat mutatják be. Mégis, a betegség prognózisának és a rákos gyógyszer-érzékenységre vonatkozó előrejelzések rendkívül pontatlanok az egyes daganatok eltérő mutációs tája miatt. Például egy nemrégiben készült tanulmány azt sugallta, hogy a daganat törzs meghatározza, hogy a mutációk BRCA1 és BRCAA 2. ábra nélkülözhetetlen alapító esemény vagy biológiailag semleges esemény a tumorgenezishez [62]. Ezenkívül a különböző sejtvonalak genomiális kópiájának számát javasolták a CRISPR célzás és a toxicitás befolyásolására a genom szerkesztése után [63, 64]. Ezek a megfigyelések jelzik a funkcionális interakciós képernyők többféle sejtvonalban történő végrehajtásának fontosságát, nemcsak a robusztus szintetikus letális vagy más interakciók, hanem a célzottabb precíziós kezelési lehetőségek azonosítása érdekében is.
Harmadszor, figyelembe kell venni a gyógyszeradagolást és az időzítést. Fontos, hogy a fenotípust a gyógyszeres kezelés során mérő képernyőknél a kísérletek dinamikus tartománya nagymértékben függ a gyógyszer koncentrációjától és a kezelés időtartamától. Boettcher és mtsai. [52] kimutatta, hogy egyetlen kezeléssel összehasonlítva az ismételt gyógyszeres kezelés lehetővé teheti a rezisztencia gének nagyobb dúsulását. A kijelölt szempontokat figyelembe vevő kemogenetikai interakciók profilozásához bevezették a drugZ pontozást, mint szoftveres eszközt mind a szinergikus, mind a szuppresszor kölcsönhatások azonosítására [35, 65].
A genetikai interakciós képernyők kombinálása az ortogonális kvantitatív megközelítésekkel globális hálózatok létrehozásához
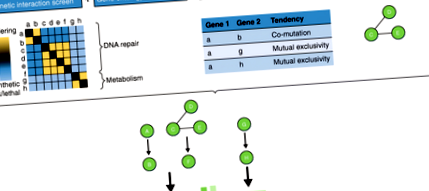
A funkcionális-interakciós térképészeti vizsgálatok egyik fő célja a gén-asszociációs vizsgálatok felemelése a fenotípusokkal összefüggő egyes gének azonosításától az értelmezhető genetikai információk nyújtásáig az érintett biológiai útvonalakon. Ezenkívül fontos a funkcionális interakciók és a fizikai interakciós modulok kombinálásának képessége a globális interakciós hálózatok kiépítése érdekében a rákos differenciálmutációk hatásainak boncolgatásához. A nagy áteresztőképességű genetikai interakciós képernyők soha nem látott mennyiségű sejtspecifikus funkcionális genomikai adatot generálnak, amely segíthet a genetikai hálózatok feltárásában. A genetikai interakciós profilok a funkcionális hasonlóság kvantitatív mérését nyújtják. Ezek a térképek átfedhetők ortogonális megközelítéssel nyert különféle hálózati információkkal, hogy tovább tájékoztassák a funkcionális értelmezést és az új génfunkció előrejelzését (1. ábra) [67]. Ezek a megközelítések magukban foglalják a gén-ontológiai elemzést, valamint a beteg daganatok mutációs tájának elemzését, a génszabályozást és a fehérje-fehérje interakciót.
A genetikai interakciós képernyők hipotetikus integrálása ortogonális kvantitatív megközelítésekkel az utak azonosításának lehetővé tétele érdekében. Tól től bal nak nek jobb, a kísérleti csővezeték olyan, hogy a genetikai interakciókat pontozzák és csoportosítják azon gének azonosítására, amelyek potenciálisan részt vesznek azonos vagy párhuzamos, funkcionálisan releváns utakban és/vagy potenciális fehérjekomplexekben. Ezeket a géneket a Gene Ontology kifejezésekkel jegyzik fel [66]. Az érdekes gének mutációs tájait statisztikailag szignifikáns ko-mutáció vagy kölcsönös kizárólagosság szempontjából teszteljük. Ko-immunprecipitációs kísérletet végeznek azon fehérjék azonosítására, amelyek kölcsönhatásba lépnek a kérdéses gén által kódolt fehérjével. Az ezen ortogonális megközelítéssel nyert adatokat egyesítjük a biológiai útvonal levezetésére
Következtetések és jövőbeli irányok
Stratégia a racionális kombinációs terápiás tervezéshez. Az interakciók az 1. ábra útvonalán alapulnak. Az a génben a funkcióvesztés mutációja a rák kialakulásának hajtó mutációja. A hipotetikus eset szintetikus beteg kölcsönhatásra utal az a gén (amely részt vesz a DNS helyreállításában) és a g g (a sejtanyagcserében részt vevő) között. Tól től bal nak nek jobb, az f vagy g gén gátlása a rák (a -/-) hátterében szintetikus betegséget eredményez, de nem halálos. A szintetikus letalitás a rák hátterében csak az f és g gének (vagy az f és h gének) együttes gátlásával érhető el
A mai napig az emlős sejtekben végzett genetikai interakciós szűrők a differenciál gén kópiaszámra és az expressziós profilokra támaszkodtak a rákos sejtekben és a sejtproliferációs leolvasásokon. Mégis, a legtöbb daganat inkább egy mutáció, mintsem egy gén teljes hiánya miatt következik be [71]. A vezető mutációk és specifikus funkcióik megkülönböztetése megkönnyíti a célpályák felfedezését. Ezért a gén-interakciós szűrések elvégzése a célgének patogén mutáns verzióinak felhasználásával, nem pedig teljes génkiütésekkel lesz fontos a gyógyszerfejlesztés szempontjából.
A daganatok mutációs tájainak elemzése azt mutatja, hogy mindegyik daganat nagyszámú szomatikus mutációt hordoz magában. A globális hálózati elemzésből kiderülhet, hogy ezek a mutációk több hub eseményben összefognak, például fehérje kölcsönhatásban vagy transzkripciós szabályozásban. A genetikai interakciós adathalmazok integrálása az ortogonális kísérleti és számítási eszközökkel nyert más információforrásokkal kihívást jelent, és hatékony együttműködést igényel a molekuláris és a rákbiológusok, a számítási biológusok és a klinikusok között. Több csoport alakított ki ilyen együttműködési feltérképezési kezdeményezéseket emlős rendszerekben [73, 75, 82]. Végül ezek az erőfeszítések globális hálózati térképekhez vezetnek, amelyek lehetővé teszik a hatékony gyógyszer-cél kombinációk előrejelzését az egyes rákos sejtek hátterében.
- Az egészséges életmód választása segíthet a nőknek a genetikai emlőrák kockázati központjának leküzdésében
- Májrák kezelési lehetőségek; Fejlett terápiák CTCA
- Immunterápia a Melanoma Memorial Sloan Kettering Cancer Center számára
- Májbetegségek gyermekeknél Johns Hopkins Medicine
- Hatás - Interaktív virtuális prezentációk - Az elhízás orvosi percének kezelése - Belgyógyászat -