A gyorsétkeztetés által kiváltott alkoholmentes zsírmájbetegség korai védőhatást fejt ki az egerekben az acetaminofen-mérgezés ellen
Absztrakt
Háttér
Az acetaminofen (APAP) könnyen hozzáférhető és biztonságos fájdalomcsillapító. Túladagolása azonban az akut májkárosodás (ALI) leggyakoribb oka. Számos hajlamosító tényező járul hozzá az APAP által kiváltott ALI iránti fogékonysághoz. Az alkoholmentes zsírmájbetegséget (NAFLD), amely a krónikus májbetegség fő oka, az APAP által kiváltott ALI fontos előrejelzőjének tekintik, bár a pontos mechanizmus ellentmondásos. Ebben a tanulmányban a NAFLD APAP-indukálta ALI-re gyakorolt hatásainak tisztázására törekedtünk.
Mód
Két egércsoportot, a normál chow (NC) táplálékkal táplált és a gyorsétellel (FF) táplált egereket 14 héten át, két alcsoportra osztottuk: intraperitoneálisan vagy sóoldattal (NC-S és FF-S csoport), APAP (NC-A és FF-A csoportok). Biokémiai teszteket, szövettani elemzéseket, kvantitatív PCR-t és Western-blot-vizsgálatot végeztünk.
Eredmények
Alanin-aminotranszferáz (ALT) szint (199,0 ± 39,0 vs. 63,8 ± 7,4 NE/l, o
Háttér
Az acetaminofen (APAP) világszerte könnyen elérhető és általánosan alkalmazott lázcsillapító és fájdalomcsillapító gyógyszer [1,2,3]. Terápiás dózisán belül alkalmazva biztonságos; túladagolása azonban az akut májelégtelenség leggyakoribb (50%) oka az Egyesült Államokban és más nyugati országokban [2, 3]. Az APAP által kiváltott akut májkárosodás (ALI) dózisfüggő hepatocelluláris károsodás. Az APAP-ot a P450 enzimek, elsősorban a citokróm P450 2E1 (CYP2E1) metabolizálják, és N-acetil-o-benzokinon-imin (NAPQI). A NAPQI-t glutation (GSH) méregteleníti, és felhalmozódása GSH-kimerülést eredményez [4]. Ezenkívül ezt az eseményt mitokondriális diszfunkció, reaktív oxigénfajok (ROS) keletkezése és nekrotikus sejtpusztulás követi. Patológiailag az APAP által kiváltott ALI-t konfluens centrizonális nekrózis jellemzi [5]. Ennek kezelése általában korán jár N-acetilcisztein terápia és szupportív kezelés; egyes esetekben azonban sürgős májtranszplantációra van szükség [6].
Az alkoholmentes zsírmájbetegséget (NAFLD) az APAP által kiváltott ALI rizikófaktorának tekintik [7]. A NAFLD világszerte a lakosság 20–40% -át érinti [8, 9], és a májkal kapcsolatos morbiditás és halálozás egyik fő oka [10]. Az alkoholmentes steatohepatitis (NASH), a NAFLD súlyos formája, oxidatív stresszel jár, amelyek szintén súlyos APAP-indukálta ALI-t okoznak.
Az in vivo kísérletek azonban következetlen eredményeket szolgáltattak. A vizsgálatok többsége azt mutatja, hogy a NAFLD-vel rendelkező rágcsálók súlyos APAP-indukálta ALI-t fejlesztenek ki [11,12,13]. Ezzel szemben néhány tanulmány kimutatta, hogy a NAFLD-vel rendelkező rágcsálók rezisztensek az APAP által kiváltott ALI-val szemben [14, 15]. Ez az eltérés oka lehet a rágcsálófajok, a beadott APAP-dózis, az alkalmazási módszer és a NAFLD létrehozásának különbsége.
Számos módszert, például genetikai módosítást [11, 12] és különböző étrendeket [13, 14, 16] alkalmaztak a NAFLD állatmodelljeinek megalkotására. Az emberekben a NAFLD előfordulása megnőtt a gyorsétterem (FF) és a fruktóztartalmú italok fogyasztásának megnövekedése miatt [9]. Az FF étrend által kiváltott NAFLD rágcsáló modelljeit olyan diéták alkalmazásával hozták létre, amelyek utánozzák az emberi FF étrendet; ráadásul ezek a modellek különböznek a NAFLD korábban létrehozott állatmodelljeitől [17, 18]. Az FF-indukálta NAFLD állatmodelljét azonban még nem használták az APAP-indukálta ALI értékelésére.
Jelen tanulmány tisztázta a NAFLD korai hatásait az APAP által kiváltott ALI-re és meghatározta az alapmechanizmusokat. Tudomásunk szerint ez az első APAP-tal kapcsolatos vizsgálat, amely az FF diéta által kiváltott NAFLD egérmodelljével foglalkozik.
Mód
Állatkezelés
Biokémiai elemzés
A szérum alanin-aminotranszferáz (ALT), a glükóz és a koleszterin szintjét automatizált klinikai kémiai analizátorral (DRI-CHEM 4000i; FujiFilm, Tokió) vizsgáltuk. A szérum inzulin és a máj triglicerid szintjét kereskedelmi készletekkel mértük (Alpco, Salem, NH és Wako, Osaka, Japán).
Western blot elemzés
A CYP2E1 máj expressziója, a peroxiszóma proliferátor által aktivált gamma receptor (PPAR-γ), a nukleáris faktor-kappa B (NF-κB), az extracelluláris szignál által szabályozott kináz (ERK), a foszforilezett ERK (p-ERK), a foszforilezett térkép kináz kináz 4 (p-MKK4), foszforilezett c-Jun N-terminális kinázokat (p-JNK), p62, foszforilezett p62 (p-p62), a magfaktor eritroid 2-hez kapcsolódó faktor 2-et (NRF2), β-aktint határoztunk meg Western blottolás. Az egyes csoportok egereitől kapott, hasonló súlyú májmetszeteket lízispufferben homogenizáltuk és centrifugáltuk. A fehérjéket elektroforézissel különítettük el 4–12% gradiens Bis-Tris géleken; átvisszük a Hybond ECL nitrocellulóz membránokra; és immunblotoltuk anti-CYP2E1 (Abcam, Cambridge, UK), anti-PPAR-y (Cell Signaling, Danvers, MA), anti-NF-κB (Cell Signaling), anti-ERK (Cell Signaling), anti-p- ERK T202/Y204 (sejtjelzés), anti-p-MKK4 S257 (sejtjelzés), anti-p-JNK T183/Y185 (sejtjelzés), anti-p62 (sejtjelzés), anti-p-p62 S349 (sejtjelzés) ) és anti-NRF2 (sejtjelző) antitestek. Β-aktin elleni antitestet (Sigma-Aldrich) használtunk az egyenlő terhelés értékelésére.
Fordított transzkripció - kvantitatív polimeráz láncreakció
A reverz transzkripció-kvantitatív polimeráz láncreakció (RT-qPCR) elvégzéséhez az egér májából származó teljes RNS-t RNeasy Mini Kit (QIAGEN GmbH, Hilden, Németország) alkalmazásával extraháltuk. A komplementer DNS-t szintetizáltuk Superscript II enzimmel (Gibco/Invitrogen, Grand Island, NY), és elemeztük qPCR-t SYBR Green PCR Kit és TP800 Thermal Cycler Dice Real Time System (Takara Bio Inc., Otsu, Japán) segítségével. Minden adatot normalizáltunk az riboszómás L32-et kódoló génre kapott adatokhoz. A qPCR végrehajtásához használt összes primert az 1. kiegészítő fájl tartalmazza: S2. Táblázat. A génexpressziós különbségeket akkor tekintettük jelentősnek, ha az mRNS-szintek relatív aránya (RR) két csoport között nagyobb vagy egyenlő 1,5-vel.
Szövettani elemzés
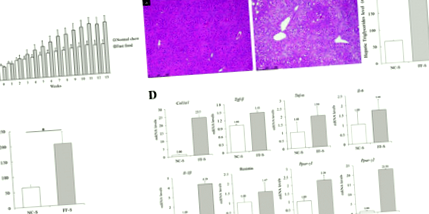
Az egyes csoportok egereinek májából kapott bal oldali lebeny hasonló méretű részeit 10% semleges pufferelt formalinban rögzítettük 24 órán át. Ezután a májrészeket levágtuk, körülbelül 5 μm vastag szakaszokra vágtuk, feldolgoztuk, és hematoxilinnal és eozinnal (H&E) [19] és Masson trichromfoltjával festettük. A terminális dezoxinukleotidil-transzferáz által közvetített dUTP nick-end label (TUNEL) vizsgálatot a máj szakaszainak In In Cell Cell Death Detection Kit, AP (Roche Diagnostics, Indianapolis, IN) festésével végeztük a gyártó utasításainak megfelelően [20]. A szövettani elemzést két tapasztalt patológus végezte vakon. A NAFLD súlyosságát a NAFLD aktivitási pontszámával értékeltük, amely steatosisból, ballonozásból és lobularis gyulladásból állt.
Statisztikai analízis
Az eredményeket átlag ± standard eltérés (SD) vagy az átlag standard hiba (SEM) formájában fejezzük ki, amint azt az ábra jelmagyarázata mutatja. A statisztikai különbségeket a Student's értékelte t-teszt, azzal o
Eredmények
A NAFLD megnyilvánulása
A 3 hétig FF diétával táplált egerek szignifikánsan jobban elhízottak, mint az NC táplálékkal három hétigo 1. ábra
A májmolekulák Western-blot-analízise. Minden csoportban bemutatták a máj gyulladásgátló és gyulladásos fehérjeinek szintjét. β-Actint használtunk az egyenlő fehérjetöltet igazolására
Az APAP által kiváltott ALI bemutatása
Az ALT-szintek magasabbak voltak az NC-A csoportban, mint az FF-A csoportban (8447,8 ± 1185,3 vs. 836,6 ± 185,1 NE/L, o 3. ábra
Az APAP metabolizmusához kapcsolódó enzimek szintje
Az uridin-difoszfát-glükuronoszil-transzferázt 1A1 (UGT1A1) és az UGT1A9-et kódoló gének mRNS-szintjei, amelyek a glükuronidációban kulcsfontosságú enzimek, nem különböztek szignifikánsan az egerek között az NC-S és az FF-S csoportokban (RR = 1,34 és 1,30; ábra 4A). A Western blot analízis eredményei magasabb CYP2E1 expressziót mutattak FF étrenddel táplált egerekben, mint NC egerekkel táplált egerekben (2. ábra).
Az APAP metabolizmusához és az oxidatív stresszhez kapcsolódó májmolekulák RT-qPCR-je. a A máj UGT1A1 és UGT1A9 kódoló gének relatív mRNS szintje. Ezek az mRNS-szintek nem különböztek szignifikánsan az egerek között az NC-S és az FF-S csoportokban. b Az NC-A és az FF-A csoportok között májmolekulákat kódoló gének relatív mRNS-szintje. A gyulladásos enzimek alacsonyabb szintjét és az antioxidáns enzimek magasabb szintjét mutatják be az FF-A csoportban
APAP-indukálta ALI-hez kapcsolódó molekulák
A Tribbles homolog 3 gén mRNS szintje (Törzs3), amely közvetetten tükrözi a GSH kimerülését [21], magasabb volt az egereknél az NC-A csoportban, mint az FF-A csoport egereiben (RR = 1,82; 4B. ábra). A TNF-a, IL-6, IL-1β és p21 kódoló gének mRNS-szintje magasabb volt az NC-A csoport egereiben, mint az FF-A csoportban (RR = 2,06, 3,21, 2,30 és 1,68, illetve). A Western blot analízis eredményei magasabb NF-κB, p-ERK, p-MKK4 és p-JNK expressziót mutattak ki az NC-A csoportba tartozó egerek szövethomogenátumaiban, mint az FF-A csoportba tartozó egereknél (2. ábra ), jelezve a májban a fokozott proinflammatorikus jeleket. Ezzel szemben a PPAR-γ, cyclin-D1, GPX2 és GSTM1-et kódoló gének mRNS-szintje alacsonyabb volt az egereknél az NC-A csoportban, mint az FF-A csoportban lévő egereknél (RR = 0,45, 0,43, 0,53 és 0,66, 4B ábra). A Western blot analízis eredményei magasabb PPAR-γ, p62, p-p62 és NRF2 expressziót mutattak az FF-A csoportba tartozó egerek szövethomogenátumaiban, mint az NC-A csoportba tartozó egerekben (2. ábra), ami arra utal, hogy fokozott antioxidáns válasz és gyulladáscsökkentő jelek. Ez védelmi hatást fejthet ki az APAP ellen.
Vita
Ebben a vizsgálatban a NAFLD-t sikeresen létrehozták egerekben azáltal, hogy 14 hétig fruktózzal kiegészített FF-étrendet adtak be. A vérminták biokémiai elemzése hiperkoleszterinémiát, magas éhomi szérum glükózszintet és inzulinrezisztenciát mutatott az FF-S csoportba tartozó egerekben. A szövettani elemzés nagyfokú steatosisra és lobularis gyulladásra, valamint magas NAFLD aktivitási pontszámra utalt az FF-S és az FF-A csoportokban. Az RT-qPCR eredményei kimutatták a fibrózist kódoló gének, valamint a gyulladásos markerek és lipidmodulátorok, például a PPAR-y megnövekedett mRNS-szintjét. A Western blot elemzés eredményei a gyulladásos és metabolikus markerek markáns expresszióját is kimutatták. Ezek az eredmények azt mutatják, hogy a fruktózzal kiegészített FF étrend rövid távú beadása indukálta a NASH és a metabolikus szindróma kialakulását.
Sőt, azt tapasztaltuk, hogy az NC-A csoportban az egerek magasabb ALT-szintet, szélesebb nekrotikus területet és magasabb DNS-fragmentáció mértéket mutatnak, mint az FF-A csoport egerei. Ezek az eredmények azt mutatják, hogy az APAP által kiváltott ALI kevésbé súlyos volt a NAFLD-vel rendelkező egerekben, és összhangban vannak számos korábbi vizsgálat eredményeivel [14, 15]. Ezt követően elemzéseket végeztek a NAFLD APAP-indukálta ALI-re gyakorolt hatásainak hátterében álló mechanizmusok meghatározására.
Az APAP glükuronidálás és szulfatálás után CYP2E1 által katalizált oxidáción megy keresztül, ami NAPQI termelést eredményez [4]. Az UGT1A1 és UGT1A9 kódoló gének mRNS szintje nem volt szignifikáns különbség az NC-A és az FF-A csoportok között. Azonban a máj CYP2E1 szintje megnőtt az FF étrenddel táplált egerekben, ami NAPQI képződést és APAP indukálta ALI-t okozhat. Ezért ez a metabolikus mechanizmus nem lehet oka a jelen tanulmány ALI eredményeinek, amelyek súlyos APAP-indukálta ALI-t mutattak ki az egerekben az NC-S csoportban.
A NAPQI-t máj GSH méregteleníti. A túlzott mennyiségű NAPQI azonban nem méregteleníthető, ami májkárosodást, mitokondriális diszfunkciót és nekrózist eredményez [4]. Törzs3 Az mRNS szint szignifikánsan megnőtt az egerekben az NC-S csoportban, ami fokozott GSH kimerülést jelez. Ez az oxidatív stressznek és az oxidatív stresszre adott válaszban részt vevő több molekulának tulajdonítható [22].
Az NRF2, egy transzkripciós faktor, védő hatást fejt ki a különböző szerek által kiváltott hepatotoxicitással szemben [23]. Ráadásul aktiválása részt vesz a GSH előállításában [24]. Normál körülmények között az NRF2 kötve marad a KEAP1-hez a citoszolban. Oxidatív stressz jelenlétében azonban az NRF2 leválik a KEAP1-ről és bejut a sejtmagba, hogy szabályozza az antioxidáns válaszelemet tartalmazó gének transzkripcióját a promoter régióiban [25]. Az NRF2 szabályozza a géneket, többek között Gclc, Gclm, Ho-1, Gstm1, Gpx2, és Nqo-1. Jelen tanulmány kimutatta, hogy a mRNS szintje Gpx2 és Gstm1 szignifikánsan magasabbak voltak az FF-A csoport egereiben, mint az NC-A csoportban (RR = 1,90, illetve 1,51), ami azt jelzi, hogy az NRF2 aktiváció védte az FF-A csoport egereit az APAP által kiváltott hepatotoxicitástól. Ismert, hogy számos molekula, például a p62 és a PPAR-y aktiválja az NRF2-t [24,25,26,27].
A gyulladáscsökkentő hatást kifejtő PPAR-y expressziója [28, 29] fokozódott az FF-étrendet tápláló egerekben. Ez az eredmény összhangban van a korábbi vizsgálatok eredményeivel, amelyek enyhe PPAR-γ-expressziót mutattak ki a normál májban, de fokozott PPAR-γ-expressziót kövér betegek vagy NAFLD-s betegek májában [30, 31]. Számos tanulmány kimutatta, hogy a PPAR-y aktiváció enyhíti az APAP által kiváltott ALI-t [32, 33]. Az APAP által kiváltott ALI elleni PPAR-γ aktivációnak ezek a védőhatásai összefüggenek az antioxidáns enzimek, például a GPx és a GST emelkedésével, amely összhangban áll az mRNS szint eredményeinkkel. Ezenkívül ezeket a megfigyeléseket a máj nikotinamid-adenin-dinukleotid-foszfát-oxidáz, ERK és NF-KB expressziós szintjének változásával is magyarázták. Jelen tanulmányban alacsony p-ERK, NF-κB, p-MKK4 és p-JNK szintet is kimutattunk az FF-A csoportba tartozó egerekben, amelyek magas PPAR-γ szintet mutattak az APAP által kiváltott oxidatív hatásra reagálva. feszültség. A PPAR-y gyulladáscsökkentő hatása az IFN-y downregulációjának is tulajdonítható, mivel a PPAR-y gátolja az IFN-y promoter c-Jun által közvetített aktivációját [34, 35]. Az IFN-y fő szerepet játszik az APAP által kiváltott ALI immunválaszában [36, 37]. Ezek a megállapítások azt mutatják, hogy a PPAR-y csökkentette az immunválaszt az egerekben az FF-A csoportban.
A D1 ciklint kódoló gén mRNS-szintje, amely elősegíti a G1-S fázisú sejtciklus progresszióját, megnőtt az egerekben az FF-S és az FF-A csoportokban. Ezenkívül a p21-et, egy erős ciklin-függő kináz (CDK) gátlót kódoló gén mRNS-szintje alacsonyabb volt az FF-A csoport egereiben, mint az NC-A csoportban. A P21 túlexpressziója gátolja a CDK2 aktivitását, ezáltal elősegítve a sejtek bejutását a sejtciklus G0/nyugalmi fázisába [38]. Ezért a megnövekedett ciklin D1 és csökkent p21 expresszió az FF-A csoportban fokozhatja a hepatocita proliferációt, ami a máj javító képességének növelésével enyhítheti az APAP által kiváltott ALI-t [24].
Összefoglalva, az APAP által indukált ALI-vel társuló oxidatív stressz során a PPAR-γ túlzott expresszió gyulladáscsökkentő hatást fejt ki, aktiválja a gyulladásgátló molekulákat, például az NRF2-t, és gátolja a gyulladásgátló molekulákat, mint például az NF-κB és az IFN-γ a NAFLD-t tartalmazó egerekben . Paradox módon az APAP által kiváltott súlyos oxidatív stressz és a NAFLD-hez társuló gyulladásgátló állapot agresszíven aktiválja az antioxidáns kaszkádokat, például a májkárosodást enyhítő PPAR-γ és NRF2-t. Ezek a hatások csökkentik az APAP túladagolás által kiváltott májkárosodást a NAFLD-vel rendelkező egerekben. Ezenkívül a sejtszaporodás aktiválása segíthet az ALI gyors enyhítésében.
Jelen tanulmánynak azonban vannak korlátai. Először csak egy meghatározott időpontban vizsgáltuk az APAP által kiváltott ALI megnyilvánulásait. Ezért nem tudtuk meghatározni a fent említett molekulák szintjének időfüggő változásait. Számos tanulmány [42, 43] azonban kimutatta, hogy egyes molekulák szintjének változása az APAP injekció beadása után 6 órával maximalizálódik, ami összhangban áll a NAFLD APAP által indukált ALI elleni korai hatásával. Másodszor, a létesítmények korlátozott rendelkezésre állása miatt nem tudtuk meghatározni az APAP metabolitok szintjét. Mivel az APAP-glükuronid, az APAP-szulfát és az NAPQI pontos szintjét nem sikerült meghatározni, az APAP-indukált ALI NAFLD-indukálta változásait közvetett módon megbecsültük az APAP-anyagcsere egyes lépéseiben részt vevő enzimek szintjének meghatározásával.
E korlátozások ellenére a jelen tanulmány az első, amely APF-rel kapcsolatos vizsgálatokban alkalmazza az FF diéta által kiváltott NAFLD modellt, amely utánozza a humán NAFLD patogenezisét. Sőt, ez a tanulmány megpróbálta azonosítani az APAP metabolikus útjával, valamint a proinflammatorikus és antioxidáns útvonallal összefüggő molekulákat.
Következtetések
Jelen tanulmány eredményei arra utalnak, hogy az FF diéta által kiváltott NAFLD korai gátló hatást fejt ki az APAP által indukált ALI-ra. A mechanizmust számos antioxidáns molekula, például a PPAR-y és az NRF2 veszi részt a súlyos oxidatív stressz hatására. További vizsgálatokra van azonban szükség annak igazolására, hogy a NAFLD hasonló hatásokat gyakorol-e hosszabb időtartamú és más ALI-típusokra.
- A korlátozott szénhidráttartalmú étrend hatékonysága az alkoholmentes zsírmájbetegségek kezelésében
- Az elhízás emésztőrendszeri szövődményei Alkoholmentes zsírmájbetegség (NAFLD) és annak
- Zárás az alkoholmentes zsírmájbetegségek jobb kezeléséről
- A zöld tea kivonat (a testmozgással együtt) segíthet a zsírmájbetegség elleni küzdelemben - tanulmány - NDTV Food
- Az alkoholfogyasztás hatása az alkoholmentes zsírmáj betegségre - Weng - Translational