A gyulladással összefüggő pitvari myopathia jellemzése, patogenezise és klinikai következményei, mint a pitvarfibrilláció egyik fontos oka
* Levelezés: Milton Packer, MD, Baylor Heart and Vascular Institute, 621 N. Hall Street, Dallas, TX 75226. E-mail:
Baylor Szív és Érrendszeri Intézet, Baylor Egyetem Orvosi Központ, Dallas, TX
Imperial College, London, Egyesült Királyság
Absztrakt
Absztrakt
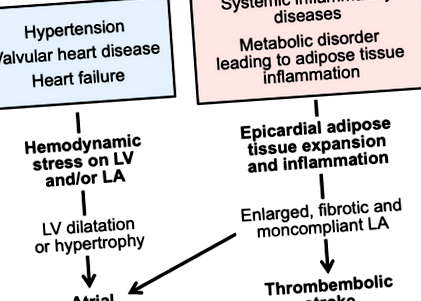
Történelmileg hosszan tartó pitvarfibrillációt (AF) figyeltek meg olyan klinikai körülmények között, amelyeket hosszan tartó hemodinamikai stressz jellemez. Az általános populációban az AF leggyakoribb kockázati tényezője a magas vérnyomás, és ezeknél a betegeknél a bal kamrai (LV) hipertrófia, majd a bal pitvar (LA) megnagyobbodása hozza létre az AF anatómiai szubsztrátumát. A renin-angiotenzin rendszer aktiválása hozzájárul az AF kialakulásához ezeknél a betegeknél; randomizált, kontrollos vizsgálatokban a magas vérnyomásban vagy LV hipertrófiában szenvedő betegek kezelése olyan gyógyszerekkel, amelyek gátolják a renin-angiotenzin rendszert, enyhíti az AF terhelését. 1 Ezenkívül a mitrális vagy aorta szelepi betegség vagy az LV szisztolés diszfunkciója tartós LA-nyomásnövekedést is eredményezhet, amely termékeny szubsztrátot eredményez az AF számára. A hemodinamikai stressz enyhítése (pl. Korrekciós szelepműtéttel) sok beteg esetében csökkentheti az AF előfordulását 2; mégis, másokban az AF megrázkódott LA anatómiai szubsztrátját nem javítja hatékonyan az eljárás.
Az elmúlt évtizedek során azonban sok AF-es beteg nem rendelkezik olyan rendellenességgel, amely hemodinamikai stresszt okozna a bal pitvarban. Ezeknek a betegeknek echokardiogramjaik vannak, amelyek általában nem mutatnak érdemi szelepi rendellenességeket vagy dilatációt, hipertrófiát vagy a bal kamra szisztolés funkciójának károsodását. Ezekben az egyénekben a szívképalkotás általában az pitvarok, különösen a bal pitvar szerkezetének vagy működésének rendellenességeit tárja fel. A bal pitvar megnagyobbodott, és gyakran károsodik az ürítés, valamint a tározó és a csatorna funkcióinak rendellenességei. 3 Az LA szerkezetének rendellenességei megjósolják az AF kialakulását, függetlenül a kórtörténet hipertóniájától, szívelégtelenségétől vagy miokardiális infarktusától. 4 Ezeknek a betegeknek pitvari myopathiája van, és klinikailag legkézenfekvőbb megnyilvánulása az AF (1. ábra).
1.ábra. A hemodinamikai és gyulladásos stressz pitvarfibrillációhoz vezethet, különös patofiziológiai útvonalakon keresztül.
LA jelzi a bal pitvust; LV, bal kamra vagy bal kamra.
A szisztémás gyulladásos és anyagcserezavarok pitvari myopathiát okozhatnak, amely AF-hez vezethet
Sok olyan pitvari myopathiával összefüggő AF-ben szenvedő betegnek van bizonyítéka, hogy a szív- és érrendszeren kívüli helyen található, régóta tartó gyulladás lép fel. A szisztémás gyulladás biomarkerei az AF gyakori precedensei az általános közösségben, 5 és a szisztémás gyulladás megjósolja a pitvari károsodások átalakulásának kialakulását és fejlődését. 6 A szisztémás gyulladásos folyamat kétféleképpen indítható el.
Először is, sok krónikus szisztémás gyulladásos (gyakran autoimmun) betegség LA myopathiával és az AF fokozott kockázatával jár. Pontosabban, a reumás ízületi gyulladás az AF előfordulásának ~ 40% -os növekedésével jár, 7 és ez a kockázat még az AF hagyományos rizikófaktorainak (pl. Magas vérnyomás) kiigazítása után is nyilvánvaló. Hasonlóképpen, az AF előfordulása ~ 40% -kal nő a pikkelysömörben szenvedő betegeknél 8; a kockázat különösen nyilvánvaló azoknál, akik fiatalok vagy klinikailag súlyos gyulladásos betegségben szenvednek. Mindkét rendellenesség esetében az elektrokardiográfia az pitvari elektromos aktiválódás rendellenességeit mutatja, amelyek elektromechanikus késleltetést mutatnak. A szívképalkotó vizsgálatok megerősítik a pitvari geometriában és a kitöltési jellemzőkben (különösen a bal pitvarban) jelentkező jelentős rendellenességek jelenlétét, amelyek összhangban állnak a szisztémás gyulladásos folyamat kiterjesztésével a pitvarfalra. Hasonló módon növekszik az AF előfordulása és prevalenciája szisztémás szklerózis, szisztémás lupus erythematosus, spondylitis ankylopoetica, gyulladásos bélbetegség és krónikus tüdőgyulladás esetén. 9., 10., 11., 12. Sok ilyen rendellenességben szenvedő beteg strukturális vagy funkcionális bizonyítékokkal rendelkezik a pitvari myopathiára (2. ábra). 13, 14
2. ábra. A zsírszöveti gyulladáshoz kapcsolódó krónikus szisztémás gyulladásos rendellenességek és anyagcserezavarok az epicardialis zsírtömeg növekedéséhez vezethetnek, ami bal pitvari myopathiát és annak klinikai következményeit okozhatja.
LA jelzi a bal pitvust.
Másodszor, a metabolikus rendellenességek széles körét, amelyekre a zsírszövet gyulladása jellemző, az AF fokozott kockázata is kíséri. Az elhízás drámai módon megnöveli az AF előfordulását és prevalenciáját, 15 és a bariatri műtét jelentősen csökkenti az AF terheit. A 2-es típusú diabetes mellitus az AF fokozott kockázatával jár, amely arányos a rossz glikémiás kontroll mértékével. 16 A zsírszöveti gyulladás és az inzulinrezisztencia egyéb állapotai az AF fokozott kockázatával járnak; ezek közé tartozik a metabolikus szindróma és az alkoholmentes májbetegség 17, 18, valamint az adipogenezist és a zsírszövet diszfunkcióját elősegítő hormonális betegségek (pl. hipotireózis és primer hiperaldoszteronizmus). 19, 20 Ezen rendellenességek mindegyikét az LA-betegség magas prevalenciája kíséri a nem invazív képalkotásban, jellemzően LA-dilatációval, fibrózissal vagy rendellenes töltési dinamikával jellemezve, és ezeknek a rendellenességeknek a súlyossága gyakran arányos az anyagcsere nagyságával. zavar vagy szisztémás gyulladás (2. ábra). 21, 22, 23, 24
Ez a cikk krónikus szisztémás gyulladásos rendellenességben vagy adipogén metabolikus betegségben szenvedő betegek LA myopathiájára utal, mint „gyulladással összefüggő pitvari myopathia”, ami „gyulladással összefüggő AF-hez” vezethet.
A pitvari myopathia patogenezise és azonosítása a szisztémás vagy zsírszöveti gyulladás állapotában
A szisztémás gyulladásos rendellenességek gyulladásos sérüléseket okozhatnak a koszorúér mikrocirkulációjában, ami mikrovaszkuláris diszfunkcióhoz, valamint szívizom fibrózisához vezethet. Ezenkívül a szisztémás vagy zsírszöveti gyulladás állapotai átalakulási változásokat idézhetnek elő a zsírszövetben az epicardiumon belül, ezáltal növelve annak tömegét és biológiáját gyulladás előtti állapotra változtatva. 25 Mivel az epikardium és a szívizom akadálytalan mikrocirkulációval kapcsolódik össze, az epikardiális zsír minden biológiai rendellenessége könnyen továbbjut az alapul szolgáló szívizomszövetekbe. Pontosabban, a proinflammatorikus adipocitokinek (pl. Tumor nekrózis faktor α, interleukin 1-β, interleukin-6) szekréciója a diszfunkcionális epikardiális zsírraktárból mikrocirkulációs sérülést és fibrózist okozhat a mögöttes szomszédos szívizomban, különösen a pitvari szívizomban. Az epikardiális zsírszövet-terjeszkedés és gyulladás kapcsolódik az AF anatómiai és patofiziológiai szubsztrátjaihoz a szomszédos pitvari szívizomban. 26, 27
A gyulladásos mediátorok szerepe az LA myopathia patogenezisében
Ezek a megfigyelések számos fontos megállapítást magyarázhatnak. Először is, az AF-hez kapcsolódó krónikus szisztémás gyulladásos és anyagcserezavarok mind együtt járnak az epicardialis zsírszövetek 28, 29, 30, 31, 32, 33, 34, 35 növekedésével; fontos, hogy az epikardiális zsírmennyiség növekedése arányos a betegség klinikai súlyosságával és a szisztémás gyulladás intenzitásával. Másodszor, AF-ben szenvedő betegeknél szoros összefüggés van az epikardiális zsír vastagsága és gyulladásos állapota, valamint a szomszédos szívizom elektromos rendellenességeinek súlyossága között. 26, 27 Harmadszor, az epicardialis zsírmennyiség megjósolja az AF előfordulását a közösségben, még a szív- és érrendszeri megbetegedések előzetes bizonyítékainak hiányában is; csak az epicardialis zsírraktár (és más zsigeri zsír nem) társul a szív rendellenességeihez 37; és az epicardialis zsírszövet tömege növekszik, amikor az AF paroxizmálisból tartós aritmiává alakul. 38 Negyedszer, szoros összefüggés van az epikardiális zsírszövet tömege és a koszorúér-mikrovaszkuláris diszfunkció és a pitvari geometria közötti rendellenességek között számos szisztémás gyulladásos és anyagcserezavar között (1. és 2. ábra). 32, 39, 40
A szomszédos pitvari szívizom sérüléséért felelős epikardiális zsírszövet-depók által felszabaduló proinflammatorikus mediátorok azonosítása nem ismert. Ugyanakkor 3 jelölt (leptin, aldoszteron és natriuretikus peptidek) szerepet játszik a gyulladással összefüggő pitvari myopathia és AF patogenezisében. Az aldoszteron fokozott aktivitása és az endogén natriuretikus peptidek csökkent aktivitása elősegítheti az epikardiális zsírbetegséget és biológiájának átalakulását tápláló anyagból gyulladás előtti állapotba. 42, 43 Az aldoszteron helyi növekedése koszorúér-mikrovaszkuláris sérüléseket és fibrózist okozhat 44; ezeknek a hatásoknak általában ellentmondanak az endogén natriuretikus peptidek 45, de hatásukat minimalizálhatjuk a hipertrofált és gyulladt adipociták általi megnövekedett natriuretikus clearance-sel. 46 Végül a zsírszöveti gyulladáshoz kapcsolódó szisztémás gyulladásos rendellenességek és anyagcserezavarok a leptin (47, 48) felszabadulását okozzák, amely maga is mikrovaszkuláris endotheli diszfunkciót okozhat, és elősegítheti mind a gyulladást, mind a fibrózist. 49 Érdekes, hogy az aldoszteron és a leptin AF-szel szoros kapcsolatban áll kísérleti és klinikai vizsgálatokban. 50, 51
A gyulladással összefüggő pitvari myopathia következményei
A pitvari myopathia jelenléte klinikailag 3 módon nyilvánulhat meg: (1) kiválthatja pitvari tachyarrhythmiákat; (2) növelheti a pulmonalis vénás nyomást és ronthatja a testtűrést; és (3) hajlamosíthat LA trombus képződésre, szisztémás tromboembóliára és stroke-ra (2. ábra).
A pitvari myopathia mint az AF oka
A pitvari miopátia jelenlétének klinikailag legkézenfekvőbb biomarkere az AF megtalálása a felszíni EKG-n. Valószínűnek tűnik azonban, hogy a pitvari myopathia hosszú ideig fejlődik, mielőtt az AF klinikailag nyilvánvalóvá válik, és klinikailag fontos hatásokat fejthet ki még az AF megnyilvánulása előtt. 52 Ezzel szemben bizonyos betegek, különösen azok, akiknek kevés gyulladásos társbetegségük van (pl. Alacsony a keringő C-reaktív fehérje szintje), AF-t szenvedhetnek anélkül, hogy a mögöttes miopátia funkcionális következményekkel járna. 53, 54, 55
A pitvari myopathia, mint a tüdő vénás magas vérnyomásának oka
A szisztémás vagy zsírszöveti gyulladás átjutása az LA szívizomba rontja annak tartályát, vezetékét és szisztolés funkcióit. Ennek eredményeként az LA kiürülése csökken, de a kamra merevsége nő, ami aránytalanul megnövekedett LA nyomáshoz vezet, még akkor is, ha az LA térfogatát csak szerényen növeljük. 54 Bár a pitvari myopathiát okozó gyulladásos folyamat a bal pitvart is sújtja, és ronthatja annak distenzitását, az AF-ben szenvedő betegek LA-nyomásának növekedése elsősorban a pitvari myopathia következménye, és nem az LV end-diastolés nyomás retrográd átvitele miatt a bal pitvar. Míg a pulmonalis éknyomás tipikusan alacsonyabb, mint az LV végdiasztolés nyomása sinus ritmusú betegeknél, az ellenkezője igaz bal szívbetegségben és AF-ben szenvedő betegeknél. 69 Ennek eredményeként az LA myopathia maga is pulmonalis vénás hipertóniát okozhat, amely elősegítheti az erőkifejtési nehézlégzést és korlátozhatja a testtűrést.
Ezért még az AF-ben szenvedő betegeknél is, akiknek bizonyítékai vannak az LV-töltés kapcsolódó rendellenességeire, az LA-törzs mérései szorosabban kapcsolódnak az edzésképességhez és az eredményekhez, mint az LV-töltési nyomáshoz. 70 Érdekes módon az LA nyomás növekedése szintén fontosabbnak tűnik az AF-ben szenvedő betegek funkcionális kapacitásának korlátozásában, mint a testmozgás által kiváltott tachycardia. Az AF-ben szenvedő betegeknél, akiknek a testmozgás okozta magasabb pulzusszám-növekedés nem mutat rosszabb testmozgást, 71 így kérdéseket vetnek fel a rövidített diasztolé szerepéről az erőkifejtési tolerancia korlátozásában. Ami a legfontosabb, hogy számos kettős álarcú, randomizált, kontrollos vizsgálatban a gyógyszer által kiváltott nyugalmi állapotban vagy testedzés közbeni gyakoriságszabályozás vagy a testtűrés javulása vagy romlása mellett következett be, függetlenül az atrioventrikuláris vezetés lassítására használt szer farmakológiai hatásmechanizmusától. 72, 73, 74, 75
A pitvari myopathia, mint a szisztémás tromboembólia oka
Az AF-hez kapcsolódó szisztémás gyulladásos rendellenességben szenvedő betegeknél fokozott a tromboembóliás stroke kockázata. Például a reumás ízületi gyulladásban és a pikkelysömörben szenvedő betegeknél az iszkémiás stroke kockázata 50% -tól 100% -ig nő, de a megnövekedett kockázat nagysága háromszorosára emelkedik, ha a 76 éves betegek szenvednek. Fontos, hogy a stroke kockázatának növekedése jelentősen meghaladja ami a hagyományos kardiovaszkuláris rizikófaktorok jelenléte alapján megjósolható, ehelyett párhuzamosan áll az ízületi gyulladás klinikai súlyosságával és időtartamával, valamint a szisztémás gyulladás intenzitásával. 8, 77 Hasonlóképpen, a stroke kockázata az AF-hez kapcsolódó anyagcserezavarokban (pl. Metabolikus szindróma vagy alkoholmentes zsírmájbetegség) nagyobb, mint ami a vérnyomás, a szérum koleszterin vagy a testtömeg változásával magyarázható, de úgy tűnik, szorosan kapcsolódni kell a szisztémás gyulladás biomarkereihez (azaz a C-reaktív fehérjéhez). 78, 79
Tehát a stroke megnövekedett kockázata szisztémás gyulladásos rendellenességekben kapcsolódik-e az AF-hez vagy a gyulladással összefüggő pitvari myopathiához? Az orvosok régóta úgy vélik, hogy az AF kaotikus összehúzódása a trombusképződést vezérli; azonban a bal pitvarban az alacsonyabb pitvari myopathiának tulajdonítható csökkent áramlási sebesség a thromboembolizációra hajlamos, megmagyarázva, hogy a mitralis regurgitáció miért véd a bal pitvarban a vér stagnálása ellen, annak ellenére, hogy az LA dilatációjának elősegítésével növeli az AF kockázatát. 80 A bal pitvarban fellépő gyulladásos és fibrotikus folyamat elsődleges meghatározó tényező a kamra vezetékfunkcióinak károsodásában, még AF hiányában is; ezenkívül a gyulladás és a fibrózis közvetlenül fokozhatja a pitvari endocardium thrombogenicitását. Ennek megfelelően a pitvari fibrózis hajlamosítja az LA trombus képződését és a stroke kialakulását, függetlenül az LA kamra méretétől. 81.
Ennek megfelelően az LA myopathia súlyossága növeli a stroke és az érrendszeri agykárosodás kockázatát AF-ben vagy anélkül szenvedő betegeknél. 82, 83 Azoknál a betegeknél, akiknek nincsenek pitvari miopátia fennállását tükröző kockázati tényezők, az AF-ben szenvedő betegeknél a stroke kockázata hasonló az AF nélküli betegek kockázatához. 3 Ezzel szemben a CHA2DS2 ‐ VASc kockázati pontszámok (amelyek sok pitvari myopathiában szenvedő vagy epicardialis adipositásban szenvedő beteget azonosítanak 84) megjósolják a stroke előfordulását, még AF nélküli betegeknél, 85 és magas kockázati pontszámú betegeknél is, a tromboembóliás események kockázatát amit a pitvari myopathia határoz meg, az AF jelenléte nem növeli tovább. 86 Figyelemre méltó, hogy az ismert AF-ben szenvedő személyeknél a reumás ízületi gyulladásban és a szisztémás lupus erythematosusban szenvedő betegeknél a stroke gyakorisága nagyobb, mint azt a CHA2DS2 ‐ VASc pontszám, 87, 88 magyarázhatja, feltehetően azért, mert a pontszám nem tartalmazza a szisztémás gyulladás vagy a pitvari myopathia közvetlen értékelése. Néhányan azt javasolták, hogy szisztémás gyulladásos rendellenességben szenvedő betegeknél megsokszorozzák a CHA2DS2-VASc kockázati pontszámot. 89
Az AF elsőbbségének a stroke okozásában való kétségeit megerősítették a longitudinális vizsgálatok eredményei, amelyek folyamatos elektrokardiográfiai monitorozó eszközöket használtak az AF kimutatására a stroke kockázatának kitett vagy anamnézisben szenvedő betegeknél. Ezekben a vizsgálatokban a kockázatnak kitett betegeknél a stroke előfordulását megelőző hónapban általában nem mutattak ki AF-t. 90, 91 Tromboembóliás stroke-ban szenvedő betegek csak ritkán és átmenetileg mutatták ki az AF-t, 92 és sok betegnél az AF-t csak az agyi érrendszeri esemény után figyelték meg. Fontos, hogy az AF jelenléte vagy hiánya által vezérelt antikoagulánsok alkalmazása a kockázatnak kitett egyes betegeknél nem akadályozta meg a thromboemboliás eseményeket. 94. o
Ezenkívül a farmakológiai kontroll vagy az AF eljárási megszüntetése nem mutatta be a szélütés kockázatának csökkentését nagyszabású, randomizált, kontrollált klinikai vizsgálatokban. Véletlenszerű, kontrollos vizsgálatok, amelyek összehasonlították a frekvencia-kontroll és a ritmus-kontroll stratégiákat a kialakult AF-ben szenvedő betegeknél, nem mutatták ki a szisztémás tromboembólia vagy a stroke kockázatának csökkenését a ritmusszabályozásra kijelölt betegeknél, annak ellenére, hogy ezeknél a betegeknél csökkent az AF terhelése. Paradox módon a ritmus-kontroll csoport a thromboemboliás események fokozott kockázatát tapasztalta, 96 valószínűleg azért, mert egyes betegeknél az orális antikoagulációt abbahagyták, azon téves vélekedés alapján, hogy a stroke elsődleges hajtóereje az AF (nem a pitvari myopathia). Végül az AF katéteres ablációval történő megszüntetése nem csökkentette a szélütés kockázatát egy nagyszabású, randomizált, kontrollált vizsgálatban; ebben a vizsgálatban az orális antikoagulációs terápiát fenntartották, bár sok beteg esetében valószínűleg nem volt a terápiás tartományban. 97
Gyulladással összefüggő pitvari myopathiában szenvedő betegek azonosítása
Következtetések
Az AF-t régóta a szív bal oldalán fellépő hemodinamikai stresszek következményének tekintik, különös tekintettel a magas vérnyomás és a szívbillentyű betegség nyomás- és térfogat-túlterhelési állapotára. Az utóbbi években azonban az AF rendellenességgé fejlődött, amely gyakran a szisztémás gyulladásos vagy anyagcsere-rendellenességek széles skálájának következménye, amely diszfunkcionális változásokat okozhat a zsírszövetraktárakban, különösen az epicardiumban. A kiterjesztett epikardiális zsírszövet tömegének proinflammatorikus állapotának a szomszédos szívizomba átvitele képes káros szerkezeti és funkcionális változásokat produkálni a bal pitvarban, ami pitvari myopathia kialakulásához vezet. A pitvari miopátiás folyamatot a koszorúér mikrovaszkuláris diszfunkciója, a szívizom fibrózis és a kamra vezetékfunkcióinak károsodása jellemzi. Leggyakrabban klinikailag AF-ként jelentkezik, és (az aritmiától függetlenül) hozzájárulhat a pulmonalis vénás hipertónia és a tromboembóliás stroke kialakulásához. A gyulladással összefüggő pitvari myopathiában szenvedő betegek nem biztos, hogy jól reagálnak az AF sebesség- vagy ritmusszabályozási stratégiájára, de az antikoaguláció elengedhetetlen a thromboemboliás stroke kockázatának csökkentése érdekében.
Közzétételek
Dr. Packer a közelmúltban konzultált az Abbvie, az Actavis, az Akcea, az Amgen, az AstraZeneca, a Bayer, a Boehringer Ingelheim, a Cardiorentis, a Daiichi Sankyo, a Johnson & Johnson, a NovoNordisk, a Pfizer, a Sanofi, a Synthetic Biologics és a Theravance témában. Ezen kapcsolatok egyike sem releváns a felülvizsgálat témája szempontjából.
- Élelmiszerek teljes szöveges tisztítása és a patogenezissel kapcsolatos 10. osztály jellemzése
- Tejtermékek és gyulladás A klinikai bizonyítékok áttekintése Kritikus vélemények az élelmiszer-tudományban
- Az étrendi kapszaicin és elhízás elleni hatékonysága a mechanizmustól a klinikai vonatkozásokig Bioscience
- Sejtproliferáció az ép gyomrot érintő C típusú gyomorhurutban Journal of Clinical Pathology
- Az alkohol okozta myopathia sejtes és molekuláris aláírása nőknél American Journal of