A hiperketonémia és a ketózis növeli a szövődmények kockázatát az 1-es típusú cukorbetegségben
Absztrakt
1. Bemutatkozás
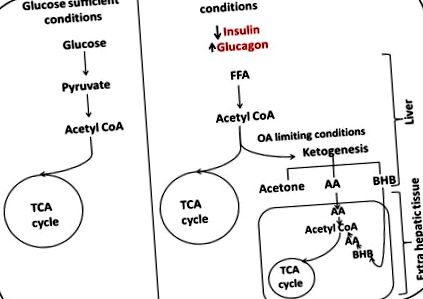
Normál körülmények között a glükóz átalakul acetil-CoA-vá, és belép a trikarbonsav (TCA) ciklusba, hogy energiát nyerjen. Amikor a glükóz korlátozóvá válik, a glükagonszint emelkedik, megkönnyítve a szabad zsírsavak (FFA) májba történő transzportját, a máj zsírsav-oxidációt hajt végre keton testek létrehozása érdekében, amelyek képesek lépést tartani az agy energiaigényével. A ketogenezis fokozódik, mivel az oxaloacetát (OA) elérhetősége korlátozottá válik, és az acetil CoA-csoportokat a ketontermelés felé kényszeríti. A ketonok az extra májszövetekben acetil-CoA-vá alakulnak át, és energiával ellátva belépnek a TCA-ciklusba.
2.1 Ketogenezis
Az acetoacetát (AA), a 3-p-hidroxi-butirát (BHB) és az aceton (legkevesebb) a ketogenezis során keletkező három keton test. Az AA a központi keton test, amelyet a 3-hidroxi-3-metil-glutaril-koenzim-A (HMG CoA) közbenső anyagcseréje során állítanak elő és hasznosítanak, és a többi ketontest ebből származik [3, 5]. Az acetont az AA spontán dekarboxilezésével állítják elő. Klinikai érdeke elsősorban azért, mert gyümölcsillatot kölcsönöz, amely alapján a ketózis azonosítható. A BHB az AA redukciójából képződik 3-hidroxi-butirát-dehidrogenáz hatására (EC 1.1.1.30) [3].
2.2 Ketolízis
Miután a májban képződött, a ketonok diffundálnak a keringésbe, hogy extrahepatikus szövetekben használják, ahol ketolízis történik. Szukcinil-CoA: 3 oxosav CoA-transzferáz (EC 2.8.3.18, SCOT) jelenlétében az AA acetoacetil-CoA-vá aktiválódik, amelyet aztán mitokondriális acetoacetil-CoA-tioláz (EC 2.3.1.9) alakít AcCoA-vá [3, 5, 15]. Az előállított AcCoA ezután felhasználható energiatermelésre oxidatív anyagcserével. A szövetek ketolitikus kapacitása SCOT aktivitásuktól függ. A szívről ismert, hogy a legmagasabb SCOT aktivitás, ezt követi a vese. Ez azt eredményezi, hogy a szív és a vese rendelkezik a legnagyobb képességgel a keton test hasznosítására. A ketonok az energia fő energiaforrásaként szolgálhatnak, SCOT - aktivitással
10% a szívéhez képest, koplalás vagy éhezés során. Fontos, hogy sem a SCOT fehérje, sem az mRNS nem mutatható ki a májban, megakadályozva ezzel a ketonok hiábavaló körforgását a májban. Így a máj által termelt ketonokat az extrakepatikus szövetekbe szállítják, hogy üzemanyagként felhasználják, így a máj a ketogenezis elsődleges forrása [3, 15, 16]. Bizonyítékok támasztják alá a cukorbetegségben szenvedő funkcionális SCOT csökkenését. A cukorbetegség állatmodelljeiben végzett kutatások azt mutatják, hogy a cukorbetegség összefüggésben áll a tirozin nitrációval, ami a SCOT inaktiválását eredményezi [17, 18]. Az SCOT ezen inaktiválódását az állatmodellek szívszövetében figyelték meg, bár emberben nem erősítették meg, utalhatunk arra, hogy a cukorbetegek csökkent képességgel képesek eltávolítani a ketonokat a keringésből, SCOT-aktivitásuk potenciális károsodása miatt.
2.3. Acetoacetát és β-hidroxi-butirát homeosztázis
Az egyéni ketontest koncentrációja diabéteszes körülmények között változó. A BHB 2-3-szor nagyobb koncentrációban található meg, mint az AA [19]. Az inzulinhiány súlyosságától függően a ketonszintek, különösen az AA-BHB arány, a T1D-s betegeknél 1: 1 és 1: 4 között változhatnak, a BHB károsodott felhasználása, valamint az extra képesség képtelensége miatt. a máj perifériás szövetei a BHB AA -vá történő átalakításához [7, 19, 20]. Ezen keringő ketonok arányához további tényezők járulnak hozzá: a máj csökkent állapota, a NADH szint emelkedésével és a β-hidroxi-butirát-dehidrogenáz aktivitásának csökkenése [21, 22].
3. DKA, oxidatív stressz és diabéteszes társbetegségek
Bár számos tanulmány szerint a ketonok antioxidáns szerepet játszanak, és felhasználják őket a különféle rendellenességek kezelésében [23–26], az egyik tanulmány Beskow és mtsai. értékelte a különféle oxidatív stressz paramétereket, például a fehérje és a lipid oxidációját, az enzimatikus és nem enzimatikus antioxidáns védekezés szintjét, és kimutatta, hogy az AA és a BHB nem váltja ki és nem akadályozza meg az oxidatív stresszt in vitro [27].
3.1 Oxidatív stressz indukció
Az irodalom kimutatta, hogy a ketonok számos mechanizmus révén növelhetik az oxidatív stresszt, és ilyen példa a NADPH-oxidázok szabályozása. A ketonok által közvetített szuperoxid gyökök termelésének növekedése fel tudja szabályozni a tapadásmolekulák expresszióját kiváltó jelátviteli mechanizmusokat. Az endoteliális sejtekben kimutatták, hogy a megnövekedett adhéziós molekula expresszió a monociták tapadását okozhatja, ami potenciálisan elváltozáshoz, plakk-iniciációhoz vagy szöveti beszivárgáshoz vezethet, ami hozzájárulhat a szövet károsodásához [31].
3.2 Az inzulinrezisztenciára/szekrécióra gyakorolt hatás
3.3 Az érgyulladás potencírozása
3.4. Májműködési zavarokban való részvétel
3.5 DKA és agyi rendellenességek
A vérben a ketonok emelkedéséhez hozzájáruló tényezők közül néhányat a 2. ábra mutat be. Ezek lehetnek fiziológiai vagy kóros jellegűek. Összefoglalva, a metabolikus állapot jellegétől függően az emelkedett ketonok nagyon különböző hatásokkal járhatnak. Normális glikémiás körülmények között vagy hiperglikémiás állapotokban, amint azt diabéteszes körülmények között megfigyelhetjük, a ketonok felhalmozódnak és olyan módon működnek, hogy káros és káros módon aktiválják a jelátviteli utakat, amelyek gyulladásgátló válaszokat eredményeznek. Másrészt hipoglikémiás állapotokban az emelkedett ketonokat üzemanyagként használják, és hatékonyan tisztítják a glükóz rendelkezésre állásának hiánya miatt. A szövetek által a keton testfelvétele energia céljára energiahatékony, és hasznosnak tekinthető.
Olyan állapotok, amelyek indukálják a ketonszintézis felemelkedését vagy a ketonok felhalmozódását a vérben. Egyénekben normális fiziológiai körülmények között, mint például éhgyomri, terhesség és csecsemőkor, a ketonok koncentrációja emelkedik a vérben. Más állapotok, például cukorbetegség, más néven inzulinhiányos állapot, alkoholizmus és a gének bizonyos mutációi, amelyek a ketonok lebontásához szükségesek, szintén növelik a vér ketonszintjét.
4. Fiziológiai ketózis
Fiziológiai ketózisban a vér ketonszintje mérsékelten emelkedik (
2 mM) [80]. Az itt elért ketonszint emelkedés marginális és nem éri el a veszélyesen magas szintet. Az elhúzódó testmozgás és az éhezés a máj ketonmennyiségének normális felemelkedésének egyik leggyakoribb oka.
4.1 Böjt
A táplálékfelvétel hiányára vonatkozó fiziológiai válasz az, hogy több olyan utat kell megfordítani, amelyek végső soron üzemanyagot szolgáltathatnak a szövetek és különösen az agy számára. A koplalás vagy az éhezés megindíthatja a ketogenezist az egész test energia homeosztázisának szabályozására és fenntartására. Az az elképzelés, miszerint az aminosavakból származó glükoneogenezis megelőzi a ketogenezis indukcióját, míg az utóbbit fehérjetakarékos célokra indukálják, jól elfogadott [2]. A hosszan tartó éhezés során a túlélést a testben lévő zsíros üzemanyag-raktárak teszik lehetővé, ezáltal megkímélve az életfunkciókhoz szükséges esszenciális fehérjéket. Az étel (szénhidrát) hiánya az inzulinszint csökkenését okozza, miközben a vér glükagonszintje egyidejűleg emelkedik. A glükagon növekedése a fentiekben leírtak szerint a ketogenezis út aktiválódását okozza. A ketontest koncentrációja ez idő alatt elérheti a 6–8 mM-ot [81]. A főként a máj által vezérelt keton testteljesítmény így segít fenntartani az agy és más létfontosságú szervek energiaigényét [2, 5, 81]. Az ebben a kontextusban bekövetkező ketogenezis főként a táplálékot szolgálja, és táplálékhiányos körülmények között előnyösnek tekinthető.
4.2 Ketogén étrend
A KD-t a glükóz transzporter 1 (GLUT1) és a piruvát-dehidrogenáz hiányainak kezelésére alkalmazzák, ahol a betegek nem tudják felhasználni a glükózt energetikai célokra, és túlélésükhöz alternatív forrásra van szükségük [91–94]. A GLUT1-hiány a glükóztranszport károsodását okozza a vér-agy gáton, és a KD-diéta használata ketonokat jelent az agy alternatív energiaforrásaként. Másrészt a piruvát-dehidrogenáz-hiány akadályozza a glükóz energiává történő átalakulását, és ebben a hibában szenvedő betegek ketogén diéták beépítésével segíthetnek [91–94]. Érdekes, hogy a ketonok előnyeit a rák kezelésében is jelenleg vizsgálják. A normál agysejtektől eltérően az agydaganatos sejtek (glioma sejtek) leggyakrabban csökkent enzim expressziót mutatnak a ketolízis útjában [95, 96]. Ennek eredményeként a daganatsejtek nem tudják felhasználni a ketonokat, mivel energiájukban nagy mértékben támaszkodnak a glükózra. A legújabb tanulmányok kimutatták, hogy a KD-ként beadott ketonok növelik a túlélést egy glioma egér és rágcsáló modellben, mivel a ketonok glükózzal történő helyettesítése akadályozza a rákos sejtek ketonok metabolizálásának képességét, és ezáltal megakadályozza a rákos sejtek növekedését és túlélését [97–99].
Azonban ezt a diétát betartó betegeknél különféle problémákkal találkoztak (1. táblázat). A diéta időtartamának növekedésével nőnek a szövődmények is. A KD hosszú távú bevitelét vesekövekkel, epekövekkel, megemelkedett májenzimekkel és ritka esetekben akár halálsal is összefüggésbe hozták [100]. Bár a csecsemők jól tolerálják az étrendet, az idősebb gyermekek körében nehézségeket okoz. Olyan bonyodalmakról, mint dehidratáció, gyomor-bélrendszeri rendellenességek, hiperkoleszterinémia, metabolikus acidózis [101] és szívbetegségekről számoltak be KD-t követő betegeknél [102]. A KD-vel tapasztalt szövődmények különböző étrendek kialakítását vezették be, amelyek hasonló előnyöket kínálnak, de jól tolerálhatók is. A módosított Atkin étrend, a közepes láncú trigliceridek és az alacsony glikémiás indexű kezelés mind nagyobb arányban tartalmazott fehérjét és szénhidrátot az étrendbe, hogy több ételválasztékot, jobb toleranciát és megfelelést biztosítson [85].
Asztal 1
A táblázat felsorolja azokat a rövid és hosszú távú szövődményeket, amelyeket a KD diétát szenvedő betegek tapasztalnak.
| Rövid időszak | Hipoglikémia [138] |
| Kiszáradás [139] | |
| Étvágytalanság [138] | |
| Gastroesophagealis reflux [140] | |
| Hányás [139, 141] | |
| Hasmenés [140] | |
| Székrekedés [141] | |
| Hasi fájdalom [140] | |
| Hosszútávú | Növekedési változások [138] |
| Hyperlipidemia [142] | |
| Nephrolithiasis [138] | |
| Vitamin, ásványi anyag és elektrolit hiány [139] | |
| Hipertrigliceridémia [139, 143] | |
| Szívbetegségek [60] |
4.3 Kor- és energiaigény
Más esetekben szintén megemelkedett ketontermelésről számolnak be a szervezetben. Például a magas zsírtartalmú tej elfogyasztása emelheti az újszülöttek ketontestét [103]. Azoknál a kisgyermekeknél, akiknek nagyon nagy az energiaigényük, akár egy napi böjt vagy fertőzések is növelhetik a ketontestek termelését, ami hiperketonémiát okozhat [104, 105]. Úgy tűnik, hogy fordított összefüggés van a gyermekek életkora és a vér ketonszintje között [105]. Felnőtteknél azonban a 12-16 órás éhezés mérsékelt növekedést okozhat a ketonszintben, míg a legfeljebb 3 napos éhezés elérheti a hiperketonémiát [106, 107]. Ez alól kivétel a terhesség. A terhes nők vérében általában magas a ketonszint, és az éhomi étrend után a vér ketontartalma gyorsan megnőhet, így fogékonyabbá válik a ketoacidózisra [108].
5. Kóros ketózis
A szabályozatlan keton-anyagcsere, amely a keton-clearance vagy a keton-termelés túlzott hibáival jár, növelheti a vér keton-koncentrációját olyan szintre, amely változásokat okozhat a vér pH-jában. A ketonszint ezen rendellenes emelkedése káros lehet.
5.1 A ketolízis útjának károsodása
A keton test lebontásában vagy ketolízisében részt vevő enzimek hiányában szenvedő egyének vérében általában magas a ketonszint, másrészt a ketogenezis útjának veleszületett hibái magas FFA-khoz és alacsony ketonszintekhez vezetnek. A ketolízis útvonalának hibái között szerepel a SCOT és az acetoacetil CoA tioláz hiány, míg a ketogenezis útvonalban a HMG-CoA szintáz és a HMG-CoA liáz hiány [5]. A SCOT-hiányban szenvedő betegek folyamatos hiperketonémiát tapasztalnak, amelyet szintén a vér ketonszintjének állandó emelkedéseként tartanak számon, és koplalás után ketonszintjük abnormálisan magasra emelkedik, és gyorsan kialakul a ketoacidózis [109]. Egy másik állapot, amelyben az egyének abnormálisan magas vér ketonszintet tapasztalnak, az acetoacetil CoA tioláz hiány, amely a ketoacidosis visszatérő rohamaival függ össze [110].
5.2 Alkoholos ketoacidózis
Ezt az állapotot leggyakrabban az alkoholisták sürgősségi osztályán diagnosztizálják. Az alkoholos ketoacidózis indukált állapot vagy állapot, amely az etanol hosszantartó beviteléből adódik. Az alkoholfogyasztás acidózishoz vezethet, amelyet a megnövekedett ketonszint a vérben közvetít [111, 112]. Az etanol májalkohol-dehidrogenázzal történő oxidációja a NADH növekedését eredményezi, és egyensúlyhiányt okoz, ami elősegíti az FFA ketonokká történő átalakulását [113, 114]. Leggyakrabban ez az állapot a normális vércukorszinthez kapcsolódik [111], de alultápláltsággal (alacsony szénhidrátfogyasztással) együtt járva a betegek hipoglikémiássá válnak, és eszméletüket vesztik a lehetséges agykárosodástól [115, 116]. Noha ezeknek a betegeknek a hormonális profilja hasonló a DKA-val (alacsony inzulinszint és magas szabályozó hormonok), biokémiai és metabolikus profiljuk meglehetősen eltérő [117]. A tanulmány azt mutatja, hogy az alkoholos ketoacidosisnak magasabb volt a BHB/AA aránya és magasabb a laktátszintje a DKA-hoz képest, ami az alkohol metabolizmusa által kiváltott redox állapot megváltoztatásával magyarázható [117].
5.3 Cukorbetegség
Az inzulin relatív vagy abszolút hiányából adódóan a megnövekedett ketogenezis cukorbetegeknél fordul elő, gyakrabban 1-es, mint 2-es típusú egyéneknél.
5.3.1. 1-es típusú cukorbetegség
1-es típusú cukorbetegség (T1D)
A diabéteszes esetek 10% -a világszerte leggyakrabban gyermekeknél és serdülőkorban fordul elő [118]. A T1D-t a hasnyálmirigy β-sejtjeinek autoimmun pusztulása közvetíti, ami abszolút inzulinhiányhoz vezet. Exogén inzulinadagolás szükséges az emelkedett glükózszint kontrolljának eléréséhez. Az inzulin beadásának bármilyen elmaradása vagy az elmaradt adag a ketogenezis út aktiválódásához vezethet. Az 1-2 mM (1-2 µmol/ml) ketonszintet gyakran észlelik a T1D-s betegeknél a klinikán végzett rutinellenőrzések során [119–122]. A ketogenezist általában előnyben részesítik, és előnyösnek tekintik éhomi vagy éhezési körülmények között, mivel a ketonok átveszik az energiatermelés szerepét a glükózkorlátozó körülmények között. Ez lényegében szénhidrátfogyasztás hiányában következik be, és mind a glükagon, mind az inzulin szorosan szabályozza. Cukorbetegség esetén az inzulin hiánya a glükagon felszabadulásával párosulva a májban a glükoneogenezist, a zsírban a lipolízist és a máj ketogenezist hajtja végre [73]. Bár a ketonok számos előnyéről beszámoltak, ennek ellenére a ketonok, ha azok feleslegben vannak, káros hatásokat okozhatnak. A vérben lévő ketonkoncentráció felhalmozódása, amely potenciálisan a vér pH-értékének csökkenését eredményezheti, ketoacidózishoz vezethet, ami pusztító szövődmény [73].
5.3.2 Diabéteszes ketoacidózis (DKA)
Lábjegyzetek
Kiadói nyilatkozat: Ez egy szerkesztetlen kézirat PDF-fájlja, amelyet kiadásra elfogadtak. Ügyfeleink számára nyújtott szolgáltatásként a kéziratnak ezt a korai változatát biztosítjuk. A kézirat átmásolásán, szedésén és a kapott bizonyíték felülvizsgálatán átesik, mielőtt a végső hivatkozható formában közzétennék. Felhívjuk figyelmét, hogy a gyártási folyamat során olyan hibákat fedezhetnek fel, amelyek befolyásolhatják a tartalmat, és a naplóra vonatkozó minden jogi felelősségvállalás vonatkozik.
- Hotdogok, felvágottak jelentősen növelik a cukorbetegség kockázatát az élő tudomány
- Az elhízás hosszabb időtartama megnöveli a 2-es típusú cukorbetegség kockázatát a nők körében
- Alacsony szénhidráttartalmú étrend pontszámok és a 2-es típusú cukorbetegség kockázata férfiaknál - PubMed
- Hogyan csökkenthető a májbetegség kockázata 2-es típusú cukorbetegség esetén
- A magas rosttartalmú, alacsony zsírtartalmú étrend hosszú távú súlycsökkenést jósol, és a csökkent 2-es típusú cukorbetegség kockázatot jelenthet