A hipotalamusz-hipofízis-mellékvese tengely, elhízás és krónikus stressz-kitettség: alvás és a HPA tengely az elhízásban
Eliane A. Lucassen
Neidenofiziológiai laboratórium, Leideni Egyetem Orvosi Központ Molekuláris Sejtbiológiai Tanszék, Leiden, Hollandia
Giovanni Cizza
Szekció az elhízás neuroendokrinológiájáról, NIDDK, National Institute of Health, 10. épület, CRC, Rm 6-3940, Bethesda, MD 20892-1613, USA
Absztrakt
Az elhízás, a stressznek való kitettség és a nem megfelelő alvás elterjedt jelenség a modern társadalomban. Ebben az áttekintésben a kapcsolataikra összpontosítunk és kritikusan értékeljük az okságot. Elhízott egyéneknél az egyik fő stresszrendszer, a hipotalamusz-hipofízis-mellékvese tengely megváltozik, és a kortizol koncentrációja megemelkedik a zsírszövetben az 1-es típusú 11β-hidroxi-szteroid-dehidrogenáz (HSD) megemelkedett helyi aktivitása miatt. Rövid alvás és az alvás minőségének romlása az elhízással is összefügg. Ezenkívül a kísérleti alváskorlátozás HPA-tengely változásokat indukál, amelyek viszont negatívan befolyásolhatják az alvást. Ezek a megállapítások arra utalnak, hogy az elhízás, a stressz és az alvásvesztés ördögi körben kapcsolódnak egymáshoz. Végül megvitatjuk az elhízás elleni küzdelem új stratégiáit a zsírszövet kortizolszintjének 11β-HSD1 inhibitorokkal történő modulálásával vagy az alvás időtartamának javításával.
Bevezetés
Az Országos Egészségügyi és Táplálkozási Vizsgálat arról számolt be, hogy 2009–2010-ben a felnőtt amerikaiak 33% -a volt túlsúlyos ((testtömeg-index (BMI) 25,0–29,9 kg/m 2)) és 36% -a elhízott (BMI ≥ 30,0 kg/kg). m 2) - hatalmas növekedés 1960 és 1962 között - amikor az amerikaiak hasonló százaléka volt túlsúlyos (31%), de csak 13% volt elhízott [1]. Az elhízás jelentős egészségügyi problémákhoz vezet, amelyek szinte minden szervrendszert érintenek, beleértve a szív- és érrendszert, valamint az endokrin hasnyálmirigyet, ami 2-es típusú cukorbetegséget okoz. Az elhízás-járvánnyal párhuzamosan a társadalom egyre gyorsabbá vált, számtalan stresszt okozva számunkra, ideértve a helyreállító alvás hiányát is. Ezenkívül az ön által bejelentett alvás időtartama 1,5-2 órával csökkent az elmúlt 50 évben Amerikában [2]. Epidemiológiai és kísérleti kutatások felhalmozódnak, hogy mind a stressz rendszerét [3], mind az alvás minőségét és időtartamát [4] befolyásolja az elhízott egyének.
Egy nemrégiben végzett metaanalízis szerint, amely összesen 23 372 személyt tartalmazott, a pszichés stressz pozitív összefüggésben van az adipozitás mértékével 1–38 évvel később [5]. A teljes hatásméret viszonylag kicsi volt (r = 0,014; 0,002–0,025), és a hatásméretek nagyobbak voltak a férfiaknál, mint a nőknél (0,024 vs. 0,017), hosszabb utánkövetés után, és jobb minőségű vizsgálatokban. A szokásos rövid alvás (általában kevesebb, mint 5 óra éjszakánként) és az elhízás közötti kapcsolatot 45 keresztmetszeti vizsgálat metaanalízisével igazolták tovább, köztük 604 509 felnőtt (OR: 1,55; 1,43–1,68) [6]. Ezenkívül az alváskorlátozás és a krónikus stressz egymástól függetlenül társul. 1300 alanyból álló mintában az észlelt krónikus stressz negatívan kapcsolódott az ön által bejelentett alvás időtartamához [7]. Meg kell azonban jegyezni, hogy ezek a megfigyelési vizsgálatok nem tudják megkülönböztetni az okot és a következményt.
Ebben az áttekintésben megvizsgáljuk az elhízás és a HPA tengely, az elhízás és az alvás, valamint a HPA tengely és az alvás kapcsolatát. A jelentett egyesületek mindegyikénél kritikusan értékeljük a kísérleti vizsgálatokat az ok-okozati viszony és annak irányának meghatározása érdekében. Végül felmérjük azoknak a stratégiáknak a lehetőségét, amelyek célja a HPA-tengely zavarainak javítása és az alvás időtartamának növelése az elhízás elleni küzdelemben.
A HPA-tengely és az elhízás
A HPA-tengely élettana és értékelése
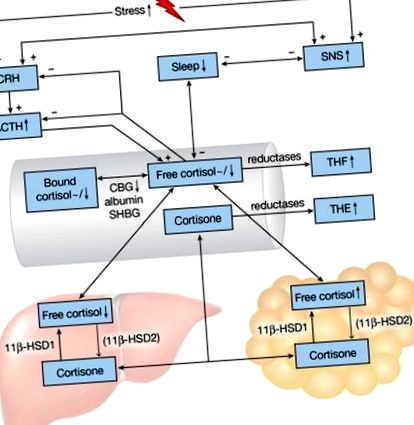
A HPA-tengely és az elhízás alvásváltozásainak sematikus ábrázolása. A plusz, illetve a mínusz jelek pozitív, illetve negatív hatásokat jeleznek. Felfelé/lefelé mutató nyilak és tildék (
A kortizol a cirkadián ritmust ábrázolja, amelynek csúcspontja reggel, majd fokozatos zuhanás következik a nap folyamán, amelyet az étkezés rövid időre megszakít, és hajnali 3 óra körüli mélypont [4]. A kortizolnak csupán 5–10% -a kering aktív, aktív formában; a kortizolkötő globulin (CBG) a legtöbb kortizolt (80–90%) nagy affinitással köti meg, 10–15% pedig alacsonyabb affinitással kötődik az albuminhoz és a nemi hormont kötő globulinhoz (1. ábra) [11, 12]. A CBG 500 nmol/l feletti kortizol szintjén teljesen telített, és a napi változékonyságot is ábrázolja, csúcspontja kora délután van [12, 13].
A kortizolszint a plazmában, a nyálban és a vizeletben meghatározható [13]. A plazmában általában a teljes kortizolszintet mérik, és a megkötetlen, fehérje nélküli frakciót közvetett módon megbecsülik a Coolens-egyenlet felhasználásával [12]. A nyálban végzett mérések felmérik a biológiailag aktív, fehérje nélküli kortizolt; így a CBG-ben az alanyon belüli változások vagy az alanyok közötti különbségek kiküszöbölhetők. A nyálmintákat könnyebb összegyűjteni, mint a plazmát, és az invazív gyűjtés miatt stresszmentesek. Bár a vizelettel szabad kortizol nem konjugált kortizolra vonatkozik, szintje arányos a szabad (nem fehérjéhez kötött) kortizollal a vérben. A vizelet megszerzése ingyenes, nem konjugált kortizol-méréshez szintén stresszmentes, de a teszt 24 órás gyűjtést igényel savas tartósítószer jelenlétében. A nyál kortizolszintje a kortizol plazmaszintjének növekedését követően 5 percen belül növekszik, és bár a szintje 30–50% -kal alacsonyabb, 500 nmol/l alatti értéken általában jól korrelál a plazma szinttel [13].
Két NAPD (H) -függő izoenzim, a 11β-hidroxi-szteroid dehidrogenáz (11β-HSD1 és 11β-HSD2) intracellulárisan alakítja az inaktív kortizont hormonálisan aktív kortizollá és fordítva (1. ábra) [14]. A 11β-HSD1 főleg a májban és a zsírszövetben expresszálódik, míg a 11β-HSD2 a vesében és a vastagbélben fejti ki működését, a kortizol hatását szövetspecifikussá téve. A kortizolt és a kortizont inaktív tetrahidrometabolitokká (THM) metabolizálja a máj 5α- és 5β-reduktáz. A kortizol átalakul kortizollá és tetrahidrokortizolokká (THF, 5α-THF és 5β-THF), míg a kortizon kortizolon és tetrahidrokortizon (THE) metabolizálódik - a vizeletben gyakran mérhető metabolitok. A 11β-HSD1 aktivitásának változását tükrözi a vizelet (THF + 5α-THF + cortol)/(THE + cortolone) arány, pl. A csökkent 11β-HSD1 aktivitás megemelkedett THE szintekhez és alacsonyabb THF szintekhez vezet, ezáltal csökkent (THF + α-THF)/THE arány.
A HPA-tengely és az elhízás társulása
A kortizol reggeli szintje a nyálban és a plazmában vagy nem mutat összefüggést, vagy negatívan korrelál az adipozitás különféle mértékeivel (1. ábra) [15]. A kortizol egyszeri meghatározása általában nem megfelelő a HPA tengely funkcionális állapotának megállapításához, tekintettel annak dinamikus jellegére: a kortizol felébresztésére adott válasz, vagyis a plazma kortizol emelkedése a szokásos ébredési idő után 20–30 perccel informatívabb ebből a célból, de nagyon változó az egyének között. Ezenkívül a kortizol méréseket megzavarhatják a nappali stresszorok. Kétszer óránként mért plazma kortizolszint 24 órán belül folyamatosan alacsonyabb volt elhízott egyéneknél (átlagos BMI 35,4 kg/m 2), összehasonlítva a nem elhízott férfiakkal (átlagos BMI 26,8 kg/m 2) [16]. Más vizsgálatokban a 24 órás vizeletmentes kortizolszint nem korrelált a BMI-vel vagy a derék kerületével, de a kortizol bomlástermékei (THM) pozitívan korreláltak ezekkel az antropometriai mérésekkel [17–19]. A vizeletben az 5β-THE fokozta az elhízást, ami azt jelzi, hogy a kortizon fokozott 5β-redukciója lehet a mechanizmus az elhízás során megnövekedett kortizol-clearance arányában [19]. Tehát úgy tűnik, hogy az elhízásban megnövekedett a forgalom (a kortizol termelése és katabolizmusa) anélkül, hogy szükségszerűen megváltoztatnák a keringési szintet vagy a kortizolt (1. ábra).
Az átlagos 24 órás plazma ACTH szint pozitívan kapcsolódik a BMI-hez, ami valószínűleg a megnövekedett hipotalamusz-hajtást és/vagy a kortizol negatív visszacsatolását tükrözi [16, 24]. A magas BMI-vel rendelkező egyének kevésbé érzékenyek a kortizol szuppressziójára 4 mg dexametazonnal [15], de a dexametazon alacsonyabb dózisával (0,0035 mg/kg és 1 mg) nem [14, 25]. Egy másik tanulmány alacsonyabb kortizol szuppressziót talált nőknél, de férfiaknál nem, 0,0035 mg/kg – 0,015 mg/kg vagy 1 mg dexametazon szokásos dózisával, jelezve, hogy az elhízás és a HPA-szuppresszió közötti összefüggés egyaránt lehet dózis és nem függő [26]. Másrészt az intravénás juh juh CRH-val [16], az ACTH-val [25] vagy a mentális stressz-tesztekkel [25] végzett HPA-stimuláció jobban növelte a kortizol szintjét elhízott és sovány egyéneknél. Így a HPA-tengely hiperreaktívnak tűnik az elhízott egyének stresszére, és mégis kevésbé reagál a negatív visszacsatolásra, esetleg annak megakadályozására, hogy a szabad kortizolszint a normális tartomány alá essen.
Ezenkívül a szimpatikus idegrendszer hiperaktívnak tűnik a központi elhízásban szenvedő alanyokban, amit az izomszimpatikus aktivitás nagyobb idegi kisülése jelez [27]. A hasi zsírszövet fokozott adipokin szekréciója, beleértve a leptint és a szabad zsírsavakat, központilag emelheti a szimpatikus aktivitást, mivel az adipokinek gyakran képesek átjutni a vér-agy gáton. Viszont a krónikusan megemelkedett SNS aktivitás károsíthatja a β-adrenerg jelátvitelt és deregulálhatja a HPA tengelyt, hozzájárulva az elhízáshoz [27].
HPA-tengely változtatások elhízott alanyokban: ok és okozat?
A stressz és a testtömeg-szabályozás közötti összefüggés meghatározása érdekében a HPA-tengelyt elhízott alanyokban vizsgálták a fogyás előtt és után. Tizenhat hét nagyon alacsony kalóriatartalmú étrend 29 kg súlycsökkenést váltott ki, amely a 11β-HSD1 mRNS expressziójának jelentős csökkenésével járt a zsírszövetben [32]. Hasonlóképpen, a 11β-HSD1 mRNS expressziójának négyszeres csökkenéséről számoltak be elhízott nőknél 2 évvel a gyomor-bypass műtét után 40 kg átlagos testsúlycsökkenés után [33]. Ezenkívül ezeknek a nőknek csökkent a vizelet THM-je és csökkent az 5a-redukáz becsült aktivitása, ami azt jelzi, hogy az 5a-reduktáz elhízással összefüggő upregulációja adaptív válasz a hiperkortizáció ellensúlyozására [33]. Az elhízás szubklinikai gyulladása hozzájárulhat a HPA tengely változásához; például az elhízás a keringő IL-6 megemelkedett szintjével társul, ami viszont felemelte a 11β-HSD1 expressziót [34]. Ezek a megállapítások azt sugallják, hogy a HPA-tengely váltakozásai mind az elhízás okai, mind következményei, és potenciálisan reverzibilisek egy pontra.
Alvás elhízásban
Az elégtelen alvás a megnövekedett BMI-vel társult (1. ábra) [4, 6]. Az elhízott felnőttek (BMI: 41 ± 1 kg/m 2) alvási apnoe nélkül 88 perccel kevesebbet aludtak, mint a sovány alanyok, a poliszomnográfia szerint [35]. A prospektív vizsgálatokban egyértelmű, de szerény súlygyarapodás volt tapasztalható rövid alvóknál (kevesebb mint 5–6 óra), akik egy 16 éves vizsgálatban 0,4 kg-ot, egy 6 éves vizsgálatban pedig 2 kg-ot híztak [4]. Azonban a rövid szokásos alvási időtartamú egyének 31% -kal és 35% -kal nagyobb eséllyel kaptak klinikailag jelentős súlygyarapodást (5 kg és 15 kg), ami arra utal, hogy ebben az összefüggésben nagy az egyének közötti változékonyság.
A HPA-tengely és az alvás
HPA-tengely dinamika és alvás
A nem megfelelő alvás következményei a HPA-tengely funkcióra
Az alvás kezdete gátló hatást gyakorol a kortizol szintjére, az alvás kezdete után 1-2 órán keresztül csökkent kortizol szintet indukál [10]. Ezt a hatást akkor figyelték meg, amikor az alanyokat 3 órás alvás-ébrenlét ciklusnak tették ki, vagy nappal aludtak. A kortizolszint gátlását „szabadon futó” körülmények között is megfigyelték, amikor az egyéneknek nincs időjelük, és az alvás általában a belső cirkadián kortizolritmus későbbi szakaszában kezdődik [10]. Ezenkívül az éjszakai ébredés átmenetileg megemeli a kortizol szintjét, míg a reggeli ébredés a kortizol szintjének jelentős és tartósabb emelkedését idézi elő. A lassú hullámú alvás korrelál a legalacsonyabb kortizolszinttel és a legalacsonyabb kortizol/ACTH válaszsal a CRH beadására [10].
A nyál és a plazma kortizol szintje emelkedett délután és este a kísérleti részleges és teljes alváshiány után, míg a reggeli szint változatlan vagy akár csökkent is [4]. A 30 percenként mért átlagos 24 órás plazma kortizolszint változatlan [4]. Egyes tanulmányok az alvásmegvonást követően csökkent kortizolcsúcsról és az akrofáz utáni kortizolszint lassabb csökkenéséről is beszámolnak [4]. Ezen túlmenően az alvás megzavarhatja a HPA-tengely dinamikáját: a rossz alvást jelző alanyok túlzott választ mutattak a kombinált dexametazon/CRH kihívásra [40 •].
Az akut alváshiány egy olyan stresszor, amelyről ismert, hogy aktiválja a szimpatikus aktivitást, miközben csökkenti a paraszimpatikus tónust, amire utal az epinefrin és a noradrenalin megemelkedett plazmaszintje (1. ábra) [4].
A HPA-változások következményei az alvásra
A Cushing-szindrómás betegeknél gyakran obstruktív alvási apnoe van, ami viszont befolyásolja az alvás minőségét [16, 41]. Ezenkívül az ACTH-függő Cushing-szindrómában szenvedő betegeknél alvási apnoe nélkül 18% -kal csökken az alvás hatékonysága (az alvás és az ágyban töltött idő aránya), a betegek kétszer olyan gyakran ébredtek (6 és 3-szor), és 12 Az 1. szakasz alvásának% -os növekedése a normál kontrollhoz képest [41]. Ez a keringő glükokortikoidok abnormálisan magas szintjének alvásra gyakorolt közvetlen káros hatásait mutatja. Az Addison-kórban szenvedő betegek alvását kevésbé vizsgálták, de nem mutatnak súlyos alvászavarokat [42, 43]. A hidrokortizonnal végzett helyettesítő kezelés után azonban ezeknél a betegeknél a REM alvási időtartama nőtt [42].
A juh intravénás CRH vagy ACTH beadása csökkentette a REM és az SWS értékét [43]. A kortizol infúzió szintén csökkentette a REM-t, miközben növelte az SWS-t, jelezve, hogy a REM-re gyakorolt HPA-tengely hatásai kortizol-mediáltak lehetnek, de a kortizol-infúzióban az SWS növekedése a CRH-val kapcsolatos negatív visszacsatolásnak köszönhető [43]. A szintetikus szteroid prednizolon beadása csökkentette a REM értéket, de nem volt hatással az SWS-re [43].
Küzdelem a HPA-tengely megváltoztatásával és az alvásvesztéssel: újszerű terápiák az elhízás ellen?
Mivel úgy tűnik, hogy a HPA-tengely és az alvásváltozások is befolyásolják a testtömeg-szabályozást és az összetételt, életképes stratégiának tűnik az elhízási járvány leküzdése. Egy nemrégiben végzett randomizált kontroll súlycsökkentő vizsgálat arról számolt be, hogy a túlsúlyos vagy elhízott afrikai-amerikai nők, akik önmaguk szerint magas stresszszinttel jártak, hajlamosak voltak nagyobb súlyt csökkenteni, ha a stresszkezelő terápiát hozzáadták egy 12 hetes életmód-programhoz (2,7 vs. 1,4 kg); következetesen ebben a csoportban a reggeli nyál kortizol nagyobb mértékben csökkent [44 •]. Ennek a kis tanulmánynak korlátozott statisztikai ereje volt, csoportonként csak 22 nő volt, de arra utal, hogy az általános stresszszint csökkenése hozzájárulhat a fogyáshoz.
Az elhízás elleni újszerű farmakológiai megközelítések a HPA-tengely manipulálásával a 11β-HSD inhibitorokra összpontosítottak, amelyek elvileg lehetővé tennék a kortizol koncentrációjának szövetspecifikus megváltoztatását, anélkül, hogy befolyásolnák a keringési szintet. A karbenoxolon a 11β-HSD1 és 11β-HSD2 nem szelektív inhibitora. Néhány, ezt az inhibitort használó tanulmány szerint alacsonyabb a 11β-HSD1 expressziója a zsírszövetben, míg mások nem [19, 20 •]. Egy tanulmány egészséges betegeknél alacsonyabb koleszterinszintről és csökkent glükogenolízisről számolt be, 7 napos 300 mg karbenoxolon beadása után [45]. A 11 • -HSD2 gátlás azonban kortizol-függő mineralokortikoid-felesleghez vezethet, mivel a kortizol aktiválhatja a vese ásványi-kortikoid receptorát, kiváltva a nátrium-visszatartást, a hipokalaemiát és a folyadékretenciót.
Az alvás időtartamának meghosszabbítása krónikusan alváshiányos betegeknél kihívást jelentő feladat. Egy kisméretű megfigyelési tanulmány arról számolt be, hogy azok a rövid alvók (éjszakánként kevesebb, mint 6 óra; átlagos BMI 27 kg/m 2), akik 6 évvel később 7–8 óráig meghosszabbították alvásukat, egy ponttal emelkedtek a BMI-ben, míg azok az egyének, akik még alvásról számoltak be éjszakánként kevesebb mint 6 óra növelte a BMI-jüket 2,1 ponttal [49]. Ezt a vizsgálatot nem randomizálták, és az alvás időtartamát csak két időpontban és kérdőívvel, szubjektív méréssel értékelték. Jelenleg egy nagy, randomizált, kontrollált nyomvonalat folytatunk (ClinicalTrials.gov, azonosító:> NCT00261898), hogy megvizsgáljuk az alváshosszabbítás hatását rövid alvó, elhízott egyének kohortjában [50 •].
Következtetések
Az elhízott alanyok változást mutatnak a HPA-tengelyben és az alvásban egyaránt. Bár a keringő kortizolszintek elhízott egyéneknél gyakran nem változnak, a HPA-tengely hiperaktívnak tűnik, mivel a kortizol-koncentrációk szövetspecifikus változásai vannak a 11β-HSD-k differenciál expressziója miatt. A rövid szokásos alvási idő és a kísérleti alváskorlátozás olyan testi változásokat eredményez, amelyek elhízáshoz vezethetnek, esetleg megnövekedett étvágy és táplálékbevitel révén, de az elégtelen alvás megzavarja a HPA-tengelyt is. Mindazonáltal a HPA-tengely dinamikáját ebben az állapotban vizsgáló tanulmányok kevések, és legjobb tudásunk szerint nincs közvetlen információ például a 11β-HSD aktivitás, a keringő CBG szint és az alvás specifikus összefüggéseiről. Viszont a HPA-tengely aktiválása negatívan befolyásolhatja az alvást. Bár beszámoltak az alvási apnoe fokozott előfordulásáról vagy a fokozott stressz/HPA-aktivációról, nincs közvetlen bizonyíték arra vonatkozóan, hogy az elhízás rosszabb alváshoz vezetne.
Mivel úgy tűnik, hogy az alvásvesztés és a HPA-tengely részt vesz az elhízás patogenezisében, úgy tűnik, hogy e rendszerek modulálására irányuló megközelítések életképesek. A szövetspecifikus 11β-HSD1 inhibitorok létrehozása különösen ígéretes, mivel ez hatékonyan megcélozhatja a kortizolt a kiválasztott szövetekben anélkül, hogy befolyásolná a keringő kortizol szintjét, ezért korlátozott nem kívánt mellékhatásokkal jár. A fentiekben összefoglalt mechanizmus alapján egy új gyógyszerosztály vonzerejét tükrözi a folyamatban lévő kutatások nagysága. Jelenleg klinikai vizsgálatokat végeznek, amelyek az általános stressz szintjének csökkentésére vagy az alváshigiéné javítására az alvás időtartamának növelésével koncentrálnak.
Összegzésképpen elmondható, hogy az elhízás, az alvás és a HPA-tengely egy káros ciklusban kapcsolódik egymáshoz, sok komplex interakcióval, beleértve az immunrendszert és az étvágyszabályozást. További kutatásokra van szükség ezen a területen, hogy megértsük a rendszerek változásait és végül az elhízás elleni küzdelmet.
Köszönetnyilvánítás
Ezt a tanulmányt teljes mértékben támogatta az Országos Egészségügyi Intézet (NIH), Intramural Research Program: National Institute of Diabetes and Emésztési és Vesebetegségek (NIDDK). Ezúton szeretnénk köszönetet mondani Dr. Csako Györgynek a hasznos javaslatokért a cikk áttekintése során.
E.A. Lucassen támogatási támogatást kapott Fulbright ösztöndíjból, VSBfonds ösztöndíjból, Leideni Egyetemi Alap ösztöndíjból. G. Cizza támogatási támogatást kapott a ZIA DK047054-04 krónikus alváshiánytól, mint az endokrin és immunváltozások kockázati tényezőjétől.
Lábjegyzetek
Közzététel A cikk szempontjából lényeges összeférhetetlenségről nem számoltak be.
Közreműködői információk
Eliane A. Lucassen, Neurofiziológiai Laboratórium, Molekuláris Sejtbiológiai Tanszék, Leideni Egyetem Orvosi Központ, Leiden, Hollandia.
Giovanni Cizza, az elhízás neuroendokrinológiájának szekciója, NIDDK, National Institutes of Health, 10. épület, CRC, Rm 6-3940, Bethesda, MD 20892-1613, USA.
Hivatkozások
A közelmúltban megjelent, különös érdeklődésű dolgozatokat a következőkként emelték ki:
- A gyermekkori elhízás és a krónikus betegség közötti kapcsolat cikkek Mount Nittany Health System
- Az elhízás világszövetsége az elhízást krónikusan kiújuló progresszív betegségként ismeri el
- Az alvás és az elhízás kapcsolata
- A súlyos elhízás kezelése a nehézlégzés csökkentése érdekében krónikus tüdőbetegségben szenvedő betegeknél
- A krónikus fájdalom és az elhízás kapcsolatának megértése HCPLive