A hosszú hatású kokain-hidroláz lehetséges elhízásellenes hatásai
Xirong Zheng
Molekuláris Modellezési és Biofarmáciai Központ, Gyógyszerészeti Főiskola, Kentucky Egyetem, 789 South Limestone Street, Lexington, KY 40536
b Gyógyszerésztudományi Tanszék, Gyógyszerészeti Főiskola, Kentucky Egyetem, 789 South Limestone Street, Lexington, KY 40536
Jing Deng
Molekuláris Modellezési és Biofarmáciai Központ, Gyógyszerészeti Főiskola, Kentucky Egyetem, 789 South Limestone Street, Lexington, KY 40536
b Gyógyszerésztudományi Tanszék, Gyógyszerészeti Főiskola, Kentucky Egyetem, 789 South Limestone Street, Lexington, KY 40536
Ting Zhang
Molekuláris Modellezési és Biofarmáciai Központ, Gyógyszerészeti Főiskola, Kentucky Egyetem, 789 South Limestone Street, Lexington, KY 40536
b Gyógyszerésztudományi Tanszék, Gyógyszerészeti Főiskola, Kentucky Egyetem, 789 South Limestone Street, Lexington, KY 40536
Jianzhuang Yao
Molekuláris Modellezési és Biofarmáciai Központ, Gyógyszerészeti Főiskola, Kentucky Egyetem, 789 South Limestone Street, Lexington, KY 40536
b Gyógyszerésztudományi Tanszék, Gyógyszerészeti Főiskola, Kentucky Egyetem, 789 South Limestone Street, Lexington, KY 40536
Fang Zheng
Molekuláris Modellezési és Biofarmáciai Központ, Gyógyszerészeti Főiskola, Kentucky Egyetem, 789 South Limestone Street, Lexington, KY 40536
b Gyógyszerésztudományi Tanszék, Gyógyszerészeti Főiskola, Kentucky Egyetem, 789 South Limestone Street, Lexington, KY 40536
Chang-Guo Zhan
Molekuláris Modellezési és Biofarmáciai Központ, Gyógyszerészeti Főiskola, Kentucky Egyetem, 789 South Limestone Street, Lexington, KY 40536
b Gyógyszerésztudományi Tanszék, Gyógyszerészeti Főiskola, Kentucky Egyetem, 789 South Limestone Street, Lexington, KY 40536
Társított adatok
Absztrakt
A humán butiril-kolinészterázból (BChE) gyártott, hosszan ható hatású kokain-hidrolázt (CocH3-Fc (M3)) tesztelték ebben a vizsgálatban annak lehetséges elhízás elleni hatása szempontjából. A magas zsírtartalmú étrendben lévő egerek lényegesen kevesebb testtömeget nyertek, ha hetente 1 mg/kg CocH3-Fc-vel (M3) kezelték a kontroll egerekhez képest, bár táplálékfelvételük hasonló volt. Nincs összefüggés az átlagos testtömeg és az átlagos táplálékbevitel között, ami összhangban áll a BChE knockout egerekben korábban közölt megfigyeléssel. Ezenkívül molekuláris modellezést hajtottak végre annak megértésére, hogy a ghrelin hogyan kötődik a CocH3-hoz, megmutatva, hogy a ghrelin hasonló módon kötődik a CocH3-hoz, mint a vad típusú humán BChE-hez. A hasonló kötési struktúra mód megmagyarázza, hogy a CocH3 miért hasonló katalitikus aktivitással rendelkezik a ghrelin ellen.
Bevezetés
A Ghrelin, az 1999-ben felfedezett „éhség hormon” néven ismert gyomor peptid hormon [10] egy 28 aminosavból álló peptid (GSSFLSPEHQKAQQRKESKKPPAKLQPR), amelynek Ser3 oldallánca zsíros savval (n-oktánsavval) acilezett. Tehát a ghrelin egy n-oktanoilezett peptid. Az acilezés nélküli (28-aminosav) peptid (n-oktanoilezés) desacil-ghrelin néven ismert [11]. Ez az acilezési reakció, amelyet egy ghrelin O-aciltranszferáz (GOAT) néven ismert enzim katalizál, elengedhetetlen a ghrelin fiziológiai aktivitásához a növekedési hormon szekretagóg receptorokkal (GHSR) a központi idegrendszerben, amelyek közvetítik a hiperfágiát és az adipozitást [12]. Úgy gondolják, hogy a ghrelin a gyomorban termelődik, elsősorban a gyomor sejtjeiből szabadul fel, és a vérkeringés révén az agyba jut. Az agyban a ghrelin éhség ébresztése érdekében kölcsönhatásba lép mind az agy hipotalamuszával (fiziológiai étkezési központ), mind pedig az örömérzés központjaival [13]. Eddig a ghrelin az egyetlen ismert hormon, amely serkenti az éhségérzetet és a táplálékfelvételt [1], amely megmondja, mikor kell enni. Ezenkívül a ghrelin szint természetesen drámai módon változik egy nap folyamán. Különösen a ghrelin szint meredeken emelkedik böjtöléssel vagy étkezés előtt, és étkezés után csökken [13]. Ezért a ghrelin újszerű, potenciálisan vonzó elhízás elleni gyógyszer célpontként jelenik meg [7].
A ghrelinre koncentrált gyógyszerfelfedezési törekvések célja a túlsúlyos emberek étvágyának csökkentése különböző megközelítésekkel, ideértve a ghrelin felszabadulás szabályozását, a ghrelin receptor antagonizmust és az aktív ghrelin termelés csökkentését a GOAT gátlásával [14–18]. Ezek az erőfeszítések azonban még mindig nem hoztak létre klinikailag hasznos gyógyszert.
A grelin fent említett fiziológiai és biológiai mechanizmusainak fényében az ideális terápiás megközelítés közvetlenül inaktiválná magát a grelint, és a grelint peptid formává (desacil-ghrelin) alakítaná át, amely nélkülözi az étvágyat kiváltó tulajdonságait hatékony ghrelin-metabolizáló enzim alkalmazásával. Például a GOAT gátlása csökkentené az (aktív) ghrelin termelését, de nem inaktiválhatja a szervezetben már előállított grelint. A ghrelin-metabolizáló enzim közvetlenül inaktiválná a grelint azáltal, hogy a grelint desacil-grelinné alakítja, és ezáltal hatékonyabban csökkenti az étvágyat. A testben a ghrelin szintjének szabályozását célzó nagy erőfeszítések ellenére nincs olyan terápiás jelöltről szóló jelentés, amely felhasználható lenne a ghrelin közvetlen inaktiválására a ghrelin desacil-ghrelinné történő átalakításával.
Kimutatták azt is, hogy az ígéretesebb CocH3 képes nemcsak maga a kokain, hanem toxikus metabolitjai (norkokain és kokaetilén) is hatékonyan lebontani [34, 35]. Nemrégiben hosszú hatású CocH3 formát terveztünk, készítettünk és teszteltünk [36], egy olyan fúziós fehérjét, amelyben a CocH3 fúzióban van az Fc régió hármas mutánsának (azaz A1V/D142E/L144M) N-terminálisával. humán immunglobulin G1 (IgG1). A kapott fúziós fehérje, amelyet CocH3-Fc (M3) néven jelölünk, és katalitikus antitest analógnak tekintünk, ugyanolyan aktív, mint a be nem olvadt CocH3 a katalitikus aktivitása szempontjából (mivel az Fc fúzió várhatóan nem változtatja meg a CocH3 katalitikus aktivitását bármilyen szubsztrát), de lényegesen hosszabb biológiai felezési ideje van (pl. t1/2 =
Patkányokban 107 óra), mint egy antitest [36]. Az állatok viselkedési tesztjeiben a CocH3-Fc (M3) egyetlen dózisa 20 nap elteltével is képes volt felgyorsítani a kokain metabolizmusát patkányokban, és így hosszú ideig blokkolni a kokain által kiváltott hiperaktivitást és toxicitást [36].
A kokain-visszaélés kezelésére vonatkozó ígéretes preklinikai adatok [36] és a CocH3 ghrelin elleni újonnan jelentett katalitikus aktivitása [33] alapján szeretnénk tudni, hogy a CocH3-Fc (M3) ismételt adagolása hatékony lehet-e az elhízás kezelésében. és miért aktív a CocH3 a ghrelin ellen. Ebből a célból a jelen tanulmányban megvizsgáltuk az 1 mg/kg CocH3-Fc (M3) heti adagolásának hatását a magas zsírtartalmú étrendet tápláló C57BL/6 egerek testtömegére. Ezenkívül elvégeztük a CocH3-ghrelin kötődés molekuláris modellezését is, összehasonlítva a megfelelő vad típusú humán BChE-ghrelin kötéssel. A kapott adatok arra utalnak, hogy a CocH3-Fc (M3) valóban ígéretes az elhízás kezelésében, és lehetséges olyan terápiás enzim kifejlesztése, amely hatékony mind a kokain-visszaélés, mind az elhízás kezelésére.
Anyagok és metódusok
Anyagok
Hím C57BL/6 egereket (26–30 g) Harlan-tól (Indianapolis, IN) rendeltünk. Az F3282 magas zsírtartalmú étrendet a Bio-Serv-től (Flemington, NJ) rendelték. Az ebben a vizsgálatban használt tisztított CocH3-Fc (M3) fehérjét korábbi tanulmányunkban készítettük [36]. Röviden: a CocH3-Fc (M3) fehérjét stabil CHO-S sejtekben fejeztük ki (laboratóriumunkban lentivírus alapú módszerrel fejlesztették ki), amelyek stabilan képesek előállítani a CocH3-Fc (M3) fehérjét. A fehérjetermelést BioFlo/CelliGen 115 (Eppendorf, Hauppauge, NY) keveréses bioreaktorban végeztük. A táptalajban lévő CocH3-Fc-t (M3) a fent említett protein A affinitáskromatográfiával tisztítottuk, amelyet ÄKTA Avant 150 rendszeren (GE Healthcare Life Sciences, Pittsburgh, PA) hajtottunk végre. A tisztított fehérjét tároló pufferben dializáltuk, és használat előtt -80 ° C-on tároltuk.
Állatkísérletek
A hím C57BL/6 egereknek magas zsírtartalmú F3282 étrendet és ad libitum vizet adtak, és 12 órás fény/12 órás sötét ciklus alatt tartották, a fényeket 8:00 órakor világították meg 21–22 ° C-os szobahőmérsékleten. A kísérleteket ugyanabban a telephelyen hajtották végre, a laboratóriumi állatok gondozására és felhasználására vonatkozó útmutatónak megfelelően, amelyet az Országos Egészségügyi Intézet elfogadott és kihirdetett. Az egereket véletlenszerűen két csoportra osztottuk. A kezelt csoportba tartozó egereknek (n = 7) intravénásán (IV) adtunk egy pufferoldatot (foszfátpufferolt sóoldat) 1 mg/kg CocH3-Fc-t (3M) tartalmazó hetente egyszer, azaz 1 mg/kg intravénás adagolással. A CocH3-Fc (3M) a 0., 7., 14., 21., 28., 35. és 42. napon. A kontrollcsoport (n = 5) egereinek intravénás beadását intravénásan, azonos pufferoldattal, enzim nélkül, hetente egyszer végeztük. Tehát az egyetlen különbség az injektált oldatban a két csoport között az, hogy 1 mg/kg CocH3-Fc (3M) van a kezelési csoportban. A két különböző csoportba tartozó egereket külön-külön ketrecbe tettük. A testtömegeket naponta rögzítettük 44 napig, és az ételfogyasztást a kiszolgált étel és az egyes ketrecekben maradt étel súlyozásával mértük.
Molekuláris modellezés
Sztochasztikus határmolekuladinamikai (MD) módszert [44] alkalmaztunk referenciaként a Ser198 oldallánc oxigénatomjával (Oγ). A reakció régió egy gömb volt, amelynek sugara (r) 20 Å, és a pufferrégió 20 Å ≤ r ≤ 22 Å fölé nyúlt. Az enzim Ser198 oldalláncán lévő hidroxil-oxigéntől 22 Å-nél hosszabb távolságban lévő összes atomot rögzítettük. A hidrogénatomokat tartalmazó összes kötést a SHAKE algoritmus segítségével korlátoztuk [45]. A teljes sztochasztikus határrendszer kezdeti felépítését a legmeredekebb süllyedés (SD) és az elfogadott Newton-Raphson (ABNR) módszerekkel optimalizálták. A mozgásegyenlet integrálásához 1-fs idő lépést alkalmaztunk. Az enzim-ghrelin komplex szolvatált rendszerét fokozatosan 50,0 K-ról 298,15 K-ra melegítették MD-szimulációban 100 ps-ig, majd MD-t termeltek, amíg az MD pályája stabilvá vált (legalább 1 ns-ig). A stabil MD pálya utolsó pillanatképét az energia minimálisra csökkentette az ABNR módszer alkalmazásával az enzim-ghrelin kötő komplex végső szerkezetének előállításához a kötési mód elemzéséhez.
Eredmények
A CocH3-Fc (M3) hatása a testsúlyra és az élelmiszer-bevitelre
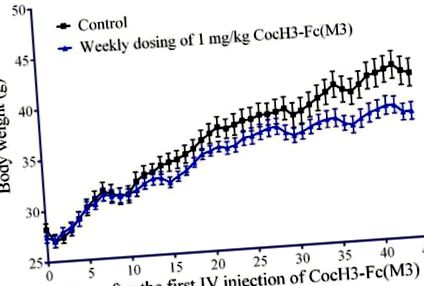
Amint az 1. ábrán látható, a magas zsírtartalmú étrendben táplált egerek átlagos testtömege a kezelt csoportban (n = 7) nem különbözött szignifikánsan a kontrollcsoportétól (n = 5) az első 10 napban. 11 nap elteltével az átlagos testtömeg eltér a két csoport között, és a különbség egyre nagyobb. Az adatok arra utalnak, hogy az 1 mg/kg CocH3-Fc (M3) heti adagolása jelentősen befolyásolta a zsírtartalmú étrendben táplált egerek testtömegét. Nevezetesen, az enzim az első 10 napban nem befolyásolta szignifikánsan a magas zsírtartalmú étrendben táplált egerek átlagos testtömegét, de az enzim átlagos testtömegre gyakorolt hatása 11 nap múlva vált szignifikánssá.
A magas zsírtartalmú étrendben táplált egerek testsúlya. A kezelt csoportba tartozó egereknek (n = 7) hetente egyszer (1 mg/kg CocH3-Fc (3 M) tartalmazó pufferoldatot (IV) adtunk. A kontroll csoportba tartozó egereknek (n = 5) intravénásán adtuk be ugyanazt a pufferoldatot, enzim nélkül.
Megpróbáltuk azonosítani a zsírtartalmú étrendben táplált egerek átlagos testtömege és napi átlagos táplálékfogyasztása közötti összefüggést is. Meglepő módon a két csoport között nem volt szignifikáns különbség az átlagos táplálékfogyasztásban, amint azt a 2. ábra mutatja. A megfigyelési időszak (44 nap) átlagos napi táplálékfogyasztása mindig az volt
3,0 g/egér mindkét csoport esetében. Tehát a CocH3-Fc (M3) nem befolyásolta szignifikánsan a napi teljes táplálékfelvételt. Ezen eredmények szerint a napi teljes táplálékfelvétel nem az egyetlen tényező, amely befolyásolja a testtömeget, és nincs összefüggés az átlagos testtömeg és a napi átlagos táplálékfelvétel között. Ezek az adatok összhangban vannak a Lockridge és munkatársai által korábban közölt megfigyeléssel. [20]. Megfigyelték, hogy a BChE knockout egerek elhízottak magas zsírtartalmú étrend mellett, és hogy a BChE knockout egerek nem fogyasztottak több ételt a vad típusú egerekhez képest [20]. A megfigyelés alapján Lockridge és mtsai. [20] arra a következtetésre jutott, hogy a BChE knockout egerek súlygyarapodása a csökkent zsírfelhasználás, nem pedig a megnövekedett táplálékbevitel eredménye volt. Ebben a vizsgálatban az enzimadagolással kapcsolatos adataink tovább támasztják alá következtetésüket.
A magas zsírtartalmú étrendben táplált egerek átlagos táplálékfogyasztása (g/egér). A kezelt csoportba tartozó egereknek (n = 7) hetente egyszer (1 mg/kg CocH3-Fc (3 M) tartalmazó pufferoldatot (IV) adtunk. A kontroll csoportba tartozó egereknek (n = 5) intravénásán, azonos enzim nélküli pufferoldattal adtuk be.
Enzim-ghrelin kötés
Annak megértése érdekében, hogy a CocH3 miért hasonlít a vad típusú humán BChE-hez a ghrelin elleni katalitikus hatékonyságban, molekuláris modellezést hajtottak végre mind a CocH3, mind a vad típusú humán BChE-vel való ghrelin-kötésen. A kapott enzim-ghrelin kötő struktúrákat a 3. ábra szemlélteti. Amint a 3. (A) ábrán látható, a ghrelin a BChE-vel kötődik a BChE Ser198 oldalláncán hidroxil oxigénhez (O γ) alkalmas módban, hogy nukleofil támadást indítson a n-oktanoilezett Ser3 oldalláncon a karbonil-szénnél (C). ghrelin, a C – O γ távolsággal
3,04 Å. Eközben a ghrelin n-oktanoilezett Ser3 oldalláncán lévő karbonil oxigén az oxianion lyukban van (a BClyE Gly116, Gly117 és Ala199 gerincváz NH csoportjaiból áll), stabil hidrogénkötéssel a BChE Gly117 gerinc NH csoportjával. (2,02 Å N ··· H távolsággal). Amint a 3. (B) ábrán látható, a CocH3-ghrelin kötési mód nagyon hasonló a BChE-ghrelin kötődéshez, a C – O γ távolság pedig
3,26 Å (kb. 0,22 Å hosszabb). A ghrelin n-oktanoilezett Ser3 oldalláncán lévő karbonil-oxigén szintén a CocH3 oxianion lyukában található, kissé gyengébb hidrogénkötéssel a CocH3 Gly117 gerinc NH csoportjával (2,20 Å N ··· H távolsággal). a vad típusú emberi BChE. A hasonló enzim-ghrelin kötési mód segít megérteni, hogy a CocH3 miért hasonló katalitikus aktivitással rendelkezik a ghrelin ellen.
A molekuladinamikai szimulációkból és az energia minimalizálásából nyert enzim-ghrelin kötő struktúrák. (A) Vad típusú emberi BChE kötődés ghrelinnel. (B) CocH3 kötése grelinnel. Az ábra csak az enzim és a ghrelin maradványait mutatja az aktív hely közelében, amelyben a nagy sárga tömeg a ghrelin van der Waals felületét képviseli.
Vita
Ismert, hogy a CocH3-Fc (M3), a CocH hosszú hatású formája (humán BChE mutáns, jelentősen javított katalitikus hatékonysággal a kokain ellen), rendkívül hatékony a kokain-visszaélés kezelésében. Jelen tanulmány tovább demonstrálta a CocH3-Fc (M3) lehetséges elhízásellenes hatását. Ezért a CocH3-Fc (M3) értékes lehet nemcsak a kokain-visszaélés, hanem az elhízás kezelésében is, ami jó hír a CocH (BChE mutáns) alapú enzimterápiás fejlesztés szempontjából. Másrészt a CocH3-Fc (M3) lehetséges elhízásellenes hatása mérsékelt lehet, mivel viszonylag alacsony a ghrelin elleni katalitikus hatékonysága a kokainnal szemben. A CocH-alapú enzimterápia fejlesztésének egy CocH3-Fc (M3) variáns racionális tervezésére kell összpontosítania, amelynek jelentősen javult a ghrelin elleni katalitikus hatékonysága, anélkül, hogy csökkentené a kokain elleni katalitikus hatékonyságot. Egy ilyen CocH3-Fc (M3) variáns hatékony lehet mind a kokain, mind a ghrelin hidrolizálásában, ezért rendkívül hatékony lehet mind a kokain-visszaélés, mind az elhízás kezelésében. Ezenkívül a kapott CocH3-ghrelin megkötő szerkezet kiindulópontként használható a kívánt CocH3-Fc (M3) variáns jövőbeni racionális tervezéséhez.
Következtetések
Kimutatták, hogy a CocH3-Fc (M3) jelentősen befolyásolhatja a magas zsírtartalmú étrendben táplált egerek testtömegét, de nem befolyásolja a napi teljes táplálékfelvételt. Nincs összefüggés az átlagos testtömeg és az átlagos táplálékbevitel között, ami összhangban áll a BChE knockout egerekben korábban közölt megfigyeléssel. Ezenkívül a molekuláris modellezés fényében a ghrelin hasonló módon kötődik a CocH3-hoz, mint a vad típusú humán BChE-hez kötődő ghrelin, ami megmagyarázza, hogy a CocH3 miért hasonló katalitikus aktivitással rendelkezik a ghrelin ellen, mint a vad típusú humán BChE. A kapott enzim-ghrelin kötési mód kiindulópontként szolgálhat a CocH3-Fc (M3) variáns jövőbeni racionális tervezéséhez és felfedezéséhez, jelentősen javítva a ghrelin elleni katalitikus hatékonyságot anélkül, hogy csökkentené a kokain elleni katalitikus hatékonyságot.
Kutatási kiemelések
A hosszú hatású CocH heti adagolása jelentősen befolyásolta az egerek testtömegét.
A hosszú hatású CocH heti adagolása nem befolyásolta az egerek táplálékfelvételét.
A Ghrelin hasonló kötési módban kötődik a CocH-hoz és a vad típusú humán BChE-hez.
A CocH értékes lehet nemcsak a kokain-visszaélés, hanem az elhízás kezelésében is.
- Az új keserű dinnye kivonat metabolikus és elhízás elleni hatásokat mutat
- Potenciális Gotu Kola egészségügyi előnyök mellékhatások - SelfHacked
- A pankreatin felhasználása, mellékhatások, lehetséges gyógyszerkölcsönhatások
- Oregano Egészségügyi előnyök, felhasználások és mellékhatások
- Az orlisztát-akarbóz kombináció megkönnyítheti a fogyást, kevesebb GI hatással szemben