A káposzta mikrobiális sokfélesége Pest Delia radicum több életszakaszban
Társított adatok
A cikk következtetéseit alátámasztó nyers adatok az NCBI-n érhetők el a BioProject PRJNA573643 címen. További adatokat, például az ábrák előállításának kódját, indokolatlan fenntartás nélkül minden képesített kutató rendelkezésére bocsátják.
Absztrakt
Bevezetés
A különböző rovarfajok mikrobiális közösségprofiljait jellemző vizsgálatok egyre nagyobb figyelmet kapnak, a Delia radicum káposzta gyökérlégy mikrobiomjáról azonban nem sokat tudni. Ez a növénykárosító pusztító termésveszteséget okozhat sok népszerű zöldségnövénynél, például káposzta, karalábé vagy repce esetében (Soroka et al., 2004; Dosdall et al., 2012). E faj nőstényei petéiket a keresztes növények szárára vagy annak közelébe rakják, és a feltörekvő lárvák a gyökérszövetbe fúródnak. A lárvák általában a növényi szövet belsejében maradnak, csak közvetlenül a kölyökképzés előtt költöznek a talajba, és később felnőttként jelennek meg (Smith, 1927). A metamorfózis drasztikus változásokat okoz a rovarok anatómiájában és fiziológiájában, és más rovarokról szóló tanulmányok arról számolnak be, hogy drasztikus hatással lehet a kapcsolódó mikrobiomra is (Geib et al., 2009; Hammer et al., 2014; Hammer and Moran, 2019).
Anyagok és metódusok
Delia radicum Nevelés
A D. radicum kiindulási telepét képező petesejteket a Wageningen Egyetemről (Entomológiai Laboratórium, Prof. Joop van Loon) szereztük be. A legyeket egy entomológiai ketrecben (60 × 60 × 120 cm) tartották, vízhez ad libitum hozzáféréssel és élesztő kivonatból, sovány tejporból és szacharózból álló száraz étel 1: 1: 1 arányú keverékével. A ketreceket laboratóriumban, páratartalom-szabályozás nélkül, szobahőmérsékleten és természetes megvilágításban tartották. Tenyésztési célokra egy kis műanyag edényt (12 × 12 × 6 cm, ma tojásdoboznak neveznek) 1 cm nedvesített folyami homokkal töltöttek meg, amelyre fehérrépát (B. rapa subsp. Rapa) tettek a tojás lerakódásának megkönnyítésére. . A tojásdobozokat egy hét múlva mozgatták ki az entomológiai ketrecből, és a lárvákat kb. 4 hétig hagyták táplálni a szállított fehérrépával a bábozásig. A bábokat ezután elválasztották a folyó homokjától a tojásdoboz elárasztásával és a víz szitálásával, majd a bábokat az eklózióig visszatették egy entomológiai ketrecbe, jelezve ezzel egy új generáció kezdetét.
Mintavásárlás
Fehérrépa (TURN1-5)
A fehérrépa (B. rapa subsp. Rapa) bőrét felületesen, körülbelül 2 mm vastag felületi sterilizált borotvapengével vágtuk le. Körülbelül 5 g anyagot habarcs és mozsár segítségével folyékony nitrogénben homogenizáltunk. Körülbelül 0,25 g homogén anyagot használtunk felfelé a PowerSoil DNS extrakciójával.
Bomló fehérrépaszövet (PULP1-5)
Körülbelül 200 mg macerált szövetmintát egy D. radicum tőzeggel fertőzött fehérrépából közvetlenül egy PowerSoil csőbe helyeztünk felületi steril spatulával.
Tojás (EGGS1-5)
Körülbelül 200 D. radicum petesejt gyűlt össze úgy, hogy a tojástartókat (nem sterilizált) demi vízzel elöntöttük, és a lefolyást egy vékony nyakú mérőlombikba gyűjtöttük, hogy az úszó tojásokat a lombik tetejére koncentráljuk. Ezután Whatman-szűrővel összegyűjtötték és egy szűrőtartóba tették. Egy másik Whatman-szűrőt tettünk a tetejére, és a tojásokat fecskendő segítségével 5 ml következő oldatokkal mostuk: milliQ víz, 6,5% fehérítő, 70% etanol és milliQ víz. Ezt követően a tojásokat tartalmazó Whatman-szűrőket folyékony nitrogénben történő fagyasztással, majd mozsárral és zúzóval összezúztuk. A homogenizátumot utólag használtuk a DNS-extrakcióban a PowerSoil kit alkalmazásával.
Lárvák (MAGG1-10)
Húsz lárvát gyűjtöttünk steril csipesszel, és -20 ° C-on tároltuk a DNS kivonásáig. A DNS-kivonás előtt az összeset 5 ml steril MQ vízzel, majd 5 ml 70% -os etanollal, majd 5,5–7,5% aktív klór fehérítővel mostuk, majd végül ismét 5 ml MQ-ban öblítettük. Ezt követően az egész lárvákat mozsárban és mozsárban folyékony nitrogénben homogenizáltuk.
Bábok (PUPA1-5)
40–100 bábot gyűjtöttünk össze egy tojásdoboz csapvízzel való elöntésével és a bábokat tartalmazó felső folyadék általános szitán való átfuttatásával. A DNS kivonása előtt az összes bábut felületi sterilizálásnak vetették alá a lárva mintákkal megegyező módon. Ezt követően az egész bábot mozsárral és mozsárral folyékony nitrogénben homogenizálták.
Legyek
Az entomológiai ketrecekből aspirátorral 30-40 legyet gyűjtöttünk, majd kloroformmal leöltünk. A legyeket a has morfológiája alapján nemezték meg; a gravid nőstényekre jellemző duzzadt hasú legyeket (FLYF1-5) nőstényeknek, a ráncos hasú legyeket (FLYM1-5) pedig hímeknek. A nem meggyőző külső személyeket elvetették. A legyeket a lárvamintákkal megegyező módon felülsterilizáltuk, majd mozsárral és mozsárral folyékony nitrogénben homogenizáltuk. A mintánként felhasznált biológiai anyag megfelelő eredetének és mennyiségének, valamint az extrakció utáni DNS-koncentrációk részletes leírását a metaadat-táblázatban találjuk (1. kiegészítő táblázat).
A 16S rRNS Gene V3 – V4 régió szekvenálása és elemzése
Eredmények
Előfeldolgozás
A 16S rRNS gén V3 – V4 régiójának páros végű szekvenálása 40 mintából összesen 1.249.018 leolvasást eredményezett. A MiSeq szekvenáláshoz a minőségi pontszám profilok voltak jellemzőek, magas minőségi pontszámok több mint 250 ciklusra előrefelé és ∼200 ciklusra fordított irányban (1. kiegészítő ábra). A retefrakciós görbék azt mutatták, hogy a baktériumok sokfélesége lefedettség elegendő, ezért úgy döntöttünk, hogy nem veszünk mintánként azonos mélységű mintát. A közelmúltban kifejlesztett módszerek lehetővé tették számunkra az amplikonszekvencia variánsok (ASV) megoldását ahelyett, hogy a molekuláris működési taxonómiai egységek (OTU) klasszikusabb felépítéséhez folyamodnánk. A módszer előnyei közé tartozik a nagyobb felbontás és a reprodukálhatóság, és lehetővé teszi a függetlenül feldolgozott adatkészletek egyszerű egyesítését (Callahan et al., 2017). Eltérő rendelkezés hiányában a kézirat adatai és elemzései kizárják azokat az olvasmányokat, amelyeket taxonómiailag a mitokondriumokhoz, a kloroplaszthoz rendeltek, vagy amelyeknél a taxonómiai feladatokat nem sikerült megoldani menekültügyi szinten.
Bakteriális közösség összetétele
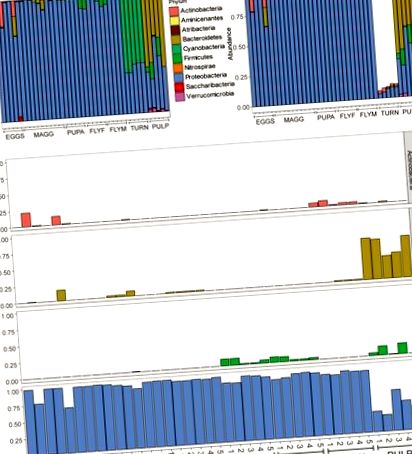
Összesen 1006 amplikon szekvencia variánst (ASV) azonosítottak a teljes adatkészletben. Az 5s – 5-nél kisebb relatív bőségű ASV-k szűrése tíz phyla-szerte összesen 357 bőséges ASV-t eredményezett (1A ábra). Az összes D. radicum mintában, életszakasztól függetlenül, nagyrészt a proteobaktériumok domináltak. Az ép fehérrépa mintáiból összegyűjtött szekvenciaadatok nagy része (~ 90%) kloroplasztból származó ASV-kből állt, és így nem voltak alkalmasak mikrobiomjának meghatározására (1B. Ábra). Mérsékelt mennyiségű Firmicutes jelent meg a felnőtt D. radicum legyekben, de a korábbi életszakaszokban nem (1C. Ábra). A fennmaradó fehérrépa ASV-kat többnyire a fehérjebaktériumok és az aktinobaktériumok közé sorolták. A rothadó fehérrépaszövet mintái nagy számban tartalmaznak Bacteroidetes, valamint Proteobacteriumokat (1C. Ábra), és egyedülállóan hordozott Verrucomicrobia ASV-kat tartalmaznak (nem látható). A kloroplasztból származó szennyeződés nem volt látható ezekben a mintákban. Az összes minta 20 legelterjedtebb nemzetségének áttekintését a 2A. Ábra mutatja, a 2B. Ábrán pedig a különböző baktériumcsaládok relatív bőségét ábrázoló hőtérkép látható a mintacsoportok között. .
(A) Az összes olvasás relatív bőségként jelenik meg az alacsony bőségű olvasmányok szűrése után (átlag (x)> 5e – 5). (B) Sávdiagram az olvasások eltávolítása után, ahol az osztályt „Kloroplaszt” vagy „Azonosítatlan”, vagy ahol a Családot „Mitokondriának” jelölték. Ne feledje, hogy az olvasások több mint 80% -át eltávolították a „fehérrépa” mintacsoport mintáiból, ami a szöveti kloroplasztikák nagy számával magyarázható. (C) Az Actinobacteriumok, a Bacteroidetes, a Firmicutes és a Proteobacteriumok relatív leolvasása minden mintában, amelyet menedékjog jellemez. Tojás, Delia radicum petesejtek; MAGG, Delia radicum lárvák; PUPA, D. radicum bábok; FLYF, D. radicum gravid nőstény nőstényei; FLYM, D. radicum hím felnőttek; TURN, friss, nem fertőzött Brassica rapa subsp. rapa; PULP, a B. rapa subsp. D. radicummal fertőzött egyed macerált szövete. rapa.
(A) A Delia radicum laboratóriumi kultúrájához kapcsolódó 20 leggyakoribb nemzetség áttekintése, amely több életszakaszból, valamint friss és bomlott fehérrépából származó mintákat tartalmaz. Az adatokat először a nemzetség szintjén agglomerálták, majd mintánként egyesítették. (B) Hőtérkép, amely megmutatja az olvasások relatív bőségét mintacsoportonként, ahol a bőségeket összevonták családi szinten. Tojás, D. radicum tojás; MAGG, D. radicum lárvák; PUPA, D. radicum bábok; FLYF, D. radicum Gravid nőstény nőstényei; FLYM, D. radicum hím felnőttek; TURN, friss, nem fertőzött Brassica rapa subsp. rapa; PULP, a B. rapa subsp. D. radicummal fertőzött egyed macerált szövete. rapa.
Gammaproteobaktériumok
(A) Az olvasmányok relatív bősége a Gammaproteobacteriumok osztályában, mintacsoportonként agglomerálva. (B) Gammaproteobakteriális törzsek, amelyek fajszintig azonosíthatók a V3 – V4 régió szekvenálása alapján. MAGG, Delia radicum lárvák; PUPA, D. radicum bábok; FLYF, D. radicum Gravid nőstény nőstényei; FLYM, D. radicum hím felnőttek; TURN, friss, nem fertőzött Brassica rapa subsp. rapa; PULP, a B. rapa subsp. D. radicummal fertőzött egyed macerált szövete. rapa.
Wolbachia
A Wolbachia nemzetség endoszimbiotikus baktériumokat tartalmaz, és köztudottan sokféle ízeltlábúat és fonálféreget fertőz meg (Serbus et al., 2008). Adatkészletünkben a Wolbachia nemzetséghez rendelt rendeltetésszerű ASV-k az összes olvasmány 52% -át tették ki, amely tíz nem rovar mintát tartalmaz, amelyek közül kilencben hiányoztak a Wolbachia olvasmányok. Mivel minden D. radicum mintához több egyed DNS-ét vontuk ki, a tenyészet fertőzöttségi rátáját ezekkel az adatokkal nem lehet meghatározni, és lehetséges, hogy az egyedek nem 100% -a hordozza a Wolbachiát. A bomló fehérrépa („PULP4”) öt mintájából egyből 34 Wolbachia-leolvasás történt, ami nagy valószínűséggel a lárvaszövet véletlenszerű bekerülésének köszönhető a mintavétel során. Összesen kilenc különböző ASV-t jelöltek meg Wolbachia néven, az egyiket 478723 olvasmány képviselte, míg a másik nyolc csak 2 és 25 olvasatot tartalmazott. Nagy valószínűséggel az utóbbi változatok kimutatása a DADA2 ASV-hívó algoritmusában szereplő szekvenciahibák és/vagy műtermékek eredménye volt. A D. radicum életszakaszaiban a Wolbachia relatív bőségének mintaváltozása a 4. ábrán látható .
A Wolbachia nemzetséghez rendelt olvasmányok relatív bősége a Delia radicum mintákban. MAGG, D. radicum lárvák; PUPA, D. radicum bábok; FLYF, D. radicum Gravid nőstény nőstényei; FLYM, D. radicum hím felnőttek; TURN, friss, nem fertőzött Brassica rapa subsp. rapa; PULP, a B. rapa subsp. D. radicummal fertőzött egyed macerált szövete. rapa.
Minta sokféleség
(A) A Delia radicum-hoz kapcsolódó mikrobiota és táplálék-szubsztrátjaik alfa sokféleségének (Chao1 és Shannon-Weaver indexei) pontdiagramjai a takarmányozás előtt (fehérrépa-bőr) és a D. radicum-lárvák (fehérrépa-cellulóz) táplálása után. (B) 30 D. radicum és 10 Brassica rapa minta elvi koordinátanalízise súlyozatlan és súlyozott UniFrac távolságok alapján. MAGG, D. radicum lárvák; PUPA, D. radicum bábok; FLYF, D. radicum Gravid nőstény nőstényei; FLYM, D. radicum hím felnőttek; TURN, friss, nem fertőzött B. rapa subsp. rapa; PULP, a B. rapa subsp. D. radicummal fertőzött egyed macerált szövete. rapa.
ASZTAL 1
Páronként többszintű összehasonlítás az adonis alkalmazásával, 999 permutációval.
| Pr (> F) | D. radicum | D. radicum | D. radicum | D. radicum | D. radicum | Macerált |
| Tojás | Lárvák | Bábok | Felnőtt nőstények | Felnőtt férfiak | fehér retek | |
| D. radicum Lárvák | 0,002 ** | |||||
| D. radicum Pupae | 0,009 ** | 0,001 *** | ||||
| D. radicum Felnőtt nőstények | 0,010 ** | 0,007 ** | 0,010 ** | |||
| D. radicum Felnőtt hímek | 0,016 * | 0,001 *** | 0,012 * | 0,206 | ||
| Macerált fehérrépa | 0,009 ** | 0,001 *** | 0,012 * | 0,007 ** | 0,011 * | |
| Friss fehérrépa | 0,008 ** | 0,003 ** | 0,010 ** | 0,010 ** | 0,011 * | 0,009 ** |
Vita
Ebben a tanulmányban a mikrobaközösség sokféleségét tártuk fel, amely a káposztagyökér légy D. radicum petesejtjeihez, lárváihoz, bábjaihoz és felnőttkori életszakaszaihoz kapcsolódik. Minden fejlődési életszakasz jelentős mennyiségű Wolbachia-olvasatot tartalmazott, de más baktériumok sokféle mikrobiális közösségét is tartalmazta. Mivel az étrend és a környezet is befolyásolja a mikrobiomot, belefoglaltuk a gazda növény (fehérrépa) és a D. radicum lárvákkal fertőzött, lebomlott gazdanövény anyag mikrobiális sokféleségét. A bomlott növényi anyagot nagyon magas alfa sokféleség jellemezte.
A friss és macerált fehérrépaminták szerkezetükben és összetételükben jelentősen különböztek a D. radicum mikrobiális közösségeitől, de számos taxont is megosztottak, amelyek esetleg átkerülnek a környezet és a gazdaszervezet között, vagy fordítva.
A D. radicum minden életszakaszát nagyszámú proteinobakteriális szimbiont jellemezte, de mindegyiknek egyedi jellemzői voltak, amelyeket a különféle sokféleségi mutatók összehasonlításával lehet megoldani.
A rovarokkal társult bélbaktériumok 16S rRNS génjét szekvenáló más vizsgálatokkal összehasonlítva érdekes párhuzamok és eltérések mutatkoznak.
A jövőbeni tanulmányok szempontjából érdekes lehet a különböző laboratóriumi nevelésű rovarfajok szekvenálási eredményeinek kombinálása annak megállapítására, hogy a mikrobiális sokféleség szórása nagyobb-e egy rovar különböző életszakaszai között, vagy két, ugyanazon életszakaszban lévő két rovarfaj között. A házi legyekkel kapcsolatos vizsgálatok kimutatták, hogy a földrajzi eredet és a laboratóriumi nevelés jelentős hatással lehet a mikrobiomra (Park és mtsai, 2019).
Kimutatták, hogy a Wolbachia jelenléte szerepet játszik a Drosophila mikrobiom-összetételének meghatározásában (Simhadri et al., 2017).
Az, hogy az ebben a tanulmányban közölt taxonok átmeneti vagy rezidensek, vagy akár elhaltak vagy élnek, nem oldható meg a jelen munkában bemutatott módszerekkel. A jövőbeni vizsgálatok tisztázhatják a D. radicum és a rezidens mikrobák közötti táplálkozási kölcsönösségek lehetőségét.
Ez a munka mélyebb megértést tett lehetővé a D. radicumhoz társult baktériumos szereplőkről a különböző életszakaszokban, valamint a növényi rothadás bakteriális természetéről, amely a D. radicum fertőzéssel jár. Mint ilyen, potenciálisan új nyomokat adhat a szimbiotikus baktériumokról, amelyek kihasználhatók a biokontroll programokban. Az átviteli minták és ezen baktérium-lejátszó fajok sajátos funkcióinak tisztázása érdekes platform a további kutatásokhoz.
Adatelérhetőségi nyilatkozat
A cikk következtetéseit alátámasztó nyers adatok az NCBI-n érhetők el a BioProject PRJNA573643 címen. További adatokat, például az ábrák előállításának kódját, indokolatlan fenntartás nélkül minden képesített kutató rendelkezésére bocsátják.
Szerző közreműködései
A TB és a CW tervezte a kutatást. A TB elvégezte a kutatást, elemezte az adatokat, és megírta a kéziratot CW hozzájárulásával.
- A káposzta finom oldala - Tapasztalja meg az életet
- Az élet első hónapjai kritikus időszak az elhízás kialakulásához
- Ezek a személyiségjegyek meghosszabbítják az életed legjobb életét
- A lapos hasi étel, amelyet nem tud a Kefir HuffPost Life-ról
- Miért kezdem a napomat meleg Cayenne Lemon vízzel elfoglalt feleség elfoglalt élettel