A katekolamin visszavétel gátlása súlyvesztést okoz a mozgásszervi aktivitás és a termogenezis növelésével
Absztrakt
BEVEZETÉS
A bupropion (BUP) jelenleg jóváhagyott a depresszió kezelésére (Wellbutrin ®) és a dohányzásról való leszokás segédeszközeként (Zyban ®) (Ascher és mtsai, 1995; Foley és mtsai, 2006). Eredetileg a „súlygyarapodás hiányával” társult, a BUP nemrégiben kimutatta, hogy elhízott emberi alanyokkal végzett klinikai vizsgálatok során enyhe (5%) súlycsökkenést okoz (Gadde és Xiong, 2007). Bár a BUP további klinikai vizsgálatokon megy keresztül az elhízás farmakoterápiájaként, nincsenek kontrollált átfogó állatkísérletek, amelyek felmérnék, hogy a krónikus BUP hogyan befolyásolja az energiaegyensúlyt.
Mint sok antidepresszáns és az egyetlen központilag ható, az FDA által jóváhagyott, hosszú távú elhízáskezelő kezelés, a sibutramine (Meridia ®), a BUP is gátolja a biogén amin plazma membrán újrafelvételét (Ascher és mtsai, 1995; Stahl és mtsai, 2004; Kaplan, 2005). Azáltal, hogy szelektíven gátolja a dopamin (DA) és a noradrenalin (NE) újrafelvételét, a BUP az extracelluláris katekolaminok eltávolításának elsődleges eszközeivel ütközik (Hoffman és mtsai, 1998). A DA és NE transzporterek blokkolása révén a BUP az intersticiális katekolamin koncentrációk akut növekedését és a preszinaptikus idegsejtek fokozott visszacsatolási gátlását okozza (Ascher és mtsai, 1995; Dong és Blier, 2001).
A BUP csökkenti a táplálékfelvételt, ha akutan rágcsálóknak adják be (Zarrindast és Hosseini-Nia, 1988; Billes és Cowley, 2007). Mivel a szelektív DA + NE újrafelvétel-gátlók akut együttes alkalmazása additív gátló hatást fejt ki az egerek táplálékfelvételére, valószínűleg mindkét katekolamin hozzájárul a BUP akut hipofágikus hatásához. Úgy tűnik, hogy mind a DA, mind az NE hozzájárul az emberekben dokumentált BUP súlycsökkentő hatásához, mivel a DA + NE újrafelvétel-gátlók szubkrónikus (7 napos) együttes adagolása szintén egerek súlyvesztését okozza (Billes és Cowley, 2007). Érdekes módon a szubkrónikus DA + NE újrafelvétel gátlása által okozott súlycsökkenés az egerek táplálékfogyasztásának csökkenése nélkül következett be, ami hasonló ahhoz a megfigyeléshez is, hogy a krónikus BUP beadás nem befolyásolja az emberek kalóriabevitelét (Griffith et al., 1983; Harto-Truax és munkatársai, 1983). Ez arra utal, hogy a katekolamin újrafelvétel gátlása súlyvesztést okozhat az energiafelhasználás növelésével.
A rágcsálók jelenlegi adatai azt mutatják, hogy az akut BUP növelheti az energiafelhasználást a hőmérséklet növelésével (Liu et al, 2002, 2004). Mivel a BUP hőmérsékletre gyakorolt akut hatásairól szóló jelentések következetlenek, további kutatásokra van szükség annak megállapításához, hogy a fokozott termogenezis hozzájárulhat-e a BUP megnövekedett energiafelhasználásához is (Zarrindast és Abolfathi-Araghi, 1992; Liu és mtsai, 2002; Hasegawa és mtsai, 2005). Mi és mások kimutattuk, hogy az akut perifériás BUP dózistól függően serkenti a rágcsálók mozgásszervi aktivitását, ez a hatás összhangban áll a DA transzporter gátlásával (Soroko és mtsai, 1977; Cooper és mtsai, 1980; Nielsen és mtsai, 1986; Zarrindast és Hosseini-Nia, 1988; Vassout és mtsai, 1993; Redolat és mtsai, 2005; Mitchell és mtsai, 2006).
Az elhízást általában krónikus betegségnek tekintik, amely folyamatos beavatkozást igényel az alacsony testsúly fenntartása érdekében (Appolinario és mtsai, 2004; Ioannides-Demos és mtsai, 2005). Az olyan gyógyszerekkel végzett krónikus (5–21 napos) kezelés, mint a BUP, befolyásolhatja a receptor expresszióját, az intracelluláris jelátviteli mechanizmusokat, valamint a transzporterek expresszióját és aktivitását (Frazer és Benmansour, 2002). Így a krónikus BUP-kezelés viselkedési toleranciát és/vagy szenzibilizációt eredményezhet, így a BUP energiamérlegre gyakorolt akut hatása eltérhet a BUP krónikus hatásaitól. Annak megállapításához, hogy a krónikus DA + NE újrafelvétel gátlás hogyan befolyásolja az energiafogyasztást és a ráfordítást, szükség van annak meghatározásához, hogy a gyógyszer hosszú távú beadása hogyan befolyásolja az energiaegyensúlyt.
Feltűnően hiányoznak az adatok a krónikus BUP-kezelés energiaegyensúlyra gyakorolt átfogó hatásairól állatmodellekben. Az sem világos, hogy a DA és az NE hogyan járulnak hozzá a BUP lehetséges metabolikus hatásaihoz, mivel egyetlen tanulmány sem vizsgálta, hogy a szelektív DA vagy NE újrafelvétel-gátlók krónikus beadása hogyan befolyásolja az energiafelhasználást. Tanulmányok, amelyek összehasonlítják a BUP és a szelektív DA vagy NE újrafelvétel gátlók hatásait az energiaegyensúly többféle mérésére (például táplálékbevitel, mozgásszervi aktivitás, termogenezis és testtömeg), szükségesek a BUP-ra gyakorolt hatások teljes elemzéséhez. energiamérleg. Jelen tanulmány célja a DA + NE újrafelvétel gátlásának akut és krónikus hatásainak vizsgálata volt az egerek energiamérlegén, különös tekintettel a fogyás mechanizmusának megvilágítására olyan gyógyszerekkel, mint a BUP. Ennek érdekében először megvizsgáltuk a BUP vagy szelektív DA és NE újrafelvétel gátlók akut beadásának hatásait a mozgásszervi aktivitásra és az interscapularis hőmérsékletre. Ezután megvizsgáltuk a szubkrónikus (7 napos) BUP vagy szelektív DA és NE újrafelvétel-gátlók hatását a mozgásszervi aktivitásra, az interscapularis hőmérsékletre, a napi táplálékfelvételre és a napi testtömegre.
ANYAGOK ÉS METÓDUSOK
Állatok gondozása és elhelyezése
Az összes állatkísérletet az Oregoni Nemzeti Prímkutató Központ intézményi állatgondozási és felhasználási bizottsága hagyta jóvá. A felnőtt hím C57Bl/6J egereket (Jackson Labs, Bar Harbor, ME) külön-külön 12 órás világos/sötét ciklusban és állandó hőmérsékleten (22 ± 1 ° C) tartottuk. Étel és víz rendelkezésre állt ad libitum, hacsak másképp nincs meghatározva. Az egereket standard chow-on tartottuk (Purina Lab Chow, 5001 sz.). Az összes műtéti eljárást izoflurán altatásban, aszeptikus sebészeti beavatkozással végeztük.
Kábítószerek
A gyógyszereket a felhasználás napján frissen készítették. Az intraperitoneális (i.p.) beadáshoz a BUP-t (Sigma, St Louis, MO) és a niszoxetint (NIS; Tocris, Ellisville, MO) steril, nem pirogén 0,9% NaCl-ban oldjuk. A GBR12783 (GBR; Tocris) és a GBR + NIS-t 10% dimetil-szulfoxidban és sóoldatban oldjuk. Minden hevesen beadott gyógyszert i.p. 0,1 ± 0,02 ml térfogatban (testtömegnek megfelelően). A kontroll egerek megfelelő mennyiségben vivőanyagot kaptak. Szubkrónikus beadáshoz (Alzet® minipumpákon keresztül) a NIS-t 10% dimetil-szulfoxidban és steril, nem pirogén sóoldatban oldjuk. A BUP-ot és a GBR-t 50% dimetil-szulfoxidban és 50% steril H20-ban oldottuk. Korábban közzétett adatokat használtak fel azoknak a gyógyszerdózisoknak a meghatározására, amelyek mérsékelten befolyásolják az energiaegyensúlyt (Billes és Cowley, 2007).
Telemetrikus transzponder beültetés és mozgásszervi aktivitás és hőmérséklet mérés
A távoli biotelemetriát előkalibrált érzékeny távadók (PDT-4000 G2 E-Mitter ® érzékelők, Mini Mitter Company, Sun River, OR) segítségével végeztük. Izoflurán altatásban E-Mittert ültettek a lapockák közé az interscapularis barna zsírszövet (IBAT) párna alá, és a sebeket varratokkal zártuk le. Az egereknek 1 hét gyógyulást engedélyeztek a vizsgálatok megkezdése előtt. Az E-Mitter távadók által kibocsátott jeleket az állat háziketrece alatt elhelyezett vevő érzékelte, és a VitalView ® szoftver (Mini Mitter) által aktivitásszámokká (tetszőleges egységekké) alakította át (Harkin és mtsai, 2002). A mozgásszervi aktivitásszám a bruttó motoros aktivitás relatív mértéke. Valamennyi kísérlet esetében az aktivitásszámlálást és az interscapularis hőmérsékleti méréseket 6 percenként végeztük.
Akut gyógyszeradminisztrációs tanulmányok
Az egereket a mindennapi i.p. 0,1 ml steril sóoldat injekciója és 16 órán át (egy éjszakán át) éhezés minden harmadik napon, legalább 2 hétig. Ezután az egereket interscapularis PDT-4000 E-Mitter szenzorokkal ültettük be, hagytuk helyreállni, és 2 hétig szoktattuk, mielőtt megkezdtük volna az etetési vizsgálatokat. Az összes egeret a testtömegre kiegyensúlyozott kezelési csoportokba soroltuk. A teszt reggelén 16 órás éhgyomri egerek kaptak i.p. frissen elkészített gyógyszer vagy vivőanyag injekcióját visszahelyezték a ketrecükbe, és hat előre lemért ételpelletet kaptak. A gyógyszer hatékonyságának pozitív kontrolljaként az ételt az injekció beadása után 1, 2 és 4 órával lemértük.
Szubkrónikus gyógyszeradagolási tanulmányok
Statisztikai analízis
EREDMÉNYEK
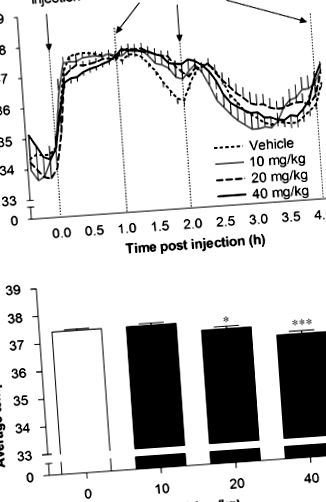
Az akut BUP enyhe átmeneti hipotermiát okozott, amelyet enyhe hipertermia követett
Korábban kimutattuk, hogy az akut BUP dózisfüggő és átmeneti növekedést okoz az egerekben a mozgásszervi aktivitásban, amely egyidejűleg átmeneti gátló hatással van az élelmiszer-bevitelre akár 1 órával az injekció beadása után (Billes és Cowley, 2007). A 10, 20 és 40 mg/kg BUP-ot követő átlagos interscapularis hőmérséklet időbeli lefutását az 1a. Ábra mutatja (n= 8, állatok/kezelési csoport; n= 22, hordozóval kezelt állatok). A BUP szignifikáns hatással volt az átlagos interscapularis hőmérsékletre az injekció beadását követő 60 perc alatt (F (3, 446) = 16,40, P 3. ábra
A 3e. Ábra a szubkrónikus vivőanyaggal vagy BUP-tal kezelt állatok átlagos óránkénti hőmérsékletének reprezentatív nyomát mutatja az infúzió 3. napján. A vivőanyaghoz képest a szubkrónikus BUP beadása mindkét kontrollfázisban szignifikánsan 0,63 ± 0,03 ° C-kal növelte a keresztszinten belüli átlagos hőmérsékletet a kontrollhoz képest (t(64) = 6,12, P 4. ábra
A szelektív DA és NE újrafelvétel-gátlók szubkrónikus együttadása fokozott aktivitást és hőmérsékletet, valamint súlycsökkenést okozott
Az 5a. Ábra a szubkrónikus szelektív DA és NE újrafelvétel-gátlók hatásának reprezentatív nyomát mutatja a mozgásszervi aktivitásra az infúzió 3. napján. Az infúzió 2–7. Napján a kezelés jelentős hatással volt az átlagos mozgásszervi aktivitásra a fény alatt (F (3, 119) = 12,71, P 5. ábra
Az 5e. Ábra az infúzió 3. napjának átlagos interscapularis hőmérsékletének reprezentatív nyoma. Jelentős hatással volt a kezelés az interscapularis hőmérsékletre a fény alatt (F (3, 119) = 11,26, P 6. ábra
VITA
Jelen tanulmány bebizonyítja, hogy a szubkrónikus (7 napos) kombinált DA + NE újrafelvétel gátlás súlyvesztést okoz a mozgásszervi aktivitás és az interscapularis hőmérséklet növelésével, és nem az ételbevitel gátlásával. A katekolamin újrafelvétel gátlása kombinálva BUP-val vagy GBR + NIS-szel mind az aktivitást, mind a hőmérsékletet növelte, de a BUP nem okozott jelentős súlyvesztést a táplálékbevitel kompenzatív növekedése miatt. Mivel a kombinált szelektív DA + NE újrafelvétel-gátlók hatása az aktivitásra és a hőmérsékletre különbözik ezeknek a gyógyszereknek az egyedi hatásaitól, a megnövekedett energiafelhasználás valószínűleg a DA és az NE rendszerek kölcsönhatásának eredménye. Ez a tanulmány új bizonyítékokat is szolgáltat arra vonatkozóan, hogy az elhízott embereknél a BUP-kezelés során megfigyelt súlycsökkenés valószínűleg a kombinált dopaminerg és noradrenerg mechanizmus okozta megnövekedett aktivitás és termogenezis megnövekedett energiafelhasználásának az eredménye.
A távoli biotelemetria lehetővé teszi a mozgásszervi aktivitás és a hőmérséklet egyidejű és folyamatos mérését az állatok háziketrecében, minimalizálva a zavaró változókat és lehetővé téve az időbeli adatgyűjtést (Harkin et al, 2002). Biotelemetria segítségével egerekben a mechanikai munka és az adaptív termogenezis mérésére mind az akut, mind a krónikus gyógyszeres kezelés során képesek voltunk rögzíteni az energiafogyasztás két típusát, amelyek az energiaállapottól függően változnak (Spiegelman és Flier, 2001).
Mivel a kisemlősök adaptív termogenezisének fő szerve, az IBAT alá beültették az E-mitreket, a hőmérséklet-ingadozások valószínűleg az IBAT aktivitását tükrözik (Lowell és Spiegelman, 2000; Avram és mtsai, 2005). Már felvetették azt az elképzelést, hogy a BAT életképes célpont lehet az elhízás gyógyszeres terápiájában. A BAT-aktivitás növelése megnöveli az anyagcserét és megakadályozza a rágcsálók étrend okozta elhízását, míg a BAT genetikai mutációja és farmakológiai gátlása elhízást okozhat (Spiegelman és Flier, 2001; Crowley és mtsai, 2002). Mivel az adaptív termogenezisről úgy gondolják, hogy hozzájárul az elhízás és a kalóriadeficit (fogyókúra) jellemző energiaköltségeinek csökkenéséhez, az adaptív termogenezist (a BAT aktiválásával) fokozó gyógyszereket javasolták a biztonságos és tartós energiafelhasználás elérésének lehetséges eszközeként (Major et al., 2007).
A szimpatikus idegterminálokból felszabaduló NE aktiválódik β3-adrenoreceptorok a barna adipocitákon BAT-ban, és lipolízishez, a protein-1 szétkapcsolódásának (UCP-1) fokozott aktivitásához és termogenezishez vezet (Avram és mtsai, 2005; Fan és mtsai, 2005). Az NE újrafelvételének blokkolásával a szimpatikus idegterminálokban az NE újrafelvétel gátlója növekedhet β3-adrenoreceptor aktiváció, ezáltal fokozza az oxidatív foszforilációt és a hőtermelést (Iversen, 1971). Patkányokban a βA 3-adrenoreceptor csillapítja a BUP (Liu és mtsai, 2004) és a sibutramin (Connoley és mtsai, 1999) által okozott megnövekedett O2-fogyasztást, ami azt sugallja, hogy a BAT-aktiváció teszi ki a megnövekedett energiafogyasztás jelentős részét. Az a jelenlegi megállapítás, miszerint a szelektív NE visszavétel gátlása csökkentette a interscapularis hőmérsékletet, hangsúlyozza, hogy további dopaminerg (BUP kezeléssel) vagy szerotonerg (sibutramin kezeléssel) bevitel fontos a fokozott szimpatikus tónus fenntartása és a termogenezis kiváltása érdekében.
Mivel a BAT-aktiválás révén bekövetkező termogenezis egy metabolikus szabályozási folyamat, amelyet a hipotalamusz irányít csökkenő szimpatikus szálakon keresztül (Lowell és Spiegelman, 2000), a katekolamin-újrafelvétel gátlói mind központilag, mind periférián képesek befolyásolni az interscapularis hőmérsékletet (Wellman, 2005). Kimutatták, hogy a BUP növeli a DA és NE értékeket a test hőmérsékletét szabályozó hipotalamusz magokban, például a preoptikus területen és az elülső hipotalamuszban (Hasegawa et al., 2005). A katekolamin-visszavétel gátlói szintén befolyásolhatják a hipotalamusz melanokortin-rendszer sejtjeinek aktivitását, amely az energia elérhetőségére reagálva szabályozza a kalóriabevitelt és az anyagcsere sebességét (Fan és mtsai, 2005; Ramos és mtsai, 2005). Például a dopamin D2 receptor aktiválása növeli az anorexiás pro-opiomelanokortin mRNS expresszióját és csökkenti az orexigén neuropeptid Y mRNS expresszióját a hipotalamusz íves magjában (Pelletier és Simard, 1991; Tong és Pelletier, 1992). Az extracelluláris DA növelésével a DA újrafelvétel gátlói közvetve növelhetik a D2 receptor aktiválódását és befolyásolhatják a melanokortin rendszer idegsejtjeinek aktivitását.
Az olyan gyógyszerek hatékonyságának része, mint a BUP, hogy több rendszert érintenek, néha kedvező gyógyszerkölcsönhatásokat eredményeznek, amelyeket nem lehet megjósolni a szelektív DA és NE újrafelvétel gátlók egyedi hatásai alapján (Kaplan, 2005). A nem tervezett gyógyszerkölcsönhatásokra példa a szubkrónikus DA + NE újrafelvétel együttes alkalmazásának hatása az IBAT hőmérsékletére. A könnyű fázis során a szubkrónikus DA + NE újrafelvétel gátlása átlagosan 0,4 ° C-os emelkedést okozott az IBAT hőmérsékletében, annak ellenére, hogy a hőmérsékletet a DA újrafelvétel gátlása lényegében nem befolyásolta, és az NE újrafelvételének gátlása csökkentette. Noha a felnőtt emberek nem rendelkeznek meghatározott perifériás BAT-lerakódásokkal, a legfrissebb bizonyítékok azt mutatják, hogy a barna zsírsejtek diszpergálódhatnak a fehér zsírszövet-lerakódásokban. További tanulmányok, amelyek összekapcsolják az emberi elhízást a βA 3-adrenoreceptor és az UCP-1 genetikai polimorfizmusok azt sugallják, hogy a BAT szerepet játszik az emberek energiafelhasználásában (Avram et al, 2005).
Hivatkozások
Ansah TA, Wade LH, Shockley DC (1996). A mozgásszervi aktivitás, a maghőmérséklet és a szívfrekvencia változásai a kokain ismételt beadására adott válaszként. Physiol Behav 60: 1261–1267.
Appolinario JC, Bueno JR, Coutinho W (2004). Pszichotróp gyógyszerek az elhízás kezelésében: milyen ígéret? CNS gyógyszerek 18.: 629–651.
- A nem szándékos fogyás gyakori okai - Családorvosi központok
- A macska fogyásának nyolc gyakori oka
- A fogyókúra fenntartásában sikeres felnőttek étrendi és fizikai aktivitása
- A testmozgás kritikusabb, mint az étrend a fogyás fenntartása érdekében. A fizikai aktivitás segít megelőzni
- David Kirkpatrick A fizikai aktivitás kis mennyisége fogyáshoz vezet