A G0/G1 Switch Gene 2 (G0S2) lipolitikus inhibitor kifejezett expressziója barna medvék zsírszövetében (Ursus arctos) a hibernálás előtt
Biokémiai Kórtani Kutatólaboratórium, Klinikai Orvostudományi Intézet, Aarhus Egyetem, Aarhus, Dánia
Levelezés
Docens, Niels Jessen, Klinikai Orvostudományi Intézet, Biokémiai Kórtani Kutatólaboratórium, Aarhusi Egyetemi Kórház, Nørrebrogade 44, DK-8000 Aarhus C, Dánia.
Tel .: +45 7846 2141
Fax: +45 7846 2150
A Novo Nordisk Alapmetabolikus Kutatási Központ, Egészségügyi és Orvostudományi Kar, Koppenhágai Egyetem, Koppenhága, Dánia
Nukleáris Orvostudományi és PET Központ, Aarhusi Egyetemi Kórház, Aarhus, Dánia
Biokémiai Kórtani Kutatólaboratórium, Klinikai Orvostudományi Intézet, Aarhus Egyetem, Aarhus, Dánia
Ökológia és természeti erőforrás-gazdálkodás tanszék, Norvég Élettudományi Egyetem, Aas, Norvégia
Erdészeti és Vadgazdálkodási Tanszék, Alkalmazott Ökológiai és Agrártudományi Kar, Hedmark Egyetemi Főiskola, Campus Evenstad, Koppang, Norvégia
Egészségügyi Kar, Örebro Egyetem Kardiológiai Tanszék, Örebro, Svédország
Biokémiai Kórtani Kutatólaboratórium, Klinikai Orvostudományi Intézet, Aarhus Egyetem, Aarhus, Dánia
Levelezés
Docens, Niels Jessen, Klinikai Orvostudományi Intézet, Biokémiai Kórtani Kutatólaboratórium, Aarhusi Egyetemi Kórház, Nørrebrogade 44, DK-8000 Aarhus C, Dánia.
Tel .: +45 7846 2141
Fax: +45 7846 2150
A Novo Nordisk Alapmetabolikus Kutatási Központ, Egészségügyi és Orvostudományi Kar, Koppenhágai Egyetem, Koppenhága, Dánia
Nukleáris Orvostudományi és PET Központ, Aarhusi Egyetemi Kórház, Aarhus, Dánia
Biokémiai Kórtani Kutatólaboratórium, Klinikai Orvostudományi Intézet, Aarhus Egyetem, Aarhus, Dánia
Ökológia és természeti erőforrás-gazdálkodás tanszék, Norvég Élettudományi Egyetem, Aas, Norvégia
Erdészeti és Vadgazdálkodási Tanszék, Alkalmazott Ökológiai és Agrártudományi Kar, Hedmark Egyetemi Főiskola, Campus Evenstad, Koppang, Norvégia
Egészségügyi Kar, Örebro Egyetem Kardiológiai Tanszék, Örebro, Svédország
Köszönjük Sven Brunbergnek a kiváló szervezést és a terepmunka során nyújtott segítséget. Ezt a tanulmányt a Lundbeck Alapítvány (az R126‐2012-12408. Számú támogatás az OF-nek) és az AP Møller Alapítvány az orvostudomány NJ-hez való előmozdításáért támogatta. A skandináv barnamedve kutatási projektet a Svéd Környezetvédelmi Ügynökség finanszírozza., a Norvég Környezetvédelmi Ügynökség, a Svéd Vadászati és Vadgazdálkodási Egyesület, a WWF Svédország és a Norvég Kutatási Tanács.
Absztrakt
Bevezetés
Ennek a tanulmánynak a célja a lipidcseppekhez kapcsolódó fehérjék expressziójának vizsgálata volt a szabadon mozgó barna medvék zsírszövetében télen hibernálás alatt, nyáron pedig aktív időszakuk alatt. A mögöttes hipotézis szerint a barna medvék elnyomják a lipolízist nyáron, amikor hízik az ATGL-aktivitás negatív szabályozóinak fokozott expressziójával.
Anyagok és metódusok
Állati befogás és biopszia eljárás
Vért és szubkután zsírszövetet gyűjtöttünk immobilizált szabadon mozgó barna medvékből (GPS-gallérral felszerelve) télen (február elején), ugyanezekből a medvékből a nyár eleji aktív időszakban (június végén/július elején). a svédországi Dalarnában. Valamennyi felvételt a Svéd Állatkutatási Etikai Bizottság (C212/9 és C47/9) és a Svéd Környezetvédelmi Ügynökség hagyta jóvá, és követi a közegészségügyi szolgálatoknak a vadon élő állatok humánus gondozására és felhasználására vonatkozó politikájának általános elveit. A mintavételt a skandináv barnamedve kutatási projekt (http://www.bearproject.info/) végezte el a bevett protokollok szerint (Arnemo et al. 2012).
Vérelemzés
A szérum FFA-kat kereskedelemben kapható készlettel analizálták (intraassay CV 2–4% és interassay CV 3–6%, kimutatási határ 0,02 mmol/L) (NEFA-HR 2; Wako Chemicals, Richmond, VA).
Szövettan
A zsírszöveti biopsziákat 4% -os formalinos pufferben (Cellpath, Newtown, Egyesült Királyság) rögzítettük és paraffinba ágyazottuk. 3 μA metszeteket 60 ° C-on 60 percig melegítettük, paraffinoztuk Tissue-Clear-ben (Sakura Finetek Europe, Alphan, Hollandia) és rehidratáltuk.
Western blot elemzés
100 mg) egy Precellys 24 homogenizátorban (Bertin Technologies, Montigny-le-Bretonneux, Franciaország) 20 mmol/l HEPES pH = 7,4, 10 mmol/l NaF, 1 mmol/l Na3VO4, 1 mmol/l L EDTA, 5% SDS, 50 μg/ml szójabab tripszin inhibitor, 4 μg/ml leupeptin, 0,1 mmol/l benzamidin, 2 μg/ml antipain és 1 μg/ml pepsztatin. A nyers homogenizátumokat Thermomixerben (Eppendorf, Hamburg, Németország) inkubáltuk 37 ° C-on és 1000 fordulat/perc sebességgel 1 órán át, majd centrifugáltuk 14 000x-nél. g 20 percig. A lipidmentes infranatantot leszívtuk és a Western blot elemzéshez használtuk.
A fehérjemintákat SDS-PAGE-val (4–12% Bis-Tris gél, Criterion XT rendszer; Bio-Rad, Hercules, Kalifornia) felbontottuk és polivinilidén-fluorid membránokra helyeztük a gyártó utasításainak megfelelően. A következő primer antitesteket használtuk: anti-ATGL, anti-CGI-58 (Abcam, Cambridge, UK), anti-PLIN1, anti-HSL (Cell Signaling, Beverly, MA), anti-CIDE-C (Novus Biologicals, Cambridge), Egyesült Királyság) és anti-G0S2, anti-szétkapcsoló protein 1 (Santa Cruz Biotechnology; Santa Cruz, Kalifornia). Torma peroxidázzal konjugált szamár anti-nyúl IgG-t (Amersham, GE-Healthcare, Pittsburgh, PA) és kecske anti-egér HRP-IgG-t (Abcam, Cambridge, Egyesült Királyság) alkalmaztunk másodlagos antitestként. A fehérjéket kemilumineszcenciával (Pierce Supersignal West Dura, Thermo Scientific, IL) vizualizáltuk, és a ChemiDoc ™ MP képalkotó rendszerrel (BioRad) számszerűsítettük. Precision Plus Az összes kék fehérje standardot használtuk molekulatömeg markerként (BioRad). A fehérjetöltet ellenőrzését Stain-Free technológiával (Gurtler et al. 2013) végeztük, és az adatokat a membránok összes fehérjetartalmához viszonyított arányban fejezzük ki.
Statisztika
A normális eloszlást QQ-ábrák és hisztogramok értékelésével teszteltük. Ha lehetséges, a nem paraméteres adatokat logaritmikus transzformációval normál eloszlássá alakítottuk át. A G0S2 expressziójának különbségeit Fisher pontos tesztjével értékeltük. Az adatok átlag ± SEM formájában kerülnek bemutatásra, hacsak másképp nem szerepel. A statisztikai elemzést a hibernáló és a nem gátló állapotok összehasonlításával végeztük ugyanazon medvében (párosítva t-Teszt) és P
Eredmények
Az állatok jellemzői
Az állatok alapvető jellemzőit az 1. táblázat foglalja össze. A medvék a két mintavételi periódus között híztak, de a növekedés csak határig szignifikáns volt (P 1. táblázat: A 2013. télen és nyáron fogott öt medve állatjellemzői
| Hímek/nőstények | 2/3 | 2/3 |
| Életkor (év) | 3 | 3 |
| Súly (kg) | 58 (38–64,5) | 53 (40–55) * A súlyt mediánban és tartományban (*) fejezzük kiP |
- A súlyt mediánban és tartományban (*) fejezzük kiP
A zsírszövet morfológiája
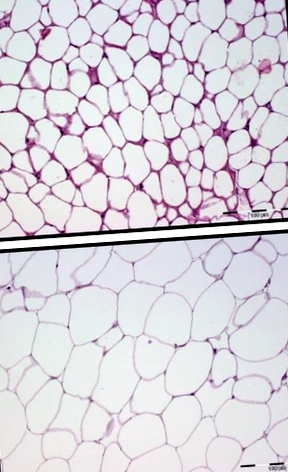
Amint az 1. ábrán látható, az adipocita sejtek mérete kisebb volt a nyári befogások során (A), mint a télen (B). A fehér zsírszövet klasszikus jellemzői a monopacuoláris sejtekkel, amelyek nagy lipidcseppet tartalmaznak, citoplazmatikus réteggel körülvéve, mindkét évszakban felismerhetők voltak. Ahogy az várható volt, egyetlen biopsziában sem figyeltünk meg barna zsírra jellemző plurivacuoláris sejteket, és a biopsziákban nem észleltük a szétkapcsolódó protein 1 expresszióját (az adatokat nem mutatjuk be).
Vérminták
A keringő FFA-szintek nagymértékben változtak a medvék között. Az átlagos szint nyáron 0,20 mmol/l (± 0,08) és 0,43 mmol/l (± 0,09) volt télen, de a különbségek nem érték el a statisztikai szignifikanciát.
A lipolízis gátlói fokozódnak a nem gátló állapotban
A CGI ‐ 58 prolipolitikus kofaktor expressziója télen volt
300% a nyári szinthez képest (P
A lipolízis negatív szabályozóinak, a G0S2 és a CIDE-C expresszióját a 3A. És B. ábra szemlélteti. A CIDE-C csökkent expresszióját találtuk (
50%) télen (P
Vita
A szabadon mozgó barna medvék hibernálásához szükséges csodálatos alkalmazkodás feltárásával olyan molekuláris mechanizmusra találtunk bizonyítékot, amely hozzájárulhat a fogságban élő barna medvéknél megfigyelhető súlygyarapodás során megnövekedett inzulinérzékenység paradoxonának magyarázatához. Javasoljuk, hogy a lipolízis gátlóinak mélyreható upregulációja a nyári időszakban gátolja az FFA felszabadulását a keringésbe olyan körülmények között, amelyeket pozitív energiamérleg jellemez (Swenson és mtsai 2007). A plazma FFA-szint emelésének gátló hatása a perifériás inzulin-stimulált glükózfelvételre és -oxidációra jól megalapozott (Belfort et al. 2005; Gormsen et al. 2007; Hoeg et al. 2011), valamint a lipid-cseppek dinamikus szabályozása A barnamedvék fehérjebevonása bizonyítékot ad az adipocita központi szerepére az egész test metabolizmusának szabályozásában.
Összefoglalva, a szabadon mozgó barnamedvék nyáron a zsírszövetben a lipolízis gátlóinak erőteljes szabályozását mutatják be. Ez a fogságban élő medvéknél korábban megfigyelt súlygyarapodás során megnövekedett inzulinérzékenység mögöttes mechanizmusaként szolgálhat. Ennek megfelelően a G0S2 célként szolgálhat az egész test glükóz homeosztázisának modulálására.
- Molekulák nélküli teljes szövegű AEDG peptid (Epitalon) serkenti a génexpressziót és a fehérjeszintézist
- Elhízás és Race Alter génexpresszió a bőrben medRxiv
- Az elhízás cukorbetegségében csökken az Omentin plazmaszintje és a génexpresszió
- Omega-3 zsírsavak és zsírszövet gyulladás és Browning éves táplálkozási áttekintés
- Helyi különbségek az emberi szubkután zsírszövet-anyagcserében az elhízásban SpringerLink