A Lipoxin A4 neuroprotektív hatásai a központi idegrendszer patológiáiban
1 Departmento de Farmacologia, Centro de Ciências Biológicas, Universidade Federal de Santa Catarina (UFSC), Campus Universitário, Trindade, 88049-900 Florianópolis, SC, Brazília
2 Centro de Inovação e Ensaios Pré-Clínicos (CIEnP), Av. Luiz Boiteux Piazza, 1302-Canasvieiras, 88056-000 Florianópolis, SC, Brazília
Absztrakt
A központi idegrendszer számos betegségét jellemzi, és néha súlyosbítja az érintett szövet intenzív gyulladásos reakciója. Ma már elfogadott, hogy a gyulladás feloldása egy aktív folyamat, amelyet egy mediátorok csoportja közvetít, és amelyek szinkronban képesek a sejtek fenotípusának megváltoztatására, egy gyulladásos gyulladásról a másikra, ami elősegíti a homeosztázisba való visszatérést. A megelőző mediátorok ezen új nemzetsége az elsőként felfedezett rezvineket, protektineket, marinákat és lipoxinokat tartalmazza. Ebben a rövid áttekintésben áttekintést nyújtunk a lipoxinok sejt- és molekuláris kölcsönhatásairól a központi idegrendszer betegségeiben tapasztalható jelenlegi ismeretekről, amelyek úgy tűnik, hogy megkönnyítik a gyulladás feloldódását, és neuroprotektív hatást fejtenek ki.
1. Bemutatkozás
A neurológiai betegségek, mint például az Alzheimer-kór, a Parkinson-kór, a traumás agysérülés és agyvérzés, valamint a krónikus neuropátiás fájdalomhoz vezető állapotok általában markáns átmeneti vagy folyamatos neuroinflammációval járnak. Hogy ennek a gyulladásos állapotnak van-e jótékony vagy káros hatása, még mindig ellentmondásos. A mikroglia, a makrofágok és a limfociták együttes működése védelmi mechanizmust eredményez a sérült agyszövet izolálására és az érintett sejtek elpusztítására. Így a gyulladásos válaszok általában önkorlátozó gyógyulási folyamatot eredményeznek. Ha azonban ez a válasz nincs megfelelően kontrollálva, akkor az immunrendszer támadni kezdi a korábban sértetlen sejteket, ami progresszív idegsejtvesztést okozhat, számos egyéb káros hatás mellett [1].
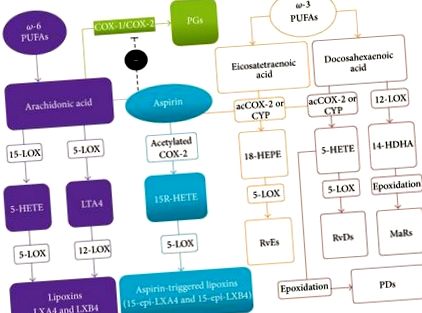
Számos tanulmány felvetette azt a kérdést, hogy az omega-3 (ω-3) A többszörösen telítetlen zsírsavak (PUFA-k) potenciálisan gyulladáscsökkentő anyagokká történő metabolizmusuk eredménye lehet [2–5]. Egyre több bizonyíték azt jelzi, hogy a gyulladást modulálhatják az endogén módon előállított lipidek, amelyek aktívan részt vesznek a gazda sérülésekre adott válaszainak csillapításában, ami a gyulladásos folyamat aktív feloldásához vezet [6]. Az endogén, megelőző lipid mediátorok ezen csoportja jelenleg lipoxinokat (LX), rezvineket, protektineket és marinákat tartalmaz, amelyek mindegyike képes aktívan megoldani a gyulladást azáltal, hogy jelzi az anyagcsere-, sejt- és szöveteseményeket, hogy a gyulladás után visszatérjen a homeosztázisba, egy folyamat során. katabázis néven ismert [7].
Az LX-ek (és ATL-ek) elősegítik hatásaik nagy részét azáltal, hogy az ALX/FPR2 receptornak nevezett specifikus G-fehérjéhez kapcsolt receptorra hatnak, amely a formil-peptid-receptor szupercsalád tagja. Ez a receptor számos szövetben található meg, beleértve a lépet és a tüdőt, valamint a sejteket, például a makrofágokat, a neutrofileket és a mikrogliákat, és különféle specifikus jelátviteli utakhoz kapcsolódik, attól függően, hogy hol expresszálódnak [13]. Az ALX/FPR2 receptor reagál a rezvinekre és számos peptidre is, amelyek közül néhány, mint az annekdin-1, prolesololáló, míg mások, például az amiloidogén peptidek, gyulladáscsökkentőek [14]. Fontos, hogy az LXA4 további receptorokhoz is kötődhet, beleértve az AhR aril-szénhidrogén-receptort [15], a ciszteinil-leukotrién-receptort (CysLT) [16, 17], a GPR32-receptort [18] és a CB1-kannabinoid-receptort [19]. Az LXA4 azonban nem mindig viselkedik agonistaként, amikor ezekhez a receptorokhoz kötődik, mivel a CysLT receptor részleges antagonistája [14], és a CB1 kannabinoid receptorok alloszterikus jelátviteli fokozója [19].
Bár az LX-ek AA-eredetű eikozanoidok, egyértelműen megkülönböztethetők a klasszikus proinflammatorikus prosztaglandinoktól, a tromboxántól és a leukotriénektől azon képességük alapján, hogy a leukociták által generálva önkorlátozó reakciót váltsanak ki a gyulladásra. Valójában kialakulásuk és funkcióik közvetlenül kapcsolódnak a gyulladás helyén jelenlévő neutrofilek fenotípusának változásához [20]. Miután a sérülés helyén kialakultak, az LX-ek elnyomják a neutrofil rekrutációt, fokozzák az apoptotikus neutrofilek fagocitózisát a makrofágok által, és stimulálják a nonphlogistic típusú monociták/makrofágok felhalmozódását, amelyek nem termelnek gyulladásgátló mediátorokat [21].
Egyre több tanulmány igazolta az LX-ek gyulladáscsökkentő és előoldó szerek szerepét a perifériás és központi rendellenességek, köztük a szív- és érrendszeri betegségek különböző állatmodelljeiben, mások által áttekintve [6, 10, 22, 23]. Itt konkrétan áttekintést nyújtunk az LX-ek biológiai hatásainak profiljáról, amelyek relevánsak lehetnek a központi idegrendszeri gyulladásos rendellenességek (CNS) terápiás szerekként történő alkalmazásában.
2. Alzheimer-kór
Az Alzheimer-kór (AD) egy pusztító neurodegeneratív szindróma, amelyet drasztikus és progresszív demencia és viselkedésváltozások jellemeznek, elsősorban az amiloidból álló extracelluláris szenilis plakkok agyban történő felhalmozódásával. β fehérje (Aβ), hiperfoszforilált tau fehérjét tartalmazó intraneuronális neurofibrilláris gubancok és krónikus ideggyulladás. Ez a betegség világszerte több millió embert érint, különösen késői életkorban, és okait nem teljesen értik [24]. Az erőfeszítések ellenére az AD-nek jelenleg nincs gyógyírja, és a rendelkezésre álló támogató kezelés korántsem hatékony. Ez a világ népességének várható élettartamának jelentős növekedésével együtt az AD hatékonyabb kezelésének keresését teszi a modern orvostudomány egyik legnagyobb kihívásává.
A lipidek szerepét az AD patogenezisében több csoport elemezte, és néhány tanulmány kimutatta, hogy az AD-ben szenvedő betegek agya esetleges aberrált lipid-anyagcserét mutat be [25–27]. Az AD neurodegeneratív folyamata szorosan összefügg az agy gyulladásos reakciójával, amely számos AA-eredetű lipid gyulladásos mediátort érint [28]. Valóban, egy nemrégiben készült tanulmány feltárta, hogy az AD-betegek agyában a gyulladás oldódása károsodott [29]. A tanulmány megállapította, hogy az AD betegek cerebrospinalis folyadékának és hippocampusának postmortem mintáiban az LXA4 szintje alacsonyabb volt, mint a kontroll alanyoké, és hogy ez a csökkenés összefüggésben van a kognitív hiány mértékével és a tau fehérje szöveti felhalmozódásával. Ezzel szemben az ALX/FPR2 receptorok expressziója egyértelműen nagyobb volt az AD hippocampus mintákban.
Érdekes módon amiloid β fehérje (Aβ), amely az AD patogenezisének egyik fő hozzájárulója, kötődik és aktiválja az ALX/FPR2 receptorokat, de antagonista hatású [30]. Le és munkatársai [30] kimutatták, hogy AβAz 1-42 humán leukocitákban kemotaktikus aktivitást fejt ki az ALX/FPR2 receptor aktiválása révén. Ennek megfelelően egy másik tanulmány kimutatta, hogy Aβ, ALX/FPR2 receptorokon keresztül hatva kemotaxist és szuperoxid termelést indukál az egér neutrofiljeiben és stimulálja a tenyésztett egér mikroglia sejteket. . Ezek és más kísérleti megfigyelések egyértelműen megállapítják, hogy az ALX/FPR2 receptorok patofiziológiailag relevánsak az A-banβ-mediált proinflammatorikus válaszok AD-ben [32].
Másrészről egy nemrégiben végzett tanulmány szerint az ATL 15-epi-lipoxin A4 (ATLA4) napi kétszeri elhúzódó kezelése lenyűgöző hatást váltott ki az AD genetikailag megalapozott egérmodelljében [33]. A vizsgálat kiemelkedőbb eredményei között az ATLA4 csökkentette a proinflammatorikus mediátorok TNF-α, interleukin-1 agytermelésétβ (IL-1β), interferon-γ, Az IL-6, a GM-CSF és a RANTES, valamint az MMP-9, amelyek mindegyike szorosan összefügg az AD progressziójával. Ezzel szemben az ATLA4 növelte az IL-10 és a TGF gyulladásgátló citokinek agyszintjét-β, stimulálta az alternatív mikroglia sejtek felhalmozódását, amelyek a klasszikus sejtekkel ellentétben nonphlogistic fenotípust mutatnak, és fokozták az Aβ a CNS-ben. Megjegyzendő, és a korábbi megfigyelésekkel összhangban, hogy Aβ aktiválja az NF-etκB jelátviteli út az egér agyában [34], az ATLA4 kezelés szintén csökkentette az NF-tκB-aktiváció az agy asztrocitáiban (de nem az idegsejtekben vagy a mikroglia sejtekben) [34].
Összefoglalva: LXA4 és Aβ ellentétes hatást fejtenek ki az ALX/FPR2 receptoron, és míg az agy LXA4 termelése csökken az AD-ben, az ALX/FPR2 receptorok túlzottan expresszálódnak [29]. Első pillantásra ez a forgatókönyv erőteljesen támogatná A megerősítésétβ az AD patogenezisén. Paradox módon azonban az ALX/FPR2 receptorok megnövekedett expressziója a gliasejtekben az AD során a beteg agyat is jobban reagálni fogja az LXA4-re, így az LX-ekkel történő kezelés nagyon érdekes lehetőség az AD-terápia szempontjából. Mindazonáltal, mivel az LXA4 más, az ALX/FPR2 receptorokon kívüli receptorokkal is kölcsönhatásba léphet, továbbra is jobban jellemezni kell az LXA4 ilyen molekuláris célokra kifejtett hatásait az AD neuroprotektív hatásaira. Például, figyelembe véve, hogy a CB1 kannabinoidok jótékony hatást fejtenek ki az AD állatmodelljeiben [35], az a tény, hogy az LXA4 alloszterikus jelátviteli fokozó a CB1 kannabinoid receptorokon [19], releváns lehet az AD kezelésben rejlő potenciál szempontjából.
3. Stroke
Az iszkémiás stroke a morbiditás és a halálozás egyik fő oka az egész világon, és kimenetele attól függ, hogy a gyulladás terjedése által a penumbra milyen másodlagos agykárosodást okoz [36]. A stroke bekövetkeztével a vér-agy gát (permeabilitása) azonnal megnő és aktiválja a gyulladásos válaszok kaszkádját, amely magában foglalja a glia aktiválását, a neutrofil infiltrációt, a szelektinek és más sejtközi adhéziós molekulák fokozott expresszióját a BBB endoteliális sejtjein, valamint egy az immunsejtek behatolása, ami iszkémiás agysérüléshez vezet [37–39]. A stroke után túlzott reaktív oxigénfajok (ROS) keletkeznek, amelyek súlyosbítják az idegsejtek halálát [40, 41]. A BBB permeabilitásában röviddel az átmeneti vagy állandó fokális ischaemia megjelenése után bekövetkezett változások emberi betegekben és az állati stroke modellekben nagyrészt a metalloproteinázok (MMP), főleg az MMP-9 és az MMP-2 fokozott termelésének következményei, endothelsejtek, mikroglia és asztrociták által [42–51]
Amint arról korábban tárgyaltunk, az LXA4 ALX/FPR2 receptorai a neutrofilekben, monocitákban, makrofágokban, idegi őssejtekben és a központi idegrendszerben rezidens sejtekben vannak, amelyek potenciális célpontokká teszik őket az agyban az LXA4 számára [52–55]. A röviddel a sérülést követően észlelt kezdeti gyulladás fokozatosan tágul, és a szélütés után több órán át vagy napig sokkal nagyobb területet érint [56, 57]. Az agyi iszkémia gyorsan kiváltja a rezidens glia aktiválódását a vérsejtek toborzása mellett [58], és ha a neutrofilek behatolnak az érintett területre, foszfolipázokat, proteázokat és oxigénnel szabad gyököket szabadítanak fel [56]. Az agyban telítetlen zsírsavak különösen érzékenyek a szabad gyökök által kiváltott peroxidációra. Nem meglepő, hogy ezért agyvérzés állatmodelljeiben a sérülés enyhíthető a gyulladásos kaszkád egyes részeinek blokkolásával [59, 60] vagy a korai szakaszban korlátozva a neutrofil infiltrációt [56, 58, 61].
Az MMP-k egy másik fontos célpontot jelentenek az LXA4 jótékony hatásainak a stroke során. Ebben a tekintetben átmeneti középső agyi artéria elzáródásnak kitett patkányokban az LXA4 analóg BML-111-vel végzett korai sérülés utáni kezelés elősegítette az MMP-9 és MMP-3 expressziójának és aktivitásának jelentős csökkenését, valamint az endogén MMP inhibitor TIMP-1 a kéregben [64]. Ez a kezelés csökkentette az agy ödémáját, a BBB megszakadását és az infarktus méretét a kéregben, de nem a striatumban, ami arra utal, hogy szelektíven gyengítette a gyulladás terjedését az egész kéregben [64]. Ezenkívül a BML-111 kezelés drámai módon csökkentette az agyba való neutrofil infiltrációt és a mikroglia sejtek aktiválódását [64]. A gliasejt-aktivitás gátlása különösen fontos lehet az LX-ek gyulladáscsökkentő hatása szempontjából, mivel az ATLA4 jelentősen csökkenti az LPS-indukálta reaktív oxigénfajok termelését a tenyésztett mikroglia sejtekben [75], valamint a nitrogén-oxid és PGE2 termelést iNOS és COX-2 expresszióval tenyésztett asztrociták [76].
A mai napig csak egy vizsgálat kísérelt meg antagonistákat használni az LXA4 neuroprotektív hatásait közvetítő receptorok jellemzésére a stroke-ban [74]. Érdekes, hogy ez a tanulmány kimutatta, hogy a középső agyi artéria elzáródásának kitett patkányok kombinált kezelése a Boc-2 ALX/FPR2 receptor antagonistával (butoxikarbonil-Phe-Leu-Phe-Leu-Phe) csak elősegítette az LXA4 által kiváltott agyi infarktus mérete és a neurológiai pontszámok javulása. Ezenkívül a Boc-2 nem tudta blokkolni az eritroid 2-es nukleáris faktorral kapcsolatos 2-es faktor (Nrf2) LXA4-indukálta expresszióját és annak sejtmagba történő transzlokációját, valamint a HO-1 expresszióját és a GSH szintézisét sem. Valójában egy korábbi tanulmány kimutatta, hogy az ALX4 aktiválja az Nrf2 jelátviteli utat egér és emberi makrofágokban [77]. Mivel ez a transzkripciós faktor koordinálja az antioxidáns válaszelemek által szabályozott gének expresszióját, az LXA4 Boc-2-rezisztens Nrf2-függő hatásai, amelyeket Wu és munkatársai ismertettek [74], vagyis a HO-1 (egy redox-érzékeny) fokozott expressziója indukálható enzim) és a GSH (antioxidáns fehérje) szintézise fontos ALX/FPR2 receptor-független mechanizmust képeznek a sejtek védelmére a stroke utáni oxidatív károsodásoktól.
Összességében az ebben a szakaszban áttekintett tanulmányok azt mutatják, hogy az LXA4, az ATLA4 és a BML-111 mindegyike egyértelmű vágású neuroprotektív hatást fejt ki a stroke modellekben. Így az LX-ek terápiás értékkel bírhatnak az iszkémiás stroke kezelésében. Az LXA4 neuroprotektív hatásainak legalább egy része úgy tűnik, hogy egy Nrf2-GSH/OH-1 jelátviteli út aktiválásából ered.
4. Traumatikus agysérülés
A traumás agysérülés (TBI) az agy működésének megváltozása vagy az agy patológiájának külső erő által okozott bizonyítéka, és kifejezetten az agy károsodásával függ össze [78]. Becslések szerint évente 235 000 amerikait hospitalizálnak nem halálos TBI miatt, 1,1 milliót pedig sürgősségi osztályokon kezelnek, de évente 50 000 halálos esettel a TBI az egyik fő halálozási ok a fiatalok körében [79, 80]. A TBI fő okai a bukások, a járműbalesetek, a bántalmazások és a sport [81].
Nyilvánvaló, hogy ez az úttörő tanulmány Luo és mtsai. [82] már ismertette az LX-ek nagyon biztató intézkedéseit a TBI-ben, és további további kutatásokat kell ösztönöznie ebben a témában.
5. Neuropátiás fájdalom
Becslések szerint a krónikus fájdalom előfordulása az amerikai és az európai lakosság körében körülbelül 30%, és a krónikus fájdalmakról beszámoló emberek körülbelül ötöde vélhetően túlnyomórészt neuropátiás fájdalmat szenved (azaz a teljes populáció körülbelül 6% -át). [83]. A neuropátiás fájdalom a szomatoszenzoros rendszer sérüléséből vagy diszfunkciójából eredő fájdalom [84], de ez a terminológia valójában többféle neuropátiás fájdalmat is magában foglal, amelyek többsége rosszul reagál a jelenleg elérhető gyógyszeres kezelésekre [83].
A perifériás szövetek sérülése vagy gyulladása általában reverzibilis változásokat vált ki az érzékszervi idegrendszerben, amelyek fokozzák a nociceptív fájdalom iránti érzékenységet, amely mechanizmus védi és biztosítja a sérült szövet megfelelő gyógyulását. Ezzel szemben a neuropátiás fájdalom gyakran rosszul alkalmazkodó állapot, amely maga az idegrendszer közvetlen sérüléséből ered. A fájdalmas utak érzékenységének állandó változásai a káros ingerek észleléséhez kapcsolódnak, így általában az ártalmatlan ingerek fájdalmat váltanak ki (allodynia), és a káros ingerekre adott válaszok amplitúdóban (hiperalgézia) és/vagy időtartamban (hiperpátia) eltúloznak. spontán fájdalom [85].
Fontos, hogy a proinflammatorikus citokinek, beleértve az IL-1-et isβ, Az IL-6 és a TNF-a periférián és központilag termelődik idegkárosodás hatására [86]. Ezért a perifériás és központi ideggyulladás nemcsak a krónikus gyulladásos fájdalom kialakulásában és fenntartásában vesz részt [79, 80], hanem valószínűleg hozzájárul a neuropátiás fájdalomhoz is [79, 80]. Valójában, még akkor is, ha a neuropátiás és a nemneuropátiás fájdalmakról általában elismerten különálló entitásokat alkotnak, a neurotranszmitterek, a neuropeptidek, a citokinek és az enzimek, amelyek mindkét fájdalomtípusban érintettek, sokak megegyeznek [83]. Ebben a tekintetben eddig csak néhány tanulmány próbálta jellemezni az LX-ek és az ATL-ek hatását a gyulladásos és neuropátiás fájdalom modelljeiben.
Az LXA4 fájdalomra gyakorolt hatásának értékelésére szolgáló első tanulmány megállapította, hogy az LXA4, LXB4 vagy egy ATL analóg intravénás vagy intratekális injekciói csökkentették a patkányokban a karrageenán által kiváltott gyulladásos hátsó mancs termikus hiperalgéziát [54]. A tanulmány arról is beszámolt, hogy a gerincvelői asztrociták expresszálják az ALX/FPR2 receptorokat, és az extracelluláris szignál által szabályozott kináz és a c-Jun N-terminális kináz csökkent aktivációjával reagálnak az LXA4-re. Megerősítve az LX-ek szabályozási szerepét a gerinc gyulladásos nociceptív feldolgozásában, egy másik tanulmány kimutatta, hogy az intrathecalis LXA4 beadása gátolja a mechanikus allodynia-t és a gerinc TNF-α szintjének növekedését is, amelyet a karrageenán indukál a patkányok hátsó mancsába [87].
A központi idegrendszer közvetlen elváltozásai, például az agy vagy a gerincvelő stroke vagy traumás sérülése által okozott elváltozások szintén a betegek jelentős részében kiválthatják a „központi fájdalomként” ismert neuropátiás fájdalom állapotát [88]. Meg kell becsülni az LX-ek lehetséges hatásait az ilyen típusú sérülésekhez kapcsolódó nociceptív változások és spontán fájdalom szabályozásában, de az ebben a szakaszban ismertetett tanulmányokból az LX-ek új módszert jelenthetnek mind a gyulladásos, mind a neuropátiás fájdalom hatékony kezelésére. fájdalom.
6. Következtetések
Érdekkonfliktus
A szerzők kijelentik, hogy a jelen cikk megjelenésével kapcsolatban nincs összeférhetetlenség.
A szerzők közreműködése
Alessandra Cadete Martini és Stefânia Forner egyformán járult hozzá ehhez a munkához.
Elismerés
A szerzőket Brazíliában a Conselho Nacional de Desenvolvimento Científico e Tecnológico (CNPq) támogatja.
Hivatkozások
- Az idegrendszeri aktivitás megjósolhatja a sikeres fogyást
- A mikrotubulus-kötő kemoterápiás gyógyszerek tartós felhalmozódása a perifériás idegrendszerben
- A „valódi” ok, amiért nem veszít le az autonóm idegrendszer erejéből -
- Az idegrendszer kulcsfontosságú lehet a fogyáshoz - Fogyasztói egészségügyi hírek HealthDay
- A Mirena (Levonorgestrel-felszabadító méhen belüli rendszer) mellékhatásai, figyelmeztetések, felhasználások