A mikrotubulus-kötő kemoterápiás gyógyszerek tartós felhalmozódása a perifériás idegrendszerben: összefüggések az idő lefolyásával és a neurotoxikus súlyossággal
Krystyna M. Wozniak
1 Johns Hopkins gyógyszerfelfedezés
James J. Vornov
4 Medpace, Cincinnati, OH
Ying Wu
1 Johns Hopkins gyógyszerfelfedezés
Kenichi Nomoto
3 Eisai Inc., Andover, MA
Bruce A. Littlefield
3 Eisai Inc., Andover, MA
Christopher DesJardins
3 Eisai Inc., Andover, MA
Yanke Yu
3 Eisai Inc., Andover, MA
George Lai
3 Eisai Inc., Andover, MA
Larisa Reyderman
3 Eisai Inc., Andover, MA
Nancy Wong
3 Eisai Inc., Andover, MA
Barbara S. Slusher
2 Neurológiai, Orvostudományi Pszichiátriai és Idegtudományi Osztály, Baltimore, MD
Absztrakt
BEVEZETÉS
Régóta felismerték, hogy az idő halmozott kemoterápiás dózisa a neuropátia legfontosabb klinikai előrejelzője. Ez a dózistól való függőség vagy az egyes beadások toxicitása által okozott sérülések felhalmozódásának, vagy a perifériás idegszövetekben a gyógyszer felhalmozódásának lehet az oka, amely csak többszöri adagolás után éri el a toxikus szintet. A perifériás idegszövet expozícióját klinikailag nehéz számszerűsíteni, és a plazmakoncentráció valószínűleg rosszul jósolja a változó eloszlás miatt, amelyet gyakran olyan tényezők erősen befolyásolnak, mint a készítmény vagy az adagolás módja (9–12). Ezenkívül változik a szövetekből való kiürülés mechanizmusa is, amelyet a kemoterápiás szerek kötése a szövetekben és a transzportmechanizmusok, például a P-glikoproteinek által közvetített kiáramlás határoz meg (13, 14).
A perifériás idegszövet felhalmozódása és a neuropathia közötti potenciális kapcsolat további vizsgálatához hasznos lenne összehasonlítani a hasonló mechanizmusú, de eltérő neurotoxikus potenciállal rendelkező kemoterápiás szereket. Az itt leírt kísérletek során meghatároztuk a plazma farmakokinetika, a perifériás idegrendszeri szövetkoncentráció és a neuropathia kialakulása közötti kapcsolatot egyetlen beadás és kéthetes MTD modell alkalmazásával három mikrotubulus célzó kemoterápiában. Először számoltunk be arról, hogy mindhárom gyógyszer drámai és tartós felhalmozódást mutat DRG-ben és SN-ben, és az utolsó adag után hetekig tartják a mérhető szinteket. Legalábbis a paclitaxel és az eribulin esetében azonban a szöveti behatolás és felhalmozódás mértéke nem korrelál a neuropathia kialakulásával.
MÓD
Állatok
A nőstény BALB/c egereket (kb. 7–8 hetesek az adagolás kezdetén) a Harlan Laboratories-tól (Indianapolis, IN) szereztük be, és fenntartottuk a vízhez való szabad hozzáférést és a standardizált szintetikus étrendet (Harlan Teklab). Az állatok elhelyezését és az eljárás szobahőmérsékletét 20 ± 2 ° C-on, illetve 55 ± 10% -án tartottuk. A mesterséges megvilágítás 12 órás fény/12 óra sötét ciklust biztosított (fény 7–19 óra). Az összes kísérleti protokollt a Sobran Inc. Intézményi Állattenyésztési és Felhasználási Bizottsága hagyta jóvá, és betartotta a laboratóriumi állatok kíméletes bánásmódjára vonatkozó összes alkalmazandó intézményi és kormányzati irányelvet.
Az egereket egy korábban meghatározott, 6 dózisú MTD-séma egyszeri és többszöri dózisával kezeltük intravénásan, Q2Dx3 × 2 hetes ütemterv szerint (a módszert lásd (3)). Az MTD-t az eribulin-mezilát, az ixabepilon vagy a paclitaxel maximális dózisaként határozták meg, amelynél a kezelt csoportban legfeljebb egy állat spontán pusztult el. Ezenkívül ez volt a maximálisan tesztelt dózis, amelynél a dóziscsoport egyetlen egere sem igényelte az eutanáziát az egyéni súlycsökkenés több mint 20% -a miatt, és a szorongás vagy az evés és/vagy inni képtelenség nyilvánvaló klinikai tüneteit mutatta. Az MTD dózis, amikor IV-ben adták be hatszor Q2Dx3 × 2 hetes ütemterv szerint, eribulin esetén 1,125 mg/kg, ixabepilon esetében 2 mg/kg és paklitaxel esetén 30 mg/kg volt.
Kábítószerek és készítmények
Az Eisai Kutatóintézetben szintetizált és sötétben -80 fokon tárolt eribulin-mezilátot 100% vízmentes DMSO-ban (Sigma-Aldrich, St. Louis, MO) oldottuk, így 10 mg/ml törzsoldatot kaptunk, amelyet alikvotákat és -80 ° C-on tároljuk az alkalmazás napjáig. Minden beadási napon a törzsoldatot felengedtük és sóoldattal hígítottuk 0,112 mg/ml végkoncentrációra 2,5% DMSO/97,5% koncentrációban, és 10 ml/kg térfogatban adtuk be.
A paclitaxelt (amelyet az LC Laboratories, Woburn, MA vásárolt, és –20 ° C-on, sötétben tároltunk) etanolban (100%) oldottunk a végső térfogat 10% -án. Ezután azonos térfogatú kremofort (a végső térfogat 10% -a) adunk hozzá, és az elegyet körülbelül 10 percig vortexeljük. Közvetlenül az injekció beadása előtt jéghideg fiziológiás sóoldatot adunk a végső térfogathoz (a végső mennyiség 80% -ában), és az oldatot az adagolás alatt jégen tartjuk. A 3 mg/ml-es adagolási oldatokat naponta frissen készítettük, és 10 ml/kg térfogatban adtuk be.
Az ixabepilont (Ixempra, Bristol-Myers Squibb, N. J.) a csomagolás szerint készítettük el. Az elkészített ixabepilon törzsoldatot (2 mg/ml) azonnal alikvotáljuk és felhasználásig 80 ° C-on tároljuk. Minden kísérleti napon a törzsoldatot 50% etanol/50% kremofor hozzáadásával hígítottuk, majd vortexeltük, és így a kívánt adagolási koncentráció ötszörösének megfelelő oldatot kaptunk. Végül 4 térfogat PBS-t adtunk hozzá keverés közben, hogy elérjük a 10 ml/kg végső adagolási koncentrációt.
Farmakokinetikai vizsgálatok
Elektrofiziológia
EREDMÉNYEK
Farmakokinetikai vizsgálatok
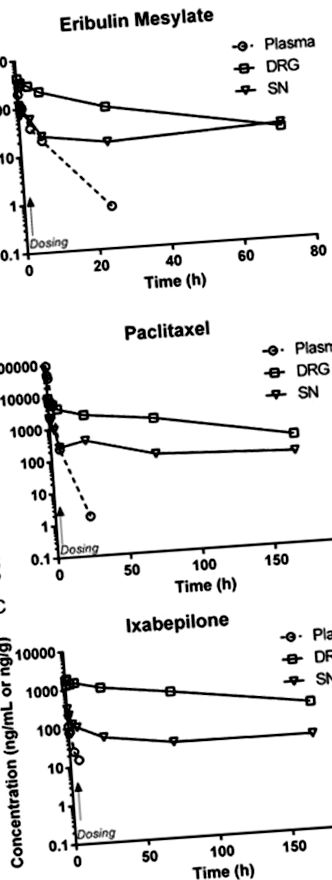
Intravénás alkalmazást követően az eribulin, a paclitaxel és az ixabepilone plazmakoncentrációja gyorsan csökkent, feltehetően a perifériás részekre történő gyors eloszlás miatt (19–21). A teszt érzékenységének korlátai megakadályozták a terminális elimináció jellemzését. Egyetlen infúzió után mindhárom gyógyszer gyorsan eloszlott DRG-be és SN-be, és több mint 72 órán át a kimutatási határ felett maradt. Az 1A – C ábra az eribulin, a paclitaxel és az ixabepilone koncentráció-idő elemzését mutatja be a megfelelő mátrixukban egyszeri dózis után. .
A paclitaxel, az eribulin-mezilát és az ixabepilone farmakokinetikai profilja egerekben, egyszeri (nyíllal jelölt) 30, 1,125 és 2,0 mg/kg intravénás dózist kapó egerek plazmájában, DRG-ben és SN-jében. Minden esetben a 24 órás adagolás után összegyűjtött plazmaminták alacsonyabbak voltak a kvantifikációs szint alatt, bár a DRG és SN szintek továbbra is számszerűsíthetők voltak az adagolás után 72 órával. (Jelképek: Plazma ⦵, DRG, SN).
Amint azt a farmakokinetikai paraméterek mutatják (1. táblázat), a három gyógyszer intravénás beadása után a szövetek relatív penetrációja nagymértékben különbözött. A korai szöveteloszlás során a felhalmozódás, amelyet a szövetben elért maximális expozíció (Cmax) tükröz a plazmához képest, legnagyobb volt az ixabepilon, majd az eribulin esetében. A szövetekben a paclitaxel csúcskoncentrációja alacsonyabb volt, mint a plazma csúcskoncentrációja, míg az eribulin és az ixabepilon Cmax-értéke magasabb volt a szövetekben, mint a plazmában. A csúcskérdés mind a három vegyület esetében nagyobb volt DRG-ben, mint ülőidegben. A teljes DRG és SN expozíciót a plazmához viszonyítva a szöveti penetrációs index (TPI) kiszámításával jellemeztük mind Cmax, mind AUC értékeket. Amint az 1. táblázat mutatja, a relatív expozíció mindkét mérőszámban nagyobb volt a DRG-ben, mint az ülőideg, mindhárom olyan gyógyszer esetében, ahol a legnagyobb expozíciójú ixabepilon, az eribulin közepes, a paklitaxel pedig viszonylag alacsony.
Asztal 1
Az eribulin-mezilát, a paclitaxel és az ixabepilone egyetlen intravénás dózisának farmakokinetikai paraméterei egerekben.
- Az idegrendszer kulcsfontosságú lehet a fogyáshoz - Fogyasztói egészségügyi hírek HealthDay
- A Lipoxin A4 neuroprotektív hatásai a központi idegrendszer patológiáiban
- A „valódi” ok, amiért nem veszít le az autonóm idegrendszer erejéből -
- Az idegrendszeri aktivitás megjósolhatja a sikeres fogyást
- Háború utáni prevenció A kábítószer-használat megelőzésének kialakulóban lévő keretei a kábítószer-háború után