A magas zsírtartalmú étrend okozta elhízás növeli a szívizom károsodását és megváltoztatja a szív STAT3 jelzését egerekben a polimikrobiális szepszis után
Theodore DeMartini
a Cincinnati Gyermekkórház Orvosi Központ, a Cincinnati Egyetem Orvostudományi Főiskolájának Kritikus Gondozási Orvostudományi Osztálya, Ohio, Cincinnati Egyetem
Marchele Nowell
a Cincinnati Gyermekkórház Orvosi Központ, a Cincinnati Egyetem Orvostudományi Főiskolájának Kritikus Gondozási Orvostudományi Osztálya, Ohio, Cincinnati Egyetem
Jeanne James
b Molekuláris kardiovaszkuláris biológiai osztály, Gyermekgyógyászati Osztály, Cincinnati Gyermekkórház Orvosi Központ, Cincinnati Egyetem Orvostudományi Főiskola, Cincinnati, Ohio 3333 Burnet Avenue, MLC 2005, Cincinnati, Ohio, USA 45229
Lauren Williamson
a Cincinnati Gyermekkórház Orvosi Központ, a Cincinnati Egyetem Orvostudományi Főiskolájának Kritikus Gondozási Orvostudományi Osztálya, Ohio, Cincinnati Egyetem
Patrick Lahni
a Cincinnati Gyermekkórház Orvosi Központ, a Cincinnati Egyetem Orvostudományi Főiskolájának Kritikus Gondozási Orvostudományi Osztálya, Ohio, Cincinnati Egyetem
Hui Shen
a Cincinnati Gyermekkórház Orvosi Központ, a Cincinnati Egyetem Orvostudományi Főiskolájának Kritikus Gondozási Orvostudományi Osztálya, Ohio, Cincinnati Egyetem
Jennifer M. Kaplan
a Cincinnati Gyermekkórház Orvosi Központ, a Cincinnati Egyetem Orvostudományi Főiskolájának Kritikus Gondozási Orvostudományi Osztálya, Ohio, Cincinnati Egyetem
Absztrakt
1. Bemutatkozás
A szepszis az intenzív osztályon (ICU) szenvedő betegek vezető halálozási oka, legfeljebb 50% -os halálozással [1, 2]. A szepszis diszfunkcionális immunválasszal jár, amely szöveti sérüléshez és szervi elégtelenséghez vezethet [3]. A társbetegségek, például az elhízás, a kórházi kezelés és a visszafogadás növelésével bonyolítják a szepszist [4]. Az elhízás krónikus gyulladással jár, azonban akut sértésre, például traumára reagálva, az elhízott emberi alanyoknak depressziós citokinválaszuk van a nem elhízott alanyokhoz képest [5]. Laboratóriumunk adatai a szepszis után elhízott egerekben csökkent citokinválaszt is mutatnak [6]. Ezenkívül az elhízott egerek halálozása magasabb a szepszis után [6, 7].
A fokozott zsírbetegség megváltoztathatja a szív szerkezetét, és káros hatással lehet a szívre [8]. Mitra és mtsai. kimutatta, hogy az elhízott egerek érzékenyebbek a doxorubicin által kiváltott kardiotoxicitásra a normál testsúlykontrollokhoz képest [9]. Más tanulmányokban azonban az elhízás kardio-protektív volt, és az elhízott egerek infarktusának mérete csökkent a miokardiális infarktus után a nem elhízott egerekhez képest [10]. Továbbá, elhízással és szívbetegséggel rendelkező embereken végzett vizsgálatok alacsonyabb halálozást mutatnak az elhízott betegek körében, ezt a koncepciót „elhízási paradoxonnak” nevezik [11, 12]. Kevéssé ismert a szívnek az elhízás által kiváltott hatása, amely a szepszis során jelentkezik.
A jelátalakító és a transzkripció aktivátora (STAT) -3 fontos akut fázisú reagens a szepszisben. A leptin és az interleukin (IL) -6 egyaránt aktiválja a STAT3 jelátviteli utat és foszforilációhoz vezet a két hely egyikén, a 705 tirozinon vagy a 727 szerinen. Az STAT3 szintén fontos a szív stressz által kiváltott válaszában. A STAT3 korai aktiválása nyilvánvaló a szívben a β-adrenerg receptor agonista kezelésre adott válasz és a szívspecifikus STAT3 deléció következtében fokozott szívhipertrófia, nekrózis és apoptózis következett be krónikus β-adrenerg stimuláció után [13]. Az elhízás hatással van a szív STAT3 expressziójára is, mivel a szív STAT3 expressziója eltérően szabályozott volt a Bama miniatűr sertésekben, akiket hosszú távú, nagy energiájú táplálékkal tápláltak, összehasonlítva a kontrollokkal [14]. A citokin szignálcsalád (SOCS3) szuppresszora a STAT3 negatív szabályozójaként működik [15]. A SOCS3 fokozza az elhízást, ami a STAT3 foszforilációjának alacsony szintű szabályozásához vezet [9]. Ezek a tanulmányok azt sugallják, hogy a STAT3 útvonal fontos a szívben a stressz alatt, de az elhízás megváltozik. Tekintettel a STAT3 fontosságára a sérülés akut fázisában adott válaszában, arra kerestük a választ, hogy a szepszis során megváltozott-e a STAT3 útja a szívben és befolyásolja-e az elhízás.
2. Anyagok és módszerek
2.1 Egerek és diéták
A vizsgálat megfelelt az Egyesült Államok Nemzeti Egészségügyi Intézete által kiadott, a laboratóriumi állatok gondozására és felhasználására vonatkozó útmutatónak [16], és a Cincinnati Gyermekkórház Orvosi Központjának intézményi állatgondozási és felhasználási bizottsága jóváhagyta. A kísérleti csoportok hím C57BL/6 egerekből álltak, hathetes korban, a Charles River Laboratories International, Inc.-től (Wilmington, MA). Az egereket a Cincinnati Gyermekkutatási Alapítvány (CCRF) állattartó létesítményében helyezték el. Az ételt és a vizet ad libitum szolgáltatták. Az állatokat 6 hétig randomizálták magas zsírtartalmú étrendbe (HFD) (TestDiet - 58Y1) (60% kcal zsírból adták) vagy normál étrendbe (ND) (Formulab - 5008) (16% kcal zsírból adták).
2.2. Testtömeg és testösszetétel
A test súlyát hetente egyszer ellenőriztük a vizsgálat étrendi szakaszában. A zsírtömeg számszerűsítéséhez elemeztük a testösszetételt a 6 hetes diéta fázis végén, az EchoMRI testösszetétel-analizátorok (EchoMRI, Houston, Tx) NMR képalkotásával.
2.3. A cecalis ligálás és szúrás egérmodellje (CLP)
Az egereket 6 hétig HFD-vel vagy ND-vel táplálták, majd CLP-n mentek keresztül, hogy polimikrobiális szepszist indukáljanak, a korábban leírtak szerint [17]. Az egereket izofluránnal altattuk. A hasat kinyitották, a vakbélet exteriorizálták, és tövénél 6,0 ligatúrával ligálták. Kettős szúrás technikát hajtottak végre 22 g tűvel, és a széklet anyagát a hashártyába juttatták. A hasi bemetszést folyékony topikális ragasztóval lezártuk. Az állatokat szubkután injektált steril sóoldattal (0,6 ml) újraélesztettük és imipenemet (25 mg/kg) kaptunk az antimikrobiális lefedettség érdekében. A plazmát és a teljes szívszövetet a CLP után 6 órával gyűjtöttük az alábbiakban ismertetett biokémiai vizsgálatokhoz.
2.4. Troponin I
A plazmát egerekből nyertük le az áldozatkészítés idején. A plazma szív troponin I-t (cTnI) nagy érzékenységű szív troponin-I ELISA kit alkalmazásával számszerűsítettük (Life Diagnostics, West Chester, PA).
2.5. A mieloperoxidáz aktivitás mérése
A mieloperoxidáz aktivitást a neutrofil felhalmozódás indexeként határoztuk meg, a korábban leírtak szerint [18]. A szöveteket 0,5% hexa-decil-trimetil-ammónium-bromidot tartalmazó oldatban homogenizáltuk 10 mM kálium-foszfát-pufferben (pH 7) oldva, és 30 percig 4 000 C-on 4 ° C-on centrifugáltuk. A felülúszó alikvot részét hagytuk reagálni tetra-metil-benzidin (1,6 mM) és 0,1 mM hidrogén-peroxid oldatával. Az abszorbancia változásának sebességét spektrofotometriával mértük 650 nm-en. A mieloperoxidáz aktivitásként meghatároztuk az 1 μmol hidrogén-peroxidot percenként lebontó enzim mennyiségét 37 ° C-on, 100 mg szövet tömegre számítva.
2.6. Echokardiográfiai vizsgálatok
Az egerek külön csoportját alkalmaztuk az echokardiográfiai elemzéshez. A 6 hetes diétás beavatkozás után az egereket izofluránnal altattuk és CLP-n mentek keresztül. Minden CLP-n átesett egér túlélte 18 órán át, és így echokardiográfiát hajtott végre (n = 8 egér/csoport). Az echokardiográfiát egy VisualSonics 2100 rendszer (Toronto, Ontario, Kanada) segítségével végeztük, amely 30 MHz-es jelátalakítóval volt felszerelve, az előzőekben leírtak szerint [19]. Közvetlenül mértük a pulzusszámot, a bal kamra belső méreteit, beleértve a vég-diasztolés és a vég-szisztolés dimenziókat, az interventricularis septum vastagságát a diastolában és a sistolában, valamint az LV hátsó falvastagságát a diastolában és a szisztolában.
2.7. A génexpresszió elemzése
Az RT-qPCR vizsgálatokat a gyártási protokoll szerint hajtottuk végre, a Mouse Prime I-L6/STAT3 PCR Assay segítségével, amely a 96 IL-6/STAT3-hoz kapcsolódó gén expresszióját jellemzi (BioRad katalógus # 10034344, Hercules, CA). A szívmintákat TRIzol-ban (Invitrogen, Grand Island, NY) homogenizáltuk. Az RNS-t fordítottan írták át az RT 2 First Strand Kit segítségével a cDNS szintéziséhez a gyártás protokollja szerint (Qiagen, Valencia, CA). A ciklusküszöböt az összes minta között standardizáltuk. Minden mintát két háztartási génre normalizáltunk (ΔCT). A normalizált kontrollmintákat (nem elhízott, nem szeptikus egerek) kivontuk a normalizált kísérleti mintákból (ΔΔCT). A nem elhízott nem szeptikus csoportot kontrollcsoportnak, a nem elhízott szeptikus, elhízott nem szeptikus és elhízott szeptikus csoportokat kísérleti csoportnak (n = 4 egér/csoport) állítottuk be. Az egyes szövetek ráncváltozását az összehasonlító CT módszerrel számítottuk (2 -ΔΔ C T). A vizsgálat integritását genomi DNS-kontroll, 3 reverz transzkripciós kontroll és 3 pozitív PCR-kontroll segítségével figyeltük meg.
2.8. Szubcelluláris frakcionálás és magfehérje-extrakció
A szívszövet mintákat 0,32 M szacharózt, 10 mM Tris-HCl-t, 1 mM etilén-glikol-tetraecetsavat (EGTA), 2 mM etilén-diamin-tetraecetsavat (EDTA), 5 mM NaN3, 10 mM β-merkaptoetanolt, 50 mM NaF-et tartalmazó pufferben homogenizáltuk., 20 μM leupeptin, 0,15 μM pepstatin A és 0,2 mM fenil-metil-szulfonil-fluorid (PMSF), 1 mM nátrium-ortovanadát, 0,4 nM mikrocisztin [20]. A homogenizátumokat centrifugáltuk (1000xg 4 ° C-on, 10 perc). A felülúszót (citoszol + membrán kivonat) összegyűjtöttük és tároltuk. A pelleteket Triton pufferben (1% Triton X-100, 150 mM NaCl, 10 mM Tris-HCl (pH 7,4), 1 mM EGTA, 1 mM EDTA, 0,2 mM nátrium-ortovanadát, 20 μM leupeptin A és 0,2) oldottuk. mM PMSF). A lizátumokat centrifugáltuk (15 000 x g, 4 ° C-on, 30 perc), és a felülúszót (magkivonat) összegyűjtöttük. A fehérje mennyiségét Bradford-esszével számszerűsítettük.
2.9. Western blot elemzés
Az elemzést nukleáris kivonatokon végeztük, kivéve, ha azt jeleztük. Az összes Western-blottoláshoz az Invitrogen NuPAGE gélelektroforézis rendszert (Invitrogen) használtuk. NuPAGE 10% Bis-Tris géleket használtunk NuPAGE MOPS pufferrel és Invitrogen Novex Mini-Cell, BioRad PowerPac 300-mal. A membránokat BioRad ChemiDoc XRS + gél dokumentációs rendszerrel készítettük és elemeztük ImageLab v5.1 szoftverrel (BioRad, Hercules, CA). A következő antitesteket használtuk a kívánt fehérjék szondázására: STAT3 (Cell Signaling Technologies, Danvers, MA), pSTAT3 (Tyrosine 705) (Cell Signaling Technologies), pSTAT3 (Serine 727) (Cell Signaling Technologies), SOCS3 (Santa Cruz Biotechnology), Inc., Dallas, Texas), gp130 (citoszol) (Cell Signaling Technologies), béta-aktin (nukleáris és citoszol) (Santa Cruz Biotechnology, Inc., Dallas, Texas).
2.10. Statisztikai analízis
Az adatokat Sigmaplot (Systat Systems, San Jose, CA) alkalmazásával elemeztük. Az értékeket a szövegben és az ábrákban a paraméterek adatainak átlagának és standard hibájának (SEM), a nem paraméteres adatok esetén pedig medián és interkvartilis tartománynak adják meg. Az adatokat ANOVA-val és t-teszttel elemeztük a paraméteres adatokra, és Mann-Whitney-tesztel elemeztük a nem parametrikus adatokat. Az echokardiográfiai adatokat a GraphPad InStat 3 for Macintosh alkalmazással elemeztük párosítatlan és párosított t-tesztek segítségével. A szignifikanciát P ≤ 0,05-ként határoztuk meg.
3. Eredmények
3.1. A magas zsírtartalmú diétás táplálás súlygyarapodáshoz és megnövekedett zsírtömeghez vezet
Hat hetes táplálkozás után 60% kcal zsírtartalmú étrenden (normál étrendben 16% -kal szemben) az egereknél szignifikánsan nagyobb volt a teljes súlygyarapodás (11,7 ± 1,9 g vs 5,0 ± 1,3 g, p 1. ábra) szignifikánsan magasabb a HFD-vel táplált csoport (8,0 ± 2,6 g vs 0,6 ± 0,5 g, p 1. táblázat). Az egerek CLP-n estek át, és a CLP után 18 óráig túlélték, és így ismételt echokardiográfiát vetettek alá. Szepszis után a nem elhízott egerek pulzusszáma alacsonyabb volt a kiindulási és az elhízott egerekhez képest. A szepszis után az elhízott egerek szívműködése javult, amit a frakcionált rövidülés növekedése bizonyít. Így, bár az elhízott egerek kiindulási állapotában gyenge funkciót mutatnak, a szívműködés fokozódik a szepszisre adott válaszként.
Asztal 1
HR = pulzus; IVSd = diasztolés interventricularis septum vastagság; LVID = szisztolés bal kamra belső dimenziója; LVIDd = diastolés bal kamra belső dimenziója; FS = a bal kamra frakcionált rövidülése; LVM = bal kamrai tömeg; LVPWd = a diastolés bal kamra hátsó falvastagsága.
| HR (ütés/perc) | 442 ± 85 | 437 ± 24 | 325 ± 46 * | 430 ± 25 # |
| IVSd (mm) | 0,85 ± 0,1 | 0,78 ± 0,02 | 1 ± 0,16 | 0,86 ± 0,15 |
| LVID-k (mm) | 2,53 ± 0,35 | 3,17 ± 0,41 # | 2,27 ± 0,85 | 2,54 ± 0,34 * |
| LVIDd (mm) | 4 ± 0,41 | 4,20 ± 0,35 | 3,51 ± 0,76 | 3,68 ± 0,4 * |
| FS (%) | 34 ± 4 | 25 ± 5 # | 37 ± 10 | 31 ± 4 * |
| LVM (mg) | 96 ± 14,1 | 95,2 ± 14,8 | 91 ± 8 | 84 ± 7 * |
| LVPWd (mm) | 0,74 ± 0,07 | 0,73 ± 0,1 | 0,88 ± 0,23 | 0,77 ± 0,07 |
HR = pulzus; IVSd = diasztolés interventricularis septum vastagság; LVID = szisztolés bal kamra belső dimenziója; LVIDd = diastolés bal kamra belső dimenziója; F5 = a bal kamra frakcionált rövidülése; LVM = bal kamrai tömeg; LVPWd = diastolés bal kamra hátsó falvastagsága;.
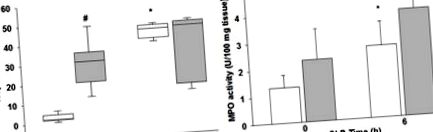
(A) Plazma szív troponin I és (B) szív neutrofil infiltráció a myeloperoxidase assay (MPO) alapján, fehér oszlopok/dobozok = nem elhízott egerek, szürke oszlopok/dobozok = elhízott egerek. * p A 3A. ábra: a középső pontok változatlan génexpressziót mutatnak, a határvonalak a szeptikus elhízott és a szeptikus, nem elhízott minták négyszeres génszabályozási levágását jelzik. A piros vonal négyszeres, a zöld vonal pedig négyszeres szabályozást jelez. A CLP után 6 órával a differenciálisan expresszált gének vizsgálata azt mutatja, hogy a szeptikus elhízott egerekben az IL-17a volt a leginkább szabályozott gén (26,5-szeres növekedés) a szeptikus, nem elhízott egerekhez képest (3. ábra A & B). Az IL-17a, Csf2 és IL-10 különbségeket mutat, amelyek több mint duplázást jelentenek (log 2 változás> 1,0), és statisztikailag szignifikánsak voltak P≤0,05 értéknél (3. ábra).
Az IL-6/STAT3 szignalizációval kapcsolatos 90 gén génexpressziós profilját elhízott és nem elhízott egerekben a CLP után 6 órával értékeltük. (A) A középpontok változatlan génexpressziót képviselnek. A határvonalak a szeptikus elhízott és a szeptikus, nem elhízott minták négyszeres génszabályozási elválasztását jelzik (vörös vonal, négyszeres felszabályozás; zöld vonal négyszeres lefelé történő szabályozás). Az IL-17a, Csf2 és IL-10 különbségeket mutat, amelyek több mint kétszeresét jelentik (log 2 változás> 1), és statisztikailag szignifikánsak voltak P≤0,05-nél. (B) Az IL-17a, Csf2 és IL-10 relatív expressziója elhízott szeptikus egerekben normalizálódott nem elhízott szeptikus egerekre. Szürke sáv = elhízott szeptikus egerek, fehér sáv = nem elhízott szeptikus egerek. A szaggatott vonalat 1-re helyezzük referenciaként. n = 4 egér/csoport.
3.5. Az elhízás megváltoztatja a szepszisben a STAT3 foszforilációját
Mivel az IL-17 termelődését befolyásolja a STAT3 aktivitása, arra kerestük a választ, hogy a szepszis során elhízott és nem elhízott egerekben eltérő módon szabályozták-e a STAT3 aktiválódását. Western blot expresszióval kiderült, hogy a STAT3 foszforilációja a 727-es szerinnél nagyobb volt a nukleáris szívkivonatokban elhízott egereknél a kiindulási értéknél (0,79 ± 0,15 relatív egység), mint a nem elhízott egereknél (0,3 ± 0,15 relatív egység, p. 4 A&C) Szepszis után a STAT3 foszforilációja a 727-es szerinnél fokozódott az elhízott és nem elhízott egereknél, összehasonlítva a kiindulási értékkel, és a STAT3 foszforilációja a 72-es szerinnél magasabb maradt az elhízott egereknél, mint a nem elhízott egerek. A Western blot elemzés, amely a STAT3 nukleáris foszforilációját értékelte a 705-es tirozinnál, hasonló fehérje expressziót mutatott kiinduláskor elhízott és nem elhízott egerekben. A STAT3 foszforilációja a 705 tirozinnál mind a nem elhízott, mind az elhízott egereknél jelentősen megnőtt a szepszis után (0,6 ± 0,4 vs 11,1 ± 1,7 relatív egység, p 4. ábra B & D).
- A magas zsírtartalmú étrend okozta elhízás növeli az azoximetán által kiváltott vastagbélpolipok képződését
- A glutén fokozza az ateroszklerotikus plakkképződést az ApoE–– diéták okozta elhízással rendelkező egerekben -
- Hogyan növeli az elhízás a cukorbetegség kockázatát - ScienceDaily
- Hogyan növeli az elhízás az ízületi károsodást
- A magas szénhidráttartalmú étrend elhízást és cukorbetegséget okozhat; Alacsony szénhidráttartalmú ételek