A magas zsírtartalmú étrend szövetspecifikus változásokhoz vezet, amelyek tükrözik a DBA/2J egerek betegségeinek kockázati tényezőit
Jackson laboratórium, Bar Harbor, Maine; és
Növény- és állattudományi tanszék, Humboldt-Universität zu Berlin, Berlin, Németország
Növény- és állattudományi tanszék, Humboldt-Universität zu Berlin, Berlin, Németország
Jackson laboratórium, Bar Harbor, Maine; és
Jackson laboratórium, Bar Harbor, Maine; és
Növény- és állattudományi tanszék, Humboldt-Universität zu Berlin, Berlin, Németország
Az újranyomtatási kérelmek és egyéb levelezések címe: G. A. Brockmann, Tenyésztési biológia és molekuláris genetika, Növény- és állattudományi tanszék, Humboldt-Universität zu Berlin, Invalidenstraße 42, 10115 Berlin, Németország (e-mail: [email protected]).
Absztrakt
Az elhízás a metabolikus szindróma és a betegség jól elismert kockázati tényezője, amelyet gyakran alacsony fokú krónikus gyulladás kísér (20, 27). McGarry (36) úttörő munkája azt állította, hogy az inzulinrezisztencia és a hiperglikémia jobban megérthető, ha a lipid anyagcsere összefüggésében nézzük. A zsírösszetétel és a különböző szövetek közötti eloszlás megváltozása az egész test metabolikus következményeivel járhat, amelyek betegséghez vezetnek. A lipidek nemcsak a felesleges energiát tároló molekulák; a sejtmembránok fő alkotóelemei is, és szignálmolekulaként működnek, amelyek szabályozzák a szisztémás biológiai folyamatokat. Mint ilyen, helyileg megváltoztathatják a transzkripciót, vagy információhordozóként működhetnek, hogy megváltoztassák más sejtek, szövetek vagy szervek működését.
A fehér zsírszövet (WAT) és a barna zsírszövet (BAT) kiegészítő szerepet játszanak az energia-egyensúlyban és a testtömeg-szabályozásban. A legtöbb emlősnél a BAT az adaptív termogenezis elsődleges közvetítője, ezért kritikus szerepet játszik az energiafelhasználásban. A WAT raktárként szolgál az energiatároláshoz, és információt küld a perifériás szerveknek és szöveteknek az energiatartalékokról. A súlygyarapodás során a zsírraktárakat nem használják egyformán, és felépítésükben és funkciójukban különböznek egymástól (20, 34, 35). Egyre nyilvánvalóbbá vált, hogy a zsírfelhalmozódás régiója és a specifikus zsírsavak rendelkezésre állása kulcsfontosságú szerepet játszik a betegségre való hajlamban. Kimutatták, hogy a magas viszcerális zsírszinttel jellemezhető központi elhízás korrelál a 2-es típusú cukorbetegséggel, diszlipidémiával és kardiovaszkuláris betegségekkel (10, 55, 58). Alternatív megoldásként a perifériás elhízásnak, a szubkután zsír megnövekedett mennyiségének olyan védőhatásai lehetnek, amelyek javítják az inzulinérzékenységet és csökkentik a betegségek kockázati tényezőit (44, 51). Ezenkívül a zsír méhben és izomban történő tárolása összefüggésben áll a máj steatosisával és az izom inzulinrezisztenciájával (5, 23).
A táplálkozási genomikai vizsgálatok elemezték a szövetek válaszait a különféle étrendekre és tápanyagokra (1, 14, 18). Az eredmények azonban fajonként és szövetenként eltérőek, valamint a kísérleti protokollok (48, 53). Azt, hogy a különböző szövetek milyen mértékben és módon reagálnak a fokozott zsírraktározásra, nem ismerjük jól. Ezért ennek a tanulmánynak az volt a célja, hogy összekapcsolja az étrend által kiváltott zsírlerakódást és a zsírsavprofilokat a szövetspecifikus funkcionális adaptációkkal a zsírraktározás hatására. Arra számítottunk, hogy a szöveti tömeg és a zsírsavösszetétel különbségei differenciális változásokat eredményeznek az elhízáshoz és inzulinrezisztenciához vezető utakban részt vevő specifikus transzkriptumokban.
A magas beltartalmú étrendre (HFD) reagálva a DBA/2J egerek mutatták a legnagyobb súlygyarapodást 43 beltenyésztett törzs között (49). Ezért a fiatal DBA/2J egereket 6 hét HFD tápláléknak tettük ki [gazdag telített zsírsavakban (SFA)], és megvizsgáltuk a szövetspecifikus tömeggyarapodást, a zsírösszetételt és a transzkriptum bőségét. Megvizsgáltuk a BAT, a WAT (gonadal, gluteális, mesentericus, retroperitoneális, szubkután), máj és izom reakcióit 12 hetes korban, amikor a HFD-s egerek tovább híztak és az anyagcseréjük lassult.
Állatok, étrend és ház.
Huszonnégy 5 hetes hím DBA/2J egeret nyertünk a The Jackson Laboratory-ból. Az átlagos testtömeg a szállításkor 14,8 ± 1,5 g volt. Valamennyi állatot normál tenyésztési táplálékkal (SBD) etették 6 hét koráig. Az állatokat ezután két etetési csoportra osztottuk, csoportonként azonos átlagos testtömeggel. Az ezt követő 6 hétben az egyik csoportot HFD-vel etették, a másikat SBD-vel tartották. Az állatokat ad libitum etették, és szabadon hozzáférhettek a vízhez. Az egereket párban, egy specifikus kórokozótól mentes helyiségben helyeztük el 12: 12-órás világos-sötét ciklus mellett. Az összes kísérleti eljárást az Állatgondozási és Felhasználási Bizottság jóváhagyta a Jackson Laboratóriumban végzett kísérletekhez (jóváhagyási szám: A3268-01), és a német Állatvédelmi Hatóság jóváhagyta a Humboldt-Egyetem Állattartó létesítményében végzett kísérleteket (jóváhagyási szám: G0301 08).
A HFD egy tisztított TestDiet 58G8 volt, 45% zsírtartalmú energiával, amely a TestDiet Basal Diet 5755-en alapul (Purina Mills, Richmond, IN). Az étrend 21,9% fehérjét, 23,5% zsírt, 4,9% rostot és 42,7% szénhidrátot, ásványi anyagot és vitamint tartalmazott (az értékek w/wt-ban vannak megadva). Az energiatartalom 4,70 kcal/g (19,68 kJ/g) volt; a zsír 45% -kal, a fehérjék 18,6% -kal, a szénhidrátok pedig 36,4% -kal járultak hozzá. Az SBD standard patkány és egér/Auto 4F tenyésztéses LabDiet 5K54 (Purina Mills) volt. Az étrend 18% fehérjét, 4% zsírt és 5% rostot tartalmazott. Az SBD bruttó energiája 3,97 kcal/g (16,62 kJ/g) volt; Az energia 22% -át fehérjék, 11% -át zsír és 67% -át szénhidrátok szolgáltatták. Az élettani üzemanyag értéke 3,28 kcal/g (13,73 kJ/g), az anyagcserélhető energia pedig 3,09 kcal/g (12,94 kJ/g). A HFD zsírja elsősorban zsír volt, némi kukoricaolajjal, míg az SBD zsírforrása szójaolaj volt. Az egész kísérleti időszak alatt egy termelési adag étrendet etettek. A gyártó megadta az élelmiszer-összetételre vonatkozó adatokat. A diéták kémiai elemzése azt mutatta, hogy a HFD és az SBD 21,8, illetve 4,6 g zsírt tartalmazott 100 g étrendben. A diétákat felhasználás előtt sterilizáltuk.
Egérfenotipizálás és szövetmintavétel.
Az egereket hetente lemértük 5 és 12 hét között. A táplálékfelvételt a felajánlott és a maradék ételmennyiség különbségének becsülték 7 napos időközönként 8. hét tovább. Az ételt préselt pelletként szolgálták az alacsony kiömlés érdekében, és a maradék kiömlést itt nem vették figyelembe. Az energiafogyasztást, amelyet az egyes étrendek energiatartalma és az elfogyasztott tömeg alapján határoztak meg, napi alapon számolták. A takarmány-hatékonyságot a testtömeg-növekedés grammokban és az elfogyasztott energiák arányában határoztuk meg kilodžoulokban. Az állatok közötti összehasonlításhoz az energiafogyasztást, a takarmányhatékonyságot és a heti táplálékfelvétel mérését átlagoltuk a 8 és 12 hét közötti időszakra.
A szérum lipideket [összkoleszterin, nagy sűrűségű lipoprotein (HDL) koleszterin, trigliceridek (TG), szabad (nem észterezett) zsírsavak (NEFA)] és a glükózt a boncolás napján Beckman Coulter Synchron CX5 Delta kémiai elemzővel (Beckman) mértük. Coulter, Fullerton, Kalifornia) a gyártó utasításainak megfelelően (részletek a http://pga.jax.org/protocols oldalon). Az összes koleszterint és a HDL-koleszterint közvetlenül mértük. A nem HDL-koleszterin becslése, amely az egérben kis sűrűségű lipoproteinből (LDL) és nagyon kis sűrűségű lipoprotein (VLDL) koleszterinből áll, úgy nyerhető, hogy a HDL koleszterint kivonjuk az összkoleszterinből. A szérum inzulint 5 μl-es mintákban határoztuk meg a DRG Instruments (Marburg, Németország) által forgalmazott Insulin Mouse Ultrasensitive ELISA Kit segítségével. A fentiekben leírtak szerint a leptint az m/rLeptin ELISA készlettel határoztuk meg a Mediagnost (Reutlingen, Németország) cégtől. A táplálkozási csoportok közötti fenotípusos értékek összehasonlításához Student's t-tesztet alkalmaztunk kétfarkú eloszlásokra, egyenlő eltérésekkel. Az étrend és a szövetek hatását a zsírsav-eloszlás mintázatára az SAS statisztikai csomaggal elemeztük (SAS 1989).
A zsírsavprofilok kémiai elemzéséhez étrendmintákat és étrendcsoportonként három egér különféle szöveteit gyűjtöttük külön-külön 15 ml-es csövekbe, amelyeket nitrogéngázzal töltöttünk meg. Az összes szövetet lemértük, csövekbe helyeztük, és ismét nitrogéngázzal fedtük át, hogy megakadályozzuk a zsírsavak oxidációját –18 ° C-on történő tárolás során. A szérumban történő elemzéshez csoportonként hat szérumot egyesítettünk, hogy elegendő anyagot kapjunk az elemzéshez. A zsírsavprofilok meghatározása az SFA C10: 0, C12: 0, C14: 0, C15: 0, C16: 0, C17: 0, C18: 0, C20: 0, C21: 0, C21: 0 mennyiségi meghatározását tartalmazta. és C24: 0, egyszeresen telítetlen zsírsavak (MUFA) C14: 1, C15: 1, C16: 1, C17: 1, C18: 1, C18: 1, C20: 1, C22: 1 és C24: 1, és a többszörösen telítetlen zsírsavak (PUFA) C18: 2 n – 6, C18: 3 n – 3, C18–4 n – 3, C20: 2, C20: 3 n – 6, C20: 4 n – 6, C20: 5 n – 3, C22: 2, C22–5 és C22–6 n – 3. A zsírsav-komponensek 100 g-os mérési pontossága a következő volt:> 5 g/100 g zsír ± 10%, 1–5 g/100 g zsír ± 10–15%, 0,5–1 g/100 g zsír ± 20 %, és Y i = μ + Diéta + ε i
A statisztikai vizsgálatokat módosított módszerrel végeztük F statisztikai, Fs, amely tartalmazza a varianciakomponensek zsugorodási becsléseit (13). P az értékeket úgy kaptuk meg, hogy a modell maradványait 1000-szer megismételtük (S1. kiegészítő ábra). 1 A számításokat az R/MAANOVA csomaggal végeztük (56). A hamis felfedezési arányt (FDR) statisztikailag szignifikáns próbákra a következővel becsültük: q értékek (46).
Korrelációs elemzés és főkomponens-elemzés.
A szövetenkénti interakció ANOVA-modellje és a zsírsav-komponensek közötti differenciálisan expresszált gének varianciakomponensei és a zsírsav-komponensek közötti páros összefüggéseket Pearson-korrelációs együtthatóként számoltuk.
Kimutatták, hogy az ANOVA modellben az egyes varianciakomponensekre alkalmazott fő komponens elemzés (PCA) betekintést nyújt a kezeléseknek a génexpressziós adatokra gyakorolt hatásaira (15). PCA-t alkalmaztunk az ANOVA szövetenkénti interakciós modell varianciakomponenseire a C16: 0, C16: 1, C18: 0, C18: 1, C18: 2 n – 6 és C18: 3 zsírsavkomponensekkel együtt. n – 3 különböző szövetekben és táplálkozási körülmények között. A szövetenkénti interakciós modell varianciakomponenseit a PCA-elemzéshez egyesítettük az egyes szövetek és étrend-állapotok standardizált zsírsav-összetétel-méréseivel. Az első négy fő komponens magyarázta a variáció 90% -át. Az első négy fő komponens kétfedelű ábráját a 4. ábra mutatja. A Hotelling T 2 statisztikát számítottunk minden génre és zsírsav-komponensre, mint
Útgazdagítás.
A génontológiai konzorcium ellenőrzött szókészletet, a gén ontológiát (GO) hozott létre a gén és géntermék kapcsolatok leírására (26). Kiotói gének és genomok enciklopédiáját (KEGG) fejlesztették ki, hogy leírják az anyagcsere, a jelátvitel és a betegség útján fennálló kapcsolatokat (28 Kétféle útelemzést alkalmaztunk, amelyek célja a dúsítási jel különböző aspektusainak megragadása a felülreprezentált KEGG és GO kategóriák kimutatására.
Hypergeometrikus teszteket végeztek a GOstats csomaggal a dúsított biológiai kategóriák kimutatására (19). A génuniverzum (háttér) az adatkészletben jelen lévő 12 656 egyedi Entrez-génazonosító volt. A génkészletek szignifikanciáját a küszöb szintjén teszteltük P értéke X ¯ = 1 m ∑ g ∈ c s g
Élettani változások a magas zsírtartalmú etetés miatt.
1. táblázat: Zsírlerakódás a szövetekben
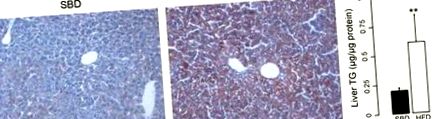
1. ábra.Olajvörös O festés, amely zsírszegény étrenden (HFD) mutat steatosist. A: zsírlerakódás az egerek májszövetében standard tenyésztési étrenden (SBD). B: magas zsírlerakódás egerekben HFD-n. C: triglicerid (TG) tartalom az SBD- és HFD-vel táplált egerek májában. **P
2. táblázat: A kiválasztott gének étrend által befolyásolt szeres változása
Az értékek változások (HFD vs. SBD). Abban az esetben, ha> 1 transzkriptum jelent egy gént, a legjelentősebb transzkriptumnak (a legkisebb P érték) képviselteti magát. Az étrendre adott válaszként legalább 1 szövetben differenciálisan expresszált összes gén transzkriptumának abszolút normalizált expressziós értékeinek teljes listáját az S5 kiegészítő táblázat tartalmazza. A normalizált expressziós adatok a Gene Expression Omnibus (GEO) adatbázison keresztül is elérhetőek (hozzáférési szám: 15822). Boldface, jelentősen felülszabályozva; dőlt betű, jelentősen le van szabályozva.
3. táblázat: Szérum mérések
2. ábra.A: glükóz-clearance egerekben SBD-n vagy HFD-n intraperitoneális glükózinjekció után 9 órás éhezés után. B: a görbe alatti terület (AUC). *P
3. ábra.A telített zsírsav (SFA), a többszörösen telítetlen zsír (PUFA) és az egyszeresen telítetlen zsír (MUFA) százalékos aránya az SBD-vel táplált egerek étrendjében, szérumában és szöveteiben (A) és HFD (B). BAT, barna zsírszövet; Glut, Gon, Mes, Ret, Sub, gonadal, gluteális, mesentericus, retroperitoneális és szubkután fehér zsírszövetek.
4. táblázat: Zsírsav-összetétel étrendben, szérumban, zsírszövetekben, májban és izomban
A szérum méréseket 6 állat összesített szérumából nyertük. A szövetekben található zsírsavösszetételek 3 különálló állat mérésén alapulnak. Az értékeket fajlagos zsírsav grammjában fejezzük ki 100 g összes zsírsavra számítva. Az étrend hatással volt az összes zsírsav arányára, a sztearinsav kivételével (C18: 0). A szöveti hatás minden zsírsav esetében nyilvánvaló volt. C16: 0, palmitinsav; C16: 1, palmitoleinsav; C18: 1, olajsav; C18: 2 n – 6, linolsav; C18: 3 n – 3, a-linolénsav; SFA, telített zsírsavak; MUFA, egyszeresen telítetlen zsírsavak; PUFA, többszörösen telítetlen zsírsavak.
5. táblázat: A magas zsírtartalmú étrendhez kapcsolódó KEGG-utak gazdagítási pontszámai
+2 és −2 küszöbértékeket használtak a szignifikáns fel- és lefelé történő szabályozás meghatározására a Kyoto Encyclopedia of Genenes and Genomes (KEGG) útvonalban. A t statisztikát használtunk génszintű bizonyítékként a számításokhoz. Boldface, jelentősen felülszabályozva; dőlt betű, jelentősen le van szabályozva.
A zsírsavak magas rendelkezésre állásával és a zsír túlzott raktározásával összhangban a zsírsavak bioszintéziséhez szükséges enzimeket kódoló gének (pl. Aacs, Acaca, Acacb, Acly) és a zsírsavak megnyúlása (Elovl6) erőteljesen csökkentek a szövetek között és a felső csoportokban 10 legjobban fel/le szabályozott gén (2. táblázat). WAT-ban, míg a legtöbb metabolikus út visszaszorult (5. táblázat), a béta-oxidáció elősegítői (Acadm, Acadl, Acsl1) a legtöbb WAT-ban aktiválódtak HFD körülmények között (2. táblázat). Így az SFA relatív csökkenése a MUFA-hoz képest az SFA előnyös oxidációjának is köszönhető HFD-vel táplált egerekben.
A zsírsavprofilok társulnak a transzkripciós változásokhoz.
Nyolcszázhatvan gén szignifikánsan korrelált (P érték
4. ábra.A fő komponens-elemzés (PCA) biplots az első 4 fő komponenshez (PC-k) (PC1 vs. PC2, A; PC1 vs. PC3, B; PC1 vs. PC4, C), amelyek a zsírsav-összetételre vonatkozó adatok és az ANOVA-interakciós modell varianciakomponenseinek PCA-analízisében a variabilitás 90% -át teszik ki Yén = μ + Diéta + Szövet + Diéta: Szövet + εén. A pontok a szondák (kék) és a zsírsavkomponensek (piros) pontszámait jelentik. A PCA terhelések fekete vonalakként jelennek meg. A palmitinsav (C16: 0), a sztearinsav (C18: 0), a palmitoleinsav (C16: 1) és az oleinsav (C18: 1) zsírszövet-tartalmával korreláló gének listáját az S6 kiegészítő táblázat tartalmazza.
A HFD génekre és útvonalakra gyakorolt hatása szövetspecifikus.
ANOVA modelleket használtunk a HFD miatti különbségek meghatározására az egyes szöveteken belül. A differenciál expressziót a küszöb szintjén határoztuk meg P 1. érték A cikk online verziója kiegészítő anyagokat tartalmaz.
KÖSZÖNETNYILVÁNÍTÁS
Köszönjük Stephan Schernecknek a máj trigliceridek meghatározását.
- Csökkenti a szív- és érrendszeri betegségek kockázatát 🍹 Japán fogyókúra 13 nap fogyás 💊 - Keleti parti mozi
- Életmódbeli és étrendi tényezők a krónikus myeloid leukémia kockázatával kapcsolatban az NIH-AARP étrendben
- A mediterrán étrend viselkedéstámogatással javítja az étkezési terv betartását, a CV kockázati tényezőket
- A magas zsírtartalmú étrend és az ösztrogénvesztés hogyan vezet a nőkhöz több hasi zsírt raktározni, mint a férfiak -
- Életmódbeli és étrendi tényezők a krónikus myeloid leukémia kockázatával kapcsolatban az NIH-AARP étrendben