A megemelkedett keringő sztearinsav jelentős lipotoxikus hatáshoz vezet az egér hasnyálmirigy-béta sejtjeiben hiperlipidémiában miR-34a-5p-közvetített PERK/p53-függő úton
Absztrakt
Célok/hipotézis
A szérum sztearinsav (C18: 0) emelkedett hiperlipidémiás és 2-es típusú cukorbetegségben szenvedő egyéneknél. A béta-sejtekben a sztearinsav megnövekedése által kiváltott lipotoxicitást azonban nem írták le jól. Ennek a tanulmánynak a célja a sztearinsav béta-sejtekre gyakorolt káros hatásainak és azok közvetítésének lehetséges mechanizmusainak vizsgálata.
Mód
A C57BL/6 egerek három csoportját normál étrenddel, vagy magas sztearinsav/magas palmitinsav tartalmú étrendet etették 24 hétig. A szigetek mikroRNS (miR) profilját mikroarray szűréssel határoztuk meg. A szigeti sérülést együttes festéssel detektáltuk a TUNEL vizsgálattal és az inzulinjelöléssel. Anti-miRNS-34a-5p oligonukleotidot (AMO-34a-5p) expresszáló lentivírus-vektort intraduktális hasnyálmirigy-úton injektáltunk egerekbe.
Eredmények
Az egér szigetein és a tenyésztett patkány inzulinoma INS-1 sejtekben a sztearinsav erősebb lipotoxikus szerepet játszott, mint más zsírsavak, a B-sejtes CLL/lymphoma 2 (BCL-2) és a BCL-2-szerű 2 (BCL-2 W) miR-34a-5p sztearinsav stimulálásával. A sztearinsav által kiváltott lipotoxicitást és az inzulinszekréció csökkenését az AMO-34a-5p enyhítette. Az INS-1 sejtekben végzett további vizsgálatok azt mutatták, hogy a p53 részt vett a miR-34a-5p sztearinsav által indukált emelkedésében, részben a protein-kináz-szerű endoplazmatikus retikulum kináz (PERK) aktiválása miatt. Ezzel szemben a PERK elnémítása enyhítette a sztearinsav által indukált p53, miR-34a-5p és lipotoxicitást.
Következtetések/értelmezés
Ezek az eredmények új betekintést nyújtanak a molekuláris mechanizmusok megértéséhez, amelyek nemcsak a sztearinsav által kiváltott lipotoxicitás káros hatásait, hanem a béta-sejtek apoptózisát és a 2-es típusú cukorbetegségbe való progressziót is megalapozzák.
Bevezetés
A lipotoxicitás a NEFA megemelkedett szintje által okozott sejtdiszfunkcióra utal. A felhalmozódó bizonyítékok azt mutatják, hogy a lipotoxicitás hozzájárul a béta-sejtek károsodásához, és kritikus szerepet játszik a 2-es típusú cukorbetegség kialakulásában [1–3]. A NEFA vegyileg telített és telítetlen zsírsavakba van besorolva. Széles körben elfogadott, hogy a lipotoxicitást leginkább hosszú láncú telített zsírsavak (SFA), például palmitinsav (C16: 0) és sztearinsav (C18: 0) indukálják, míg a telítetlen zsírsavak általában kevésbé mérgezőek, és akár védő is lehet [4–6].
Bár a sztearinsav által kiváltott lipotoxicitás molekuláris mechanizmusait nem teljesen értjük, nyilvánvaló, hogy a fokozott endoplazmatikus retikulum (ER) stressz központi szerepet játszik a transzkripciós újraprogramozásból [12], a c-Jun N-terminális kináz aktiválásából eredő lipotoxicitásban. [13], CCAAT/enhancer kötő fehérje homológ fehérje (CHOP) [14], p53 és mitokondriális apoptózis útvonalak [15, 16]. Fontos, hogy a mikro-RNS-ek (miRNS-ek), amelyek az ER stressz alatt részt vesznek a poszt-transzkripciós szabályozásban, a hepatocita és a szívizom lipotoxicitásának kulcsszabályozóiként jelentek meg [17, 18]. Sziget-béta sejtekben a miRNS szerepe a sztearinsav által közvetített lipotoxicitásban még mindig nem világos.
Ebben a tanulmányban feltételeztük, hogy a növekvő sztearinsav súlyosabb béta-sejt lipotoxicitást vált ki, mint más NEFA, és mögöttes mechanizmusa összefügg a miRNS (miR) -34a-5p.
Mód
Anyagok
A sztearinsav és a palmitinsav törzsoldatait (Sigma, St Louis, MO, USA) a korábban leírtak szerint állítottuk elő [19]. Az oligonukleotidokat és a lentivírust az elektronikus kiegészítő anyag (ESM) módszerek írják le.
Állatkísérletek
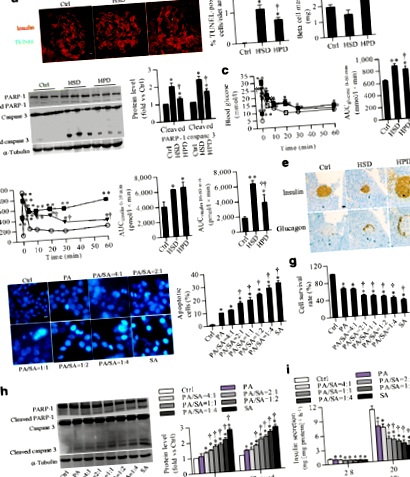
Minden kísérleti eljárás követte az állatok gondozására és felhasználására vonatkozó, a Harbini Orvostudományi Egyetem által kidolgozott és a Harbini Orvostudományi Egyetem Állatkísérleti Etikai Bizottsága által jóváhagyott irányelveket. Hét hetes C57BL/6 hím egereket vásároltak a Vital River Laboratories-tól (Peking, Kína), és teljesen randomizálták normál étrend, magas sztearinsavtartalmú étrend (HSD) vagy magas palmitinsavtartalmú étrend (HPD) fogadására. ) (ESM 1. táblázat). Az anti-miRNS-34a-5p oligonukleotidot (AMO-34a-5p) (lenti-AMO-34a-5p) (1x108 TU/ml) expresszáló lentivirális vektort lassan injektáltuk az egerekbe a hasnyálmirigy-csatornán keresztül (100 μl). 24 hetes etetés után, a korábban leírtak szerint [20]. További méréseket a lentivirális fertőzés utáni 4. héten végeztünk. Lásd: ESM-módszerek. A kísérletezők vakok voltak a csoportok kiosztására és az eredmények értékelésére.
A szérum NEFA profilja, valamint a glükóz és lipid mérése
Vérmintákat gyűjtöttünk a további kimutatáshoz. Lásd: ESM-módszerek.
miRNS microarray elemzés
Az Oebiotech (Sanghaj, Kína) elvégezte a miRNS mikroarray munkát, 12 mintát dolgozott fel egérszigetekről (n = 4 csoportonként). Lásd: ESM-módszerek.
Együttes festés TUNEL-vizsgálattal és inzulinjelölt szigetekkel
Sziget sérülését az In situ sejthalál-detektáló készlettel (TUNEL Fluorescence Kit, Roche, Indianapolis, IN, USA) detektáltuk. A szigeteket inzulinellenes antitesttel (Cell Signaling Technology, Minneapolis, MN, USA) jelöltük, és konfokális mikroszkóppal néztük meg őket. Lásd: ESM-módszerek.
Hasnyálmirigy inzulin tartalma
A hasnyálmirigyet a korábban leírt savas etanolos módszerrel extraháltuk [21], és az inzulinszintet kimutattuk.
Intravénás glükóz tolerancia tesztek
Az IVGTT-ket éjszakán át éheztetett egereken végeztük. Az inzulin- és glükózszint méréséhez vérmintákat vettünk 0, 1, 5, 10, 20, 30 és 60 perc múlva glükóz beadása után (0,75 g/kg) a farokvénába.
Béta-sejt tömeg és hisztokémiai elemzés
A hasnyálmirigy szöveteit rögzítettük, paraffinba ágyazottuk és inzulin- és glükagonellenes antitestekkel festettük. Lásd: ESM-módszerek.
Az inzulin granulátum elemzése
Elektronmikroszkóppal elemeztük az inzulingranulátum-tartalmat a rögzített hasnyálmirigy-szövetekben a korábban leírtak szerint [22].
Sejtkultúra
Patkány inzulinoma sejtvonal INS-1 sejteket tenyésztettünk, és 24 órán át 600 μmol/l sztearinsavval vagy más zsírsavval kezeltük. Az egér hasnyálmirigy-szigeteit a korábban leírtak szerint izoláltuk [23]. Lásd: ESM-módszerek. A kísérletezők vakok voltak a csoportok kiosztására és az eredmények értékelésére.
A sejtek életképességének mérése
A sejt életképességét a laktát-dehidrogenáz (LDH) felszabadulás, a propidium-jodid (PI) festés, a 3- (4,5-dimetil-2-tiazolil) -2,5-difenil-2 értékelésével határoztuk meg.H-tetrazolium-bromid (MTT) vizsgálat és Hoechst festés. Lásd: ESM-módszerek.
Transzfekciós eljárások
Az INS-1 sejteket oligonukleotidokkal vagy rekombináns plazmiddal transzfektáltuk Lipofectamine 2000 (Invitrogen) alkalmazásával, az előzőekben leírtak szerint [24], és a transzfekció után 48 órával detektálási vizsgálatokban használtuk őket.
Luciferáz aktivitás vizsgálata
A luciferáz aktivitást luciferáz aktivitás vizsgálattal detektáltuk. Lásd: ESM-módszerek.
Mennyiségi PCR
Az mRNS és miRNS szintjét kvantitatív PCR-rel (qPCR) határoztuk meg. Lásd: ESM-módszerek. A primer szekvenciákat az ESM 2. táblázatában mutatjuk be.
Western blot
A Western blot eljárást korábban leírták [25]. Lásd: ESM-módszerek.
Inzulin mérések
Az egér szérum és a sejttenyésztő táptalaj inzulinszintjét egér/patkány inzulin ELISA kit segítségével határoztuk meg (Linco Research, St Charles, MO, USA). A glükóz-indukált inzulin szekréció (GSIS) értékeléséhez a sejteket szekréciós pufferben inkubáltuk (lásd ESM módszerek) további 60 percig 2,8 vagy 20 mmol/l glükózzal.
Statisztika
Az értékeket átlag ± SD-ként fejezzük ki. Több csoportot elemeztek egyirányú ANOVA-val, majd egy Student – Newman – Keuls tesztet. Csak két csoportos összehasonlításokat végzett t teszt. Kétoldalas o érték
Eredmények
A sztearinsav súlyosabb lipotoxicitást vált ki, mint a palmitinsav
A sztearinsav növeli a miR-34a-5p szintet mind az egér szigetein, mind az INS-1 sejtekben
HSD-szigeteken 40 miRNS-t expresszáltak differenciálisan (tíz fel- és 30 lefelé szabályozott ≥2,0-szeres változás és o 2. ábra
A kvantitatív PCR igazolta, hogy a miR-34a-5p szintek 191% -kal nőttek a HSD-ben, illetve 97% -kal a HPD-szigeteken, összehasonlítva a normál szigetekkel (2b. Ábra). A palmitinsav/sztearinsav különböző arányának kitett INS-1 sejtekben a miR-34a-5p expressziója markánsan felülszabályozott a nagyobb arányú sztearinsavnak kitett sejtekben lévő kontrollokhoz képest (2c. Ábra).
A miR-34a-5p hozzájárul a sztearinsav által kiváltott lipotoxicitáshoz szigeteken és INS-1 sejtekben
Az miR-34a-5p specifikusan elnyomja a BCL-2 és a BCL-W expressziót
A B-sejt CLL/lymphoma 2 (BCL-2) és a BCL-2-szerű 2 (BCL-W) expressziója mind HSD-szigeteken, mind sztearinsavval kezelt INS-1 sejtekben csökkent (4a., B. Ábra). Az AMO-34a-5p kezelés, akár in vitro, akár in vivo, jelentősen megfordította a BCL-2 és BCL-W fehérjék sztearinsav által közvetített downregulációját (4c. Ábra, d). A miR-34a-5p-t túlzott mértékben expresszáló INS-1 sejtekben a BCL-2, valamint a BCL-W szintje csökkent, de hatékonyan megmenthető az AMO-34a-5p hozzáadásával (4e. Ábra). Ezenkívül a luciferázvizsgálat igazolta, hogy a miR-34a-5p túlzott expressziója gátolta a luciferáz aktivitást humán embrionális vese 293 (HEK293) sejtekben, amelyeket transzfektáltak mindkét plazma 3'-UTR-jét hordozó plazmiddal. Bcl2 vagy a Bcl2l2 gén (4f. ábra).
A p53 részt vesz a miR-34a-5p sztearinsav által indukált emelkedésében
A p53 fehérje mennyisége megnőtt a HSD szigeteken és a sztearinsavval kezelt INS-1 sejtekben (ESM 7a. Ábra). A sztearinsav által kiváltott lipotoxicitást elnémítás után megszüntettük p53 (más néven Trp53), amelyet a sztearinsavval megnövekedett miR-34a-5p 75% -os csökkenése kísér (5a – c. ábra). Eközben a hasított PARP-1 és hasított kaszpáz-3 sztearinsav által kiváltott upregulációját, valamint a BCL-2 és a BCL-W fehérje expressziójának szabályozását megmentette a p53 leütés (5d. Ábra).
A PERK hozzájárul a miR-34a-5p és a lipotoxicitás sztearinsav-indukálta felülszabályozásához
In vitro eredményeink azt mutatták, hogy az ER stressz transzmembrán szenzorai, beleértve az inozitolt igénylő 1-es enzimet (IRE1), az aktiváló 6-os transzkripciós faktort (ATF6) és a PERK-t, erősen szabályozzák a sztearinsav-kezelés. Hasonlóképpen, az ER stressz marker fehérjék, például a CHOP és a glükóz-szabályozott 78 kDa fehérje (GRP78) szintén fokozódtak (ESM 7b. Ábra). Genetikailag elhallgattatás Felfrissít (más néven Eif2ak3) kis interferáló RNS (siRNS) segítségével az INS-1 sejtekben jelentősen blokkolta a sztearinsav által kiváltott p53 expresszió növekedését (6a. ábra), miR-34a-5p szintjét (6b. ábra) és lipotoxicitását (6c., d ábra). ). Ennek megfelelően a hasított PARP-1 és a hasított kaszpáz 3, valamint a szuppresszált BCL-2 és BCL-W sztearinsavval megnövekedett expressziója visszatért az alapszintre a Felfrissít kifejezés (6e. ábra). Azonban egyikük géncsendezése sem Ire1 sem Atf6 gátolta a fent észlelt sztearinsav által kiváltott változásokat (ESM 8. ábra). Ezenkívül az eukarióta transzlációs iniciációs faktor (eIF) 2α foszforilált szintje jelentősen megnőtt a sztearinsav-expozíció után (ESM 9. ábra). Az siRNS-ek célzásának gátló hatékonysága p53, Ire1, Atf6 és Felfrissít az ESM a 10. ábrán látható.
Vita
Ebben a tanulmányban bizonyítékokat szolgáltatunk arra vonatkozóan, hogy a többi NEFA-hoz képest a sztearinsav játszik szerepet a béta-sejtek lipotoxicitásában, ami azt jelenti, hogy a szérum sztearinsav megnövekedett koncentrációja alapvető szerepet játszik a béta-sejtek diszfunkciójának és a 2-es típusú cukorbetegség kialakulásában . Mechanisztikus vizsgálataink kimutatták, hogy a miR-34a-5p upreguláció modulálja a sztearinsav által kiváltott lipotoxicitást azáltal, hogy gátolja a BCL-2 és BCL-W fehérjék termelését. További vizsgálatok azt is kimutatták, hogy az ER-stresszhez kapcsolódó PERK szenzor hozzájárul a miR-34a-5p sztearinsav-indukálta uregegulációjához egy p53-függő jelátviteli úton.
Korábbi tanulmányok azt mutatták, hogy a miR-34a-5p szorosan összefügg az apoptózissal a BCL-2 családon keresztül a rákos sejtekben, a tubuláris sejtekben és a kardiomiocitákban [37–39]. A BCL-2 család egyaránt tartalmaz anti-apoptózis tagokat (BCL-2, BCL-2-szerű 1 [BCL-XL] és BCL-W) és pro-apoptózis tagokat (BCL-2-asszociált X fehérje [BAX], BCL) -2-antagonista/gyilkos [BAK] és BCL-2-asszociált sejthalál-agonista [BAD]) [40, 41]. Vizsgálatunkban megerősítettük, hogy a BCL-2 és a BCL-W a miR-34a-5p közvetlen célpontja luciferáz aktivitási vizsgálatokkal. Az azonban továbbra sem világos, hogy a sztearinsav hogyan szabályozza a miR-34a-5p szintjét. A bizonyítékok felhalmozása alátámasztja a p53-at, mint a miR-34a-5p-t szabályozó klasszikus transzkripciós tényezőt. Az INS-1 sejtek sztearinsavval történő hosszú távú inkubálása után a p53 szerepének további vizsgálata a miR-34a-5p upregulációban elnémítottuk p53 majd megvizsgálta, hogy a miR-34a-5p szintek megfordultak-e, a lipotoxicitás csökkenésével jár-e, ami azt sugallja, hogy a miR-34a-5p HSD által kiváltott stimulációjának alapját képező mechanizmus p53-függő utat használ.
A béta-sejt lipotoxicitással járó fokozott ER stressz apoptotikus jeleket transzdukál a 2-es típusú cukorbetegség korai stádiumában [42]. Az ER transzmembrán szenzor fehérjék által külön-külön elindított három fő jelátviteli út, beleértve az IRE1, PERK és ATF6 részt vesz az ER stresszben [43]. Ezt követően leütöttük Ire1, Felfrissít és Atf6 sztearinsavval kezelt INS-1 sejtekben siRNS-ekkel, és megállapították, hogy a gátlás Ire1 és Atf6 nem gátolta a miR-34a-5p sztearinsav által kiváltott stimulációját. Az siRNS transzfekciója azonban a Felfrissít csillapított lipotoxicitás és miR-34a-5p szintek sztearinsav kezeléssel. Ezek az eredmények azt mutatják, hogy a miR-34a-5p-t a PERK elősegítheti ER-stressz körülmények között. Azt is felfedeztük, hogy a PERK gátló hatást mutatott a p53 fehérje expressziójára, ami arra utal, hogy a PERK – p53 – miR-34a-5p tengely mechanikusan részt vesz a sztearinsav által kiváltott lipotoxicitásban a béta sejtekben.
Ezenkívül a gyulladásos reakció volt a gyakori reakció a NEFA tartós expozíciója során, ami viszont a lipotoxicitás súlyosbodását eredményezi. A gyulladásos állapotok krónikus expozíciója béta-sejtek diszfunkciójához és apoptózishoz vezet [32, 44, 45]. Egy nemrégiben végzett vizsgálat feltárta, hogy a miR-34a szintje egyidejűleg emelkedett a citokinnal kezelt MIN6 sejtekben és az emberi hasnyálmirigy szigeteiben, és hozzájárult a béta sejtek diszfunkciójához [32]. Ezért azt javasoltuk, hogy a HSD által kiváltott miR-34a-5p növekedés és a további hasnyálmirigy-sérülés valószínűleg fontos gyulladásos válaszutat jelentenek. Ezt a jövőbeni vizsgálatok során tisztázni kell.
Összefoglalva, bizonyítékokat szolgáltatunk arról, hogy a keringő sztearinsav magas szintje súlyos lipotoxicitást vált ki a hasnyálmirigy béta sejtjeiben. Úgy tűnik, hogy a miR-34a-5p uregulációja és a kapcsolódó BCL-2/BCL-W gátlás kritikus szerepet játszik a sztearinsav citotoxicitásának közvetítésében. Eredményeink azt is sugallják, hogy a miR-34a-5p expresszióban a PERK szabályozó szerepet játszik, és hogy a p53 a PERK által indukált miR-34a-5p upreguláció mediátora. Ezek a megállapítások együttesen lehetővé teszik számunkra, hogy javaslatot tegyünk egy új szignál útra, amely a sztearinsavat összeköti a lipotoxicitással a béta sejtekben: sztearinsav – PERK – p53-miR-34a-5p – BCL-2/BCL-W. Ezek az eredmények új betekintést nyújtanak a sztearinsav által kiváltott lipotoxicitásba és a 2-es típusú cukorbetegség progressziójába, ahol a miR-34a-5p csökkentése hatékony stratégia lehet a béta-sejtek lipotoxicitásának javítására.
- A megemelkedett keringő sztearinsav jelentős lipotoxikus hatást eredményez az egér hasnyálmirigy-béta sejtjeiben
- Indukált sejtekből előállított funkcionális hasnyálmirigy béta sejtek differenciálása és transzplantációja
- A magas halolajtartalmú kibővített takarmány hatása a szivárvány növekedésére és zsírsavösszetételére
- Az étrendi takarmány-koncentrátum arány hatása az illékony zsírsav felszívódására és az expresszióra
- Az aszkorbinsav hatása az N-nitrozoprolin kiválasztására a lakto-vegetáriánusok vizeletében és