A metasztázisok és a cachexia kapcsolatának elemzése tüdőrákos betegeknél
Rákgenetikai Intézet, Columbia Egyetem, New York, New York
Ugyanolyan közreműködéssel járult hozzá ehhez a munkáhozIryo Center, London, UKA szerző további cikkeinek keresése
Hematológiai/Onkológiai Osztály, Orvostudományi Tanszék, Columbia Egyetem, New York, New York
Egyenletesen járult hozzá ehhez a munkáhozHematológiai/Onkológiai Osztály, Orvostudományi Tanszék, Missouri Egyetem, Columbia, Missouri
Sebészeti Osztály, Memorial Hospital, Sloan Kettering Memorial Cancer Center, New York, New York
Orvosok és Sebészek Kollégiuma, Columbia Egyetem, New York, New York
Hematológiai/Onkológiai Osztály, Orvostudományi Tanszék, Columbia Egyetem, New York, New York
Orvosok és Sebészek Kollégiuma, Columbia Egyetem, New York, New York
Hematológiai/Onkológiai Osztály, Orvostudományi Tanszék, Columbia Egyetem, New York, New York
Hematológiai/Onkológiai Osztály, Orvostudományi Tanszék, Columbia Egyetem, New York, New York
Biostatisztikai osztály, Tohoku Egyetem Orvostudományi Kar, Sendai, Japán
Juntendo Egyetem Orvostudományi Karának Klinikai Onkológiai Tanszék, Tokió, Japán
Radiológiai Osztály, Columbia University Medical Center, New York, New York
Herbert Irving Átfogó Rákközpont, New York, New York
Hematológiai/Onkológiai Osztály, Orvostudományi Tanszék, Columbia Egyetem, New York, New York
Herbert Irving Átfogó Rákközpont, New York, New York
Biostatisztikai Tanszék, Columbia Egyetem, New York, New York
Biostatisztikai Tanszék, Columbia Egyetem, New York, New York
Anatómiai Patológiai Osztály, Weill Cornell Medical College, New York, New York
Légzőszervi Klinika, Tohoku Egyetemi Kórház, Sendai, Japán
Palliatív Orvosi Osztály, Tohoku Egyetemi Kórház, Sendai, Japán
Montefiore Orvosi Központ/Albert Einstein Orvostudományi Főiskola, New York, New York
Rákgenetikai Intézet, Columbia Egyetem, New York, New York
Herbert Irving Átfogó Rákközpont, New York, New York
Swarnali Acharyya, Rákgenetikai Intézet, Columbia Egyetem, 1130 St. Nicholas Avenue, 402B terem, New York, NY 10032. Tel: +1 212-851-492; Fax: 212-851-5256; E-mail: [email protected]
Rákgenetikai Intézet, Columbia Egyetem, New York, New York
Egyformán közreműködött ebben a munkábanIryo Center, London, Egyesült KirályságA cikk további cikkei kereshetők
Hematológiai/Onkológiai Osztály, Orvostudományi Tanszék, Columbia Egyetem, New York, New York
Egyenletesen járult hozzá ehhez a munkáhozHematológiai/Onkológiai Osztály, Orvostudományi Tanszék, Missouri Egyetem, Columbia, Missouri
Sebészeti Osztály, Memorial Hospital, Sloan Kettering Memorial Cancer Center, New York, New York
Orvosok és Sebészek Kollégiuma, Columbia Egyetem, New York, New York
Hematológiai/Onkológiai Osztály, Orvostudományi Tanszék, Columbia Egyetem, New York, New York
Orvosok és Sebészek Kollégiuma, Columbia Egyetem, New York, New York
Hematológiai/Onkológiai Osztály, Orvostudományi Tanszék, Columbia Egyetem, New York, New York
Hematológiai/Onkológiai Osztály, Orvostudományi Tanszék, Columbia Egyetem, New York, New York
Biostatisztikai osztály, Tohoku Egyetem Orvostudományi Kar, Sendai, Japán
Juntendo Egyetem Orvostudományi Karának Klinikai Onkológiai Tanszék, Tokió, Japán
Radiológiai Osztály, Columbia University Medical Center, New York, New York
Herbert Irving Átfogó Rákközpont, New York, New York
Hematológiai/Onkológiai Osztály, Orvostudományi Tanszék, Columbia Egyetem, New York, New York
Herbert Irving Átfogó Rákközpont, New York, New York
Biostatisztikai Tanszék, Columbia Egyetem, New York, New York
Biostatisztikai Tanszék, Columbia Egyetem, New York, New York
Anatómiai Patológiai Osztály, Weill Cornell Medical College, New York, New York
Légzőszervi Osztály, Tohoku Egyetemi Kórház, Sendai, Japán
Palliatív Orvosi Osztály, Tohoku Egyetemi Kórház, Sendai, Japán
Montefiore Orvosi Központ/Albert Einstein Orvostudományi Főiskola, New York, New York
Rákgenetikai Intézet, Columbia Egyetem, New York, New York
Herbert Irving Átfogó Rákközpont, New York, New York
Swarnali Acharyya, Rákgenetikai Intézet, Columbia Egyetem, 1130 St. Nicholas Avenue, 402B terem, New York, NY 10032. Tel: +1 212-851-492; Fax: 212-851-5256; E-mail: [email protected]
Absztrakt
A súlycsökkenés és a hematogén áttétek rossz prognózistényezők a tüdőrákos betegeknél, amelyek előfordulhatnak, de nem feltétlenül fordulnak elő együtt. Retrospektíven megvizsgáltuk a cachexia, a tumor jellemzői (például metasztatikus terhelés és mutációs státus) és a tüdőrákos betegek kezelésének klinikai összefüggését. Két intézmény (Columbia Egyetem, Amerikai Egyesült Államok és Tohoku Egyetem, Japán) 394 tüdőrákos betegének orvosi dokumentációját tekintették át. Az összegyűjtött információk magukban foglalták a cachexia jelenlétét, a szövettani altípust, a tumor stádiumát, az áttétek számát, a mutáció állapotát, a kezelést és a túlélést. Leíró statisztikákat végeztek. Csak az IV. Stádiumban szenvedő betegeknél> 5% volt a testsúlycsökkenés (0,8%, 2,2%, 3,6% és 5,1% az I – IV. Stádiumban; P = 0,0001). A metasztázisos betegeknél gyakrabban alakult ki cachexia, mint a kezeléstől független metasztázis nélküli betegeknél (6,0% és 7,1% súlycsökkenés metasztázisos betegeknél, szemben 2,5% és 2,0% metasztázis nélküli betegeknél, mielőtt [P = 0,0001] és [utánP
Bevezetés
A cachexia egy komplex metabolikus szindróma, amelyet önkéntelen izomtömeg-veszteség jellemez, akár zsírtömeg-veszteséggel, akár anélkül, és számos krónikus betegséghez kapcsolódik, beleértve a rákot is 1. A rákkal kapcsolatos cachexia diagnosztikai kritériumainak nemzetközi meghatározása 2011-ben jelent meg. Ez az operatív meghatározás a rákos cachexiát úgy jellemezte, hogy a súlycsökkenés az össztömeg 5% -a (BW) volt 6 hónap alatt, a fogyás pedig> 2% az egyéneknél testtömeg-indexével 2. A cachexia diagnosztikai kritériumait nemrégiben frissítették, beépítve a súlycsökkenés százalékának és a testtömeg-index két dimenzióját .
Becslések szerint a cachexia az előrehaladott rákos betegek 80% -át érinti 4. A cachexia leginkább a hasnyálmirigy, a gyomor, a vastagbél, a tüdő, valamint a fej és a nyak rákos megbetegedéseiben fordul elő 5. A rákos cachexia funkcionális károsodással, alacsony kemoterápiás toleranciával, kevesebb tüneti reakcióval és fokozott érzékenységgel jár a fertőzések iránt. A cachexia negatív hatásai gyakran befolyásolják a kezelést, mivel szükségessé teszik a gyógyszer dózisának csökkentését, egyéb késéseket vagy a kezelés leállítását 6. A cachexia jelentős hatással van a beteg életminőségére (QOL), fáradtsággal és depresszióval való összefüggése miatt.
Epidemiológiai vizsgálatok szerint a tüdőrákos betegeknél a súlycsökkenés gyakorisága 55–60%. Mivel azonban a tüdőrákos betegeknél a fogyás nem annyira gyors, mint a hasnyálmirigy- vagy gyomorrákban szenvedőknél, gyakran a betegség végső stádiumáig nem ismerik fel 7, 8. A nem kissejtes tüdőrákban (NSCLC) szenvedő 418 beteg elemzésében úgy gondolták, hogy a fogyás jelenléte gyengébb kezelési eredményekkel jár, ami a csökkent kezelési tolerancia következménye. Egy második vizsgálatban, amely 40, III. Stádiumú NSCLC-s beteget tartalmazott, a cachexiához alacsonyabb QOL és rövidebb túlélés társult 10 .
A metasztázis a rákos sejtek szisztémás elterjedésének és növekedésének folyamata a betegség elsődleges helyétől távoli helyeken 11. Mivel a metasztázisok és a cachexia együtt létezhetnek, tüdőrákos betegek retrospektív vizsgálatában arra törekedtünk, hogy megvizsgáljuk a cachexia és az áttétek kialakulása közötti lehetséges kapcsolatot. Feltételeztük, hogy a rák metasztázisának képessége összefüggésben lehet a cachexia patogenezisével.
Mód
Miután a Columbia Presbyterian Medical Center és a Tohoku Egyetem intézményi felülvizsgálati testületei jóváhagyást kaptak, a Columbia Presbyterian Medical Center és a Tohoku Egyetemi Kórházban 2004 májusa és 2014 májusa között tüdőrák miatt kezelt betegek retrospektív felülvizsgálatát végezték el. A vizsgálatba való belépés kritériumai között szerepelt a tüdőrák patológiás diagnózisa, a klinikai ellátás ezen intézmények egyikében> 3 hónapig és> 3 rögzített súly. A kizárási kritériumok között szerepelt egy másik intézményben végzett kezelés a diagnózis után> 3 hónapig. Demográfiai és klinikai változásokat gyűjtöttünk (lásd az S1 adatot), beleértve a klinikai kísérő betegségek, például az anorexia és a veseelégtelenség jelenlétét, amelyek szintén hozzájárulhatnak a fogyáshoz.
Statisztikai analízis
Diákok t tesztet alkalmaztunk a két csoport minden egyes súlycsökkenési százalékának összehasonlítására a két csoport jellemzői között, mint például a kezelés előtti metasztázis jelenléte, a kezelés utáni metasztázis, az EGFR mutáció, a KRAS mutáció és az anti-EGFR tirozin kináz inhibitor (TKI) terápia. A varianciaanalízist és a Tukey – Kramer őszintén szignifikáns különbségtesztet alkalmazták az egyes súlycsökkenési százalékok összehasonlításához> 3 csoport, például szövettani altípus (adenokarcinóma, laphámsejtes karcinóma, kissejtes karcinóma, egyéb), (I., II., III. Szakasz) között., IV), és kronológiai metasztázis helyének változása (0, 1, 2, ≥3). Az egyes elemzések varianciáinak egyenlőségét Bartlett, Levene, Brown – Forsythe és O'Brien tesztjei igazolták. A túlélési ábrák elkészítéséhez Kaplan – Meier-módszereket, a megfelelő csoportok összehasonlításához pedig a log-rank tesztet alkalmazták. A kockázati arányok (HR) és a 95% -os konfidencia intervallumok (CI) becsléséhez Cox arányos veszély regressziót alkalmaztunk. A statisztikai elemzésekhez JMP szoftvert (11.0 verzió; SAS Institute, Cary, NC) használtunk. Minden esetben kétoldalas P-0,05 értékeket tekintettünk szignifikánsnak.
Eredmények
A cachexia előfordulása metasztázis előtti és utáni kezelésben szenvedő betegeknél
A Columbia-Presbyterian Medical Center-ben kezelt, szövettanilag igazolt tüdőrákos betegek orvosi nyilvántartása (n = 294) vagy a Tohoku Egyetemi Kórház (n = 100) felülvizsgálták. A betegek demográfiai és klinikai jellemzőit az 1. táblázat foglalja össze. Tekintettel a tüdőrák altípusok közötti biológiai különbségekre, megkérdeztük, hogy vannak-e eltérések a cachexia incidenciájában. Nem figyeltünk meg azonban szignifikáns különbséget a fogyásban az adenokarcinóma, a laphámsejtes karcinóma, a kissejtes tüdőrák és más, például a nagysejtes tüdőrák fő szövettani patológiájú altípusaibanP = 0,66; 2. táblázat).
| Kor, medián (tartomány), évek | 68 (27–96) |
| Szex | |
| Férfi | 204. (51.8.) |
| Női | 190 (48,2) |
| Etnikum | |
| fehér | 170 (43.1) |
| ázsiai | 112 (28.4) |
| Spanyol | 61. (15.5.) |
| afro-amerikai | 14. cikk (3.6) |
| Egyéb | 14. cikk (3.6) |
| Nem ismert | 23. cikk (5.8) |
| Színpad | |
| én | 51. (12.9.) |
| II | 53 (13.5) |
| III | 103. (26.1.) |
| IV | 187 (47,5) |
| Szövettani altípus | |
| Adenocarcinoma | 252 (64,0) |
| Laphámsejtes karcinóma | 83. (21.1.) |
| Kissejtes tüdőrák | 48. (12.2.) |
| Egyéb | 11. (2.8) |
| Kemoterápia | 333 (84,5) |
| Első sor | 333 (84,5) |
| Második sor | 142 (36,0) |
| Harmadik vonal és azon túl | 68 (17.3) |
| Sugárkezelés | 237 (60,2) |
| Sebészet | 144 (36.5) |
| Adenocarcinoma | 214 | 8.7 |
| Laphámsejtes karcinóma | 66 | 8.1 |
| Kissejtes tüdőrák | 41 | 10.3 |
| Egyéb | 10. | 6.5 |
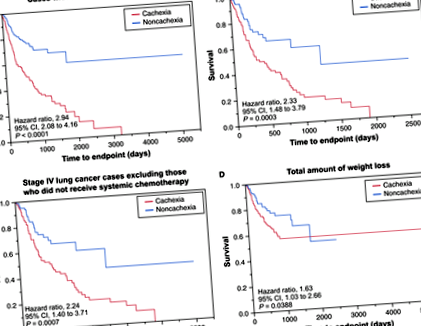
Ezután feltártuk a kachexia gyakorisága közötti összefüggést a betegség különböző stádiumában lévő tüdőrákos betegeknél. Megállapítottuk, hogy csak a IV. Stádiumú tüdőrákban szenvedő betegeknél (vagyis hematogén áttétet szenvedő betegeknél) volt az átlagos testsúlycsökkenési százalék, amely megfelelt a cachexia definíciójának (3. táblázat).
A rákellenes terápiának, például a kemoterápiának, szisztémás hatása van 12, beleértve az étvágycsökkentés, az émelygés, a hányás és a gyomor-bél traktus gyulladásának csökkenését. Ezért elemeztük a kezelés súlycsökkenésre gyakorolt hatását betegcsoportunkban. Először elemeztük az átlagos súlycsökkenést cachexiában szenvedő vagy anélkül szenvedő betegeknél, akár a kezelés előtti, akár az utókezelés során, a metasztázis összefüggésében. Mind a kezelés előtti, mind az utókezelés során a metasztatikus csoport szignifikánsan nagyobb súlycsökkenést ért el,> 5% (3. táblázat).
Ezt követően megvizsgáltuk, hogy a metasztatikus helyek száma vagy az összes tumor térfogata korrelál-e a cachexia gyakoriságával. A súlycsökkenés szignifikánsan különbözött a csoportok között a hematogén áttétek megléte alapján, mindkettő korábban (P = 0,0001) és utána (P
Daganatok mutációs állapota és cachexia előfordulása
| EGFR mutáció | 0,6032 | |
| Igen | 55 | 7.7 |
| Nem | 156 | 8.5 |
| KRAS mutáció | 0,0011 | |
| Igen | 52 | 11.4 |
| Nem | 117. | 6.0 |
| Anti-EGFR TKI terápia az EGFR-mutáns csoportban | 0,3036 | |
| Igen | 22. | 9.4 |
| Nem | 33 | 6.6 |
Vita
A súlycsökkenés előfordulási gyakorisága a tüdőrákos betegeknél 55–60% -ra becsülhető, de a rák szövettani és klinikai jellemzői, valamint a cachexia valószínűsége közötti összefüggéseket rosszul jellemzik. A tüdőrákos betegek klinikai adatainak jelenlegi retrospektív elemzésének négy fő megállapítása van. Először is, a metasztatikus tüdőrákos betegeknél a kezelés előtt és után is magasabb volt a cachexia aránya, mint a metasztatikus betegségben szenvedőknél. Ez a cachexia az előkezelésben vagy a kezelés előtt naiv körülmények között érvel azzal a hipotézissel szemben, miszerint a rákkal társult cachexiát elsősorban a kezelés (pl. Kemoterápia által kiváltott gyomor-bélrendszeri rendellenességek vagy sugárbetegség) okozza, és arra utal, hogy ez valószínűleg a tumor eredendő jellemzője . Másodszor, a metasztázisos betegek kohorszán belül az áttétes megbetegedések nagyobb terhe (a metasztatikus helyek számával mérve) korrelált a cachexia magasabb kockázatával. Harmadszor, a cachexia jelenléte gyengébb túlélést jósolt, függetlenül a kezeléstől. Negyedszer és végül: a mutált KRAS jelenléte a daganatokban korrelált a cachexia valószínűségével.
Az ALK átrendeződés, a MET amplifikáció, a BRAF mutáció, amelyek 3–7% -ot, 2–4% -ot, illetve 1–3% -ot tesznek ki, a tüdőrákban ritkábban fordulnak elő 27. Jövőbeni vizsgálatokra van szükség a KRAS és az EGFR, valamint a cachexia fejlődésén kívüli egyéb genomiális változások társulásának azonosításához. Érdekes, hogy a BRAF V600E és TP53 R248G mutációkat hordozó sejtvonal injekciójából kifejlesztett humán anaplasztikus pajzsmirigyrák kísérleti egérmodellje metasztázisokat és cachexiát egyaránt fejlesztett. Jövőbeni vizsgálatok szükségesek annak megállapítására, hogy a BRAF V600E és a cachexia között van-e hasonló kapcsolat a betegeknél.
Elképzelhető, hogy a rák progressziója különféle mechanizmusokkal hat a vázizmokra. Kísérleti modellekben Waning et al. kimutatta, hogy a csontáttétes daganatok osteolízist indukálnak és a TGF béta felszabadulását okozzák a keringésben 28, 29. A TGF béta intracelluláris kalciumszivárgást és vázizomgyengeséget vált ki. Egyéb oldható tényezők, mint például a daganatos eredetű mellékpajzsmirigy-hormonhoz kapcsolódó fehérje (PTHrP) a tüdőrák modellben közvetítik az energiapazarlást a zsírszövetben, és befolyásolják a vázizom tömegét és erejét 30. Az extracelluláris vezikulák vagy exosomák felszabadulása rákban még egy olyan potenciális mechanizmus, amely összekapcsolhatja az áttétek szisztémás hatásait a vázizmok elvesztésével. Az exoszóma felszabadulása és működése szerepet játszik a rák progressziójának premetasztatikus és metasztatikus állapotában. Ő és mtsai. A 34. ábra megmutatta, hogy a daganatból származó mikrovezikulák hogyan befolyásolhatják a távoli vázizomzatot a vázizomsejtek apoptózisának és az izomtömegvesztés kiváltásával. Jövőbeni kísérleti vizsgálatokra van szükség annak érdekében, hogy mechanikusan meghatározzák az áttétek hozzájárulását a cachexia fejlődéséhez.
Összefoglalva, tüdőrákos betegek retrospektív klinikai elemzése azt sugallja, hogy a metasztázis és a cachexia között van kapcsolat, amely inkább a tumor eredendő jellemzőivel, mintsem a kezeléssel függ össze. Átfogó kutatási célunk egy átfogó diagnosztikai/prediktív platform kidolgozása, amely integrálja a tüdőrák molekuláris és klinikai jellemzőit az áttétképességgel és a rákos cachexia kockázatával. Jelen eredmények megalapozzák a folyamatban lévő vizsgálatokat, és megalapozzák a jövőbeni prospektív és kísérleti tanulmányokat a tüdőrák cachexia további megértéséhez és kezeléséhez.
- A testösszetétel változása nem kissejtes tüdőrákban szenvedő indiai betegeknél
- 5 egészséges szokás, amely segít a tüdőrák kezelésében Johns Hopkins Medicine
- Cachexia; Rák klinikai vizsgálat Pyatigorskban
- A PDC-1421 III. Fázisú vizsgálata a depresszió kezelésére rákos betegeknél - Teljes szöveg nézet
- 5 turmix receptek rákos betegek számára - PCSN