Az miRNA-10a-5p enyhíti az inzulinrezisztenciát és fenntartja a trigliceridek és a bél mikrobiota napi mintázatát a magas zsírtartalmú étrendben táplált egerekben
Yawei Guo
1 Xuanwu Kórház Fővárosi Orvostudományi Egyetem, Peking 100053, Kína
Xiaohui Zhu
1 Xuanwu Kórház Fővárosi Orvostudományi Egyetem, Peking 100053, Kína
Sha Zeng
2 Xiangtan Központi Kórház, Xiangtan 411100, Kína
Mingyi He
1 Xuanwu Kórház Fővárosi Orvostudományi Egyetem, Peking 100053, Kína
Xiurong Xing
1 Xuanwu Kórház Fővárosi Orvostudományi Egyetem, Peking 100053, Kína
Changyuan Wang
1 Xuanwu Kórház Fővárosi Orvostudományi Egyetem, Peking 100053, Kína
Társított adatok
A tanulmány eredményeinek alátámasztására használt adatokat a cikk tartalmazza.
Absztrakt
1. Bemutatkozás
Az elhízás és a 2-es típusú diabetes mellitus spirális aránya világszerte egészségügyi probléma, amely emberek millióit érinti. A túlevés és a csökkent testmozgás az elsődleges oka ennek az aggasztó jelenségnek. Az elhízás, a hiperglikémia és az inzulinrezisztencia kialakulásában bizonyítottan szerepet játszó sok tényező közül a bél mikrobiota fontos szerepet játszik. A hosszú távú magas zsírtartalmú étrend (HFD) bevitele a bél mikrobiota dysbiosisát eredményezheti, és az elhízott alanyokat gyakran alacsony mikrobiális sokféleség és a mikrobiota összetételének károsodása jellemzi [1–3].
A cirkadián ritmus kritikus szerepet játszik a fiziológiai homeosztázis és az egészségi állapot fenntartásában. A cirkadián ritmus megzavarása gyakran összefügg az elhízás, a 2-es típusú cukorbetegség és más metabolikus szindrómák megjelenésével és kialakulásával [4]. A cirkadián rendellenességek rágcsáló modelljeivel végzett korábbi vizsgálatok azt mutatták, hogy a HFD táplálása hátrányosan modulálta a cirkadián szignalizációt, ami kétirányú szabályozásra utal a cirkadián szignalizáció és az étrend között [5]. A kapcsolódó mechanizmusokat azonban tovább kell tisztázni. A közelmúltban kiderült, hogy a bélmikrobiom, amely az étrendi összetétel bevonásának létfontosságú közvetítője, részt vesz a cirkadián ritmus fenntartásában [6]. Fontos, hogy a bél mikrobioma napi ritmust mutat és metabolitjaiban rezgéseket produkál, és ezeket a napi változásokat a HFD bevitele megzavarhatja [6, 7].
A mikroRNS-ek (miRNS-ek), az endogén módon kicsi, nem kódoló RNS-ek 19-25 nukleotidból álló osztálya gátló vagy elősegítő hatást fejthet ki a célgének expressziójára poszttranszkriptíven. Nemrégiben kimutatták, hogy ezek a fontos génszabályozó egységek modulálják a cirkadián mozgásszervi ritmust és a kimeneti utakat [8, 9]. Például a miRNS-276a és a let-7 szabályozhatja a pacemaker gén expresszióját időtlen [10, 11], míg a miRNS-276b a Beadex expresszió visszaszorításával szabályozhatja a cirkadián mozgásszervi ritmust [12]. Továbbá felvetődött, hogy a miRNS-ek képesek modulálni a célbaktériumok génexpresszióját, és elősegíthetik növekedésüket, következésképpen alakítva a bél mikrobiotáját [13]. Ezért feltételezzük, hogy a miRNS-10a, amely ritmikusan expresszálódik és szabályozza a lipid- és glükóz metabolizmusban részt vevő géneket [14], hatással lehet a bél mikrobiotájára és az inzulinérzékenységre. Ebben a tanulmányban azt találtuk, hogy a miRNS-10a-5p enyhíti a HFD által kiváltott elhízást, glükóz intoleranciát és inzulinrezisztenciát. Ezenkívül a miRNS-10a-5p fenntartotta a triglicerid és a bél mikrobiota napi mintázatát, amelyet a HFD bevitele zavart meg.
2. Anyagok és módszerek
2.1. Állatok és kísérleti tervezés
2.2. Intraperitoneális glükóz és inzulin tolerancia teszt
Héthetes kezelés után intraperitoneális glükóz tesztet (IGTT) és inzulin tolerancia tesztet (ITT) végeztek. Az állatoknak intraperitoneálisan injektáltunk 1,0 g glükózt vagy 0,65 U inzulint testtömeg-kilogrammonként hat órás éhgyomorra. Glükóz vagy inzulininjekció után a farokvénából származó vért alkalmazták a glükóz koncentrációjának mérésére 0, 30, 60 és 120 percnél, egy érintéses Ultra Easy glükométer segítségével.
2.3. Gén expressziós elemzés
A teljes RNS-t a májból extraháltuk a korábban leírtak szerint [15]. A cDNS-t SuperScript II (Invitrogen, Shanghai, Kína) alkalmazásával szintetizáltuk. A primereket SYBR Green PCR keverékkel (Invitrogen) kevertük, hogy valós idejű kvantitatív PCR analízissel amplifikáljuk a Clock, Per2 és Cry1 amplifikációt. A génexpresszió eredményeit összehasonlító CT módszerrel számoltuk, amely normalizálta a cél mRNS-t β-aktinná. A primereket a korábban leírt módon [6] és az 1. táblázatban felsoroltak szerint használjuk .
Asztal 1
RT-qPCR alapozók.
| Óra | F: ACCACAGCAACAGCAACAAC |
| R: GGCTGCTGAACTGAAGGAAG | |
| Per2 | F: TGTGCGATGATGATTCGTGA |
| R: GGTGAAGGTACGTTTGGTTTGC | |
| Cry1 | F: CACTGGTTCCGAAAGGGACTC |
| R: CTGAAGCAAAAATCGCCACCT | |
| β-aktin | F: TGTCCACCTTCCAGCAGATGT |
| R: AGCTCAGTAACAGTCCGCCTAGA | |
| De | F: TCAAATCMGGIGACTGGGTWGA |
| R1: TCGATACCGGACATATGCCAKGAG | |
| R2: TCATAACCGCCCATATGCCATGAG | |
| 16 s | F: TCCTACGGGAGGCAGCAGT |
| R: GGACTACCAGGGTATCTAATCCTGTT |
2.4. A glükóz, triglicerid és koleszterin szérumkoncentrációjának meghatározása
A glükózkoncentrációt a kereskedelemben kapható készlettel (Nanjing Jiancheng Bioengineering Institute, Nanjing, Kína) elemeztük, a triglicerid (TG) és a koleszterin (Chol) tartalmát a kereskedelemben kapható készletekkel (Beijing Strong Biotechnologies, Inc. Beijing, Kína) határoztuk meg.
2.5. Mikrobiota profilozás
A vastagbél digesta mintáit használtuk a teljes genom DNS kivonására, és az amplifikációt egy vonalkóddal (16S V3 + V4) ellátott specifikus primer alkalmazásával végeztük. A szekvenáló könyvtárakat előállítottuk és elemeztük a korábban leírtak szerint [16]. Az operatív taxonómiai egységeket (OTU) a mikrobiális közösségek genomiális előrejelzésére végeztük a Tax4Fun elemzéssel, a korábban leírtak szerint [17].
2.6. Az SCFA-koncentrációk meghatározása
Deionizált előhűtött víz hozzáadása után a vastagbél digesta mintáit szakaszosan 2 percig örvénykeverőre tettük. Ezután a mintákat 15 percig 4 ° C-on tartottuk, és 5 percig 5 ° C-on centrifugáltuk 4 ° C-on. A felülúszót a kromatográfiás rendszerbe történő befecskendezéssel határoztuk meg, a korábban leírtak szerint [18].
2.7. Bakteriális génmennyiség meghatározása
A vastagbél digesta mintáit használtuk a butiril-CoA: acetát CoA-transzferáz (But) gén kópiaszámának meghatározására. A géneket standard görbe meghatározásával számszerűsítettük, és primereket használunk a korábban leírtak szerint [6] és az 1. táblázatban felsorolva .
2.8. Statisztikai analízis
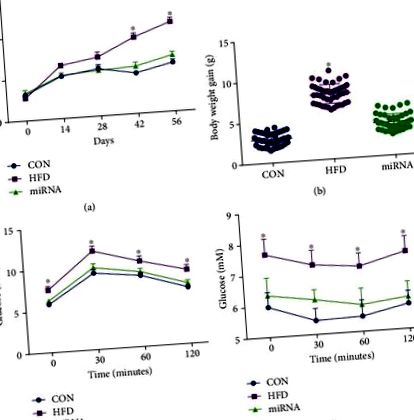
A statisztikai elemzéseket ANOVA alkalmazásával hajtottuk végre, majd Bonferroni analízissel (SPSS 18 szoftver) többszörös összehasonlítást követtünk. Az idősorokhoz többváltozós varianciaanalízist végeztünk Duncan tesztjével. Az adatokat átlag ± SEM formában mutatjuk be. A szignifikanciát P-nél elfogadták. Az 1. ábra (a), a testtömeg szignifikánsan megnőtt a 8 hétig tartó HFD bevitele után, míg a miRNS-10a-5p beadása megakadályozta ezt a változást. A kontroll egerek testtömeg-növekedése a kísérlet során szignifikánsan alacsonyabb volt, mint a HFD-vel táplált egereké, míg a kontroll egerek és a miRNS-10a-5p-vel beadott HFD-vel táplált egerek között nem figyeltünk meg szignifikáns különbséget a testtömegben (1. ábra (b )). Az IGTT (1. ábra (c)) és az ITT (1. ábra (d) ábra) eredményei azt mutatták, hogy a HFD-vel táplált egereknél csökkent a glükóz tolerancia és az inzulinérzékenység, míg a miRNS-10a-5p beadása javította ezeket a paramétereket a HFD-vel táplált egerekben.
A miRNA-10a-5p hatása a testtömeg-gyarapodásra, az IGTT-re és az ITT-re magas zsírtartalmú étrenddel táplált egerekben. a) testtömeg; b) testtömeg-növekedés; (c) intraperitoneális glükóz teszt; d) inzulin tolerancia teszt. Az adatokat átlag ± SEM-ben fejeztük ki. ∗ P 2 (a) - 2 (c), a HFD megváltoztatta a máj órája, a Per2 és a Cry1 mRNS expressziójának cirkadián óramintáját, a korábbi vizsgálatok szerint [6, 7]. A miRNS-10a-5p-vel beadott egerekben az óra, a Per2 és a Cry1 mRNS expressziója napi ritmust mutatott, hasonló a kontroll egerek ritmusához (2. táblázat). Megállapítottuk, hogy a HFD szignifikánsan megemelte az egerek szérumában a glükóz, a trigliceridek és a koleszterinszintet az alacsony zsírtartalmú étrendben lévő egerek szérumában mért értékekhez képest, miközben ezekben a paraméterekben nem volt szignifikáns különbség a kontroll egerek és a HFD-vel táplált egerek között. miRNS-10a-5p-vel beadott egerek (2. (d) - 2 (f) ábrák). A szérum glükózszint azonban csak a kontroll egerekben mutatott ritmusosságot, míg a szérum triglicerid tartalom mind a kontroll egerekben, mind pedig a miRNS-10a-5p-vel beadott HFD-vel táplált egerekben ritmikusságot mutatott (3. táblázat).
3. táblázat
A glükóz és trigliceridek mesor, amplitúdója és akrofázja az egerek szérumában.
| Szőlőcukor | CON | 23.10 | 6.04 | 0,22 | ∗ |
| miRNS | NS | ||||
| Trigliceridek | CON | 22.63 | 2.22 | 0.51 | ∗ NS: nem szignifikáns. |
Annak megállapítására, hogy a szérum trigliceridek ritmusa összefügg-e a máj óragén expressziójával, Pearson-korrelációs elemzést végeztünk a triglicerid szint és a cirkadián óra gén expresszió között. Erős pozitív korrelációt észleltünk a szérum trigliceridtartalom és a máj óra expressziója között kontroll egerekben (r = 0,9078) (2. ábra (g)). Eközben kevésbé pozitív korreláció volt a szérum triglicerid szint és a máj óra expressziója között mind a kontroll egerekben (r = 0,6728) (2. ábra (h)), mind a HFD-vel táplált egerekben, amelyeket miRNS-10a-5p-vel adtunk be (r = 0,7925) ( 2. ábra (i)).
3.3. A miRNS-10a-5p hatása a bél mikrobiota napi ritmusára HFD-vel táplált egerekben
A bél mikrobiota cirkadián ritmusáról és a HFD zavaró hatásáról korábban beszámoltak [6, 19]. Eredményeink azt is megerősítették, hogy a mikrobák három nemzetsége, az Oscillospira, a Ruminococcus és a Lachnospiraceae, napi rezgéseken megy keresztül (4. táblázat; 3. ábra a) - 3 (c). Azonban, amint azt korábban leírtuk [6, 7], a HFD megzavarta a napi ritmusukat. Fontos, hogy a HFD csökkentette a Lachnospiraceae-szaporaságot a ZT0-nál, míg a Ruminococcus-bőséget minden idõpontban növelte. A miRNS-10a-5p beadása fenntartotta a fent említett mikrobák napi ritmusát.
Pearson r-együtthatója pozitív korrelációt jelzett a máj óra expressziója és a Lachnospiraceae relatív bősége között, mind a kontroll egerekben (r = 0,877) (3. ábra (d)), mind a HFD-vel táplált egerekben, amelyeket miRNS-10a-5p-vel adtak be (r = 0,853). (3. ábra (f)). HFD-vel táplált egerekben azonban csak marginális negatív összefüggést figyeltünk meg a máj óra expressziója és a Lachnospiraceae relatív bősége között (r = −0.03935) (3. ábra (e)).
3.4. A miRNS-10a-5p hatása a butiráttartalom és a gén expressziójának napi ritmusára HFD-vel táplált egerekben
Amint a 4. (a) ábra mutatja, a széklet-butirátban megfigyeltük a napi rezgést és a napi ritmus HFD általi megzavarását. A miRNS-10a-5p beadása fenntartotta a butirát szint napi ritmusát. Ezenkívül a miRNS-10a-5p beadása visszaállította a butirát szintézisben részt vevő enzimet kódoló mikrobiális gén, de a mikrobiális gén bőséges expressziójának diurnális oszcillációját a HFD bevitel által okozott zavar után (4. táblázat; 4. ábra (b)).
A miRNS-10a-5p hatása a butirát-tartalom napi ritmusára és a But zsírtartalmú táplálékkal táplált egerekben. a) a butirát viszonylagos bősége a székletben; (b) But relatív kifejezése. Az adatokat átlag ± SEM-ben fejeztük ki. Sing P Singh R. K., Chang H. W., Yan D. és mtsai. Az étrend hatása a bél mikrobiomjára és következményei az emberi egészségre. Journal of Translational Medicine. 2017; 15. cikk (1) bekezdés: 73. doi: 10.1186/s12967-017-1175-y. [PMC ingyenes cikk] [PubMed] [CrossRef] [Google Tudós]
- A tápanyagok szabad teljes szöveges elhízás, inzulinrezisztencia és hiperandrogenizmus közvetítik a kapcsolatot
- Az elhízás és az inzulinrezisztencia csökkent aktivitással jár a
- Életem inzulinrezisztenciával; Jenn receptjei
- A MiR-483-5p az elhízással és az inzulinrezisztenciával társul, és függetlenül az újatól
- Tápanyag-sűrű ételek fogyáshoz és inzulinrezisztenciához - Marty Kendall