A nagyon alacsony fehérjetartalmú étrend az előrehaladott diabéteszes nephropathiát enyhíti az autofágia indukciójával az mTORC1 útvonal elnyomásával Wistar zsíros patkányokban, a 2-es típusú cukorbetegség és az elhízás állatmodelljében.
Absztrakt
Célok/hipotézis
Az alacsony fehérjetartalmú étrend (LPD) hatékonysága a diabéteszes nephropathiánál ellentmondásos. Célul tűztük ki, hogy megvizsgáljuk az LPD renoprotektív hatásait és az alapul szolgáló molekuláris mechanizmust 2-es típusú cukorbetegség és elhízás patkánymodelljében.
Mód
Cukorbeteg férfi Wistar zsíros (fa/fa) patkányokat (WFR) standard táplálékkal (23,84% fehérje) vagy LPD-vel (5,77% fehérje) kezeltünk 20 héten át, 24 hetes kortól. Vizsgáltuk az LPD hatását a veseműködésre, a fibrózisra, a tubuláris sejtkárosodásra, a gyulladásra, a proximális tubuláris sejtek mitokondriális morfológiájára, az apoptózisra, az autofágia és az 1-es rapamicin-komplex emlős célpontjának aktivációjára (mTORC1).
Eredmények
A vese súlya, az albuminuria, a vizeletből származó máj típusú zsírsavmegkötő fehérje kiválasztása, a plazma cystatin C szintje és a vesetisztológia változásai, beleértve a fibrózist, a tubuláris sejtek károsodását és a gyulladást, súlyosbodtak a WFR-ekben a nem diabéteszes Wistar sovány patkányokhoz (WLR-ek) képest ). A PTC-kben felhalmozódott töredezett és duzzadó mitokondriumok és az apoptózis fokozódott a WFR-k veséjében. A p62 és a p-S6 riboszomális fehérje (p-S6RP) immunhisztokémiai festése a WFR-k tubuláris elváltozásaiban megnőtt a WLR-ekhez képest. Az LPD-beavatkozás egyértelműen enyhítette a károsodást, amint azt a vesefunkció és a szövettan felmérése mutatja, különösen a cukorbeteg vesék tubulointerstitialis károsodása. Ezenkívül az 5,77% LPD, de nem a 11,46% LPD, szignifikánsan elnyomta a p-S6RP szintet és megnövelte a mikrotubulusokhoz kapcsolódó fehérje könnyű lánc 3-II szintjét a vesekéregben. Az LPD beavatkozás részben csökkentette a HbA1c szintet a WFR-ekben, és az átlagos BP-ben sem észleltek különbségeket egyik csoportban sem.
Következtetések/értelmezés
A nagyon alacsony fehérjetartalmú étrend javította az előrehaladott diabéteszes vesekárosodásokat, beleértve a tubulointerstitialis károsodást is, azáltal, hogy helyreállította az autofágia mTORC1 útjának elnyomása révén.
Bevezetés
Mód
Anyagok
Az anyagokkal kapcsolatos részletekért olvassa el az elektronikus kiegészítő anyagok (ESM) módszereit.
Kísérleti állatok
Férfi és nő Wistar sovány (fa/ +) patkányokat (WLR) a Takeda Pharmaceutical Company Biological Institute (Oszaka, Japán) [28] bocsátott rendelkezésre, és a Kanazawa Orvosi Egyetemen tartották fenn. Férfi cukorbeteg WFR-eket és életkornak megfelelő nem diabéteszes WLR-eket használtak. 24 hetes korukban a patkányokat négy csoportra osztották: (1) WLR-k standard táplálékkal (STD) táplálták; (2) WLR-k LPD-t tápláltak; (3) WFR-k tápláltak STD-t; és (4) WFR-k LPD-t tápláltak. Az STD 23,84% fehérjét, 16,80% zsírt, 59,36% szénhidrátot és 14,85 kJ/g energiát tartalmazott. Az LPD 5,77% fehérjét, 16,48% zsírt, 77,75% szénhidrátot és 14,81 kJ/g energiát tartalmazott. Az étrendi beavatkozást 20 hétig végeztük. Néhány kísérlethez 11,46% fehérjét, 16,58% zsírt, 71,97% szénhidrátot és 14,81 kJ/g energiát tartalmazó chow-t is használtunk, és néhány WFR-t 30% kalóriatartalmú chow-val etettek a kísérleti időszak alatt.
A Kanazawa Orvostudományi Egyetem Állat-élettudományi Kutatóközpontja jóváhagyta az összes kísérletet, és az összes kísérletet a vonatkozó irányelveknek és előírásoknak megfelelően hajtották végre (további részletekért lásd: ESM-módszerek.).
Biokémiai mérések
A HbA1c szintet DCA 2000 analizátorral (Siemens Medical Solutions Diagnostics, Tokió, Japán) mértük a kísérlet végén. Az intraperitoneális glükóz tolerancia tesztet (IPGTT) és az intraperitonealis inzulin tolerancia tesztet (IPITT) a beavatkozás 20. hetében végeztük el, a korábban leírtak szerint [29]. A vizeletalbumin és a máj típusú zsírsavmegkötő fehérje (L-FABP), a plazma cystatin C, az inzulin és a fibroblaszt 21-es növekedési faktor (FGF21) szintjét ELISA kitek alkalmazásával mértük (lásd ESM módszerek).
Morfológiai elemzés és immunhisztokémia, Western blot elemzés és valós idejű PCR
A vese metszeteket Masson trichrom (MT)/periodikus sav – Schiff (PAS) reagenssel festettük, és immunhisztokémiai festést végeztünk CD68 (1:50), vesekárosodás-1 (KIM-1) molekula (1: 100) elleni antitestekkel. ), p62 (1: 100) és p-S6 riboszomális fehérje (S6RP) (1: 100), a korábban leírtak szerint [28, 30, 31]. (A morfológiai és immunhisztokémiai analízis további részleteit lásd az ESM módszerekben.) Western-blotot hajtottunk végre hasított kaszpáz-3 (1: 1000), β-aktin (1: 1000), p-S6RP (1: 1000) antitestekkel, S6RP (1: 1000), p-Akt (1: 1000), Akt (1: 1000) és a mikrotubulusokkal társított 3-as könnyűlánc fehérje (LC3) -I/II (1: 1000). A teljes RNS izolálását a vesekéregből, cDNS szintézist és kvantitatív valós idejű PCR-t hajtottuk végre, az előzőekben leírtak szerint [28]. A III típusú kollagén, a CD68, az IL-6, a TNF-a, a monocita kemotaktikus protein 1 (MCP-1) és az autópálya-szerű receptor 2 (TLR2) TaqMan szondáit a Thermo Fisher Scientific-től (Waltham, MA, USA) vásároltuk. Az analitikai adatokat belső kontrollként a 18S mRNS expresszió szintjéhez igazítottuk.
Transzmissziós elektronmikroszkópia
A mitokondriális morfológiát és a fragmentált mitokondriumokat a proximális tubuláris sejtekben (PTC) transzmissziós elektronmikroszkóppal figyeltük meg, amint azt korábban leírtuk [28, 32]. (Az elektronmikroszkópos mitokondriális morfológiával kapcsolatos további részletekért lásd az ESM módszereket.)
Autofagosómák monitorozása vese proximális tubuláris sejtekben LC3 – zöld fluoreszcens fehérje transzgenikus egerek alkalmazásával
A hím LC3-zöld fluoreszcens fehérje (GFP) egereket (C57BL/6 háttér) a Riken BioResource Center-től (Ibaraki, Japán) szereztük be. A tizenkét hetes egereket STD-vel vagy magas zsírtartalmú étrenddel (HFD) etették 4 hétig; a HFD-vel táplált egerek egy részét ezután 2 napra LPD-re állítottuk át. 48 órás éhezés után meghatároztuk a PTC-kben az autofágia-t, a korábban leírtak szerint [33].
Statisztikai analízis
Az adatokat átlag ± SD-ként fejezzük ki. Az ANOVA-t, amelyet Tukey többszörös összehasonlító tesztje használt, hogy meghatározzuk a páronkénti különbségek jelentőségét három vagy több csoport között, és a Student t tesztet alkalmaztunk páratlan összehasonlításokhoz. A o értéke
Eredmények
A kísérleti patkányok jellemzői
Változások a vizelet albuminjában és az L-FABP kiválasztásában és a plazma cystatin C-ben
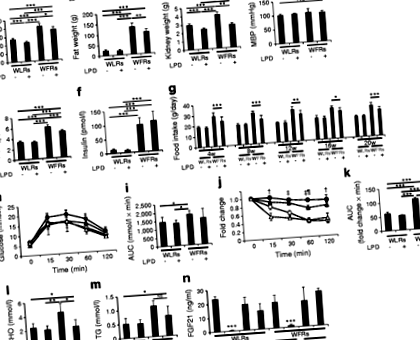
24 hetes korban a vizelet albumin/kreatinin és az L-FABP/kreatinin arány már magasabb volt a WFR-eknél, mint a WLR-eknél (2a., B. Ábra). A vizeletalbumin és az L-FABP kiválasztásának szintje a WFR-ekben jelentősen megnőtt a WLR-ekhez képest a 20 hetes LPD-beavatkozás után (2a., B. Ábra). Az LPD egyértelműen csökkentette a vizeletalbumin és az L-FABP kiválasztási szintjét WFR-ekben, de a 30% -os kalória-korlátozásnak nem volt ugyanaz a hatása (2a., B. Ábra). Ezenkívül a vizelettel végzett L-FABP kiválasztási értékek szignifikánsan javultak a 20 hetes LPD beavatkozás után, összehasonlítva a 24 hetes WFR-ek értékével. Az LPD-beavatkozás után a vizelettel történő albumin kiválasztási értékek azonban közel azonos szinten maradtak, mint a 24 hetes WFR-eknél. A beavatkozás után a plazma cystatin C szintje szintén szignifikánsan magasabb volt a WFR-ekben, mint a WLR-ekben, és az LPD beavatkozás helyreállította ezeket a szinteket a WFR-ekben (2c. Ábra).
Vesefibrózis és tubuláris sejtkárosodás változásai
A teljes vese reprezentatív fényképei és a 24 hetes patkányok MT-vel festett vese metszeteinek mikroszkópos felvételei vesehipertrófiát mutattak WFR-ekben (3a. Ábra). Az MT festéssel és a III típusú kollagén mRNS expressziójával megfigyelt vesefibrózis magasabbnak bizonyult a WFR-k veséiben, mint a WLR-ek ebben az időben (3b – e. Ábra). A PAS festéssel és a KIM-1 immunhisztokémiai festéssel és az mRNS expresszióval értékelt tubuláris sejtkárosodási pontszámok szintén szignifikánsan magasabbak voltak a WFR-ekben, mint a WLR-ekben (3b. Ábra, f – h). A 20 hetes LPD-beavatkozás után a WFR-ek veséi jelentősen nagyobbak voltak, mint a WLR-eké (4a. Ábra), a vesefibrózis és a tubuláris sejtkárosodás következetesen megnőtt a WFR-k veséiben a WLR-ekhez képest (4b-h. Ábra). Az LPD beavatkozás egyértelműen javította ezeket a fejlett vesekárosodásokat a WFR-ben.
A vese gyulladásának változásai
CD68 immunohisztokémiai festési pontszámok tubulointerstitialis elváltozásokban és mRNS expresszióval gyulladással kapcsolatos gének, köztük Cd68, Mcp1 (más néven Ccl2), Tnfa (más néven Tnf) és Tlr2 a vesekéregben már szignifikánsan magasabbak voltak a WFR-ekben, mint a 24 hetes patkányok WLR-jeiben (5a – f. ábra). A 20 hetes kísérleti periódus után vese gyulladás, amelyet a CD68 immunhisztokémiai festés és a Cd68, Mcp1, Tnfa, Tlr2 és Il6, következetesen súlyosbodott a WFR-ek vesekéregében a WLR-ekhez képest (5g – m. ábra). Az LPD-beavatkozás azonban szinte teljesen eltörölte a vese gyulladását a WFR-ekben.
A mitokondriális morfológia változásai a PTC-kben, a glomeruláris bazális membránban és a podocytákban, valamint az apoptózis a vesében
A mitokondriális morfológiát megváltoztatták a WFR-ek PTC-jében: töredezett mitokondriumokat, mitokondriális duzzanatot és megnövekedett számú PTC-ket figyeltek meg hosszúkás mitokondriumok nélkül (6a., B. Ábra). Az LPD javította a mitokondriális morfológia változásait, és autofagosómákat figyeltek meg LPD-vel táplált WFR-ekben (6a. Ábra). A glomeruláris bazális membrán vastagsága jelentősen megnőtt a WFR-ekben, és a WFR-ek glomerulusaiban a podocita lábfejének kiürülését figyelték meg. A glomeruláris bazális membrán és a podocita lábfej folyamatának változásait WFR-ekben LPD kezeléssel korrigáltuk (6c. Ábra). Ezenkívül az apoptózis, amelyet a hasított kaszpáz-3 tartalom határoz meg, megnövekedett a WFR-ek vesekéregében, és az LPD javította az apoptózist a WFR-ekben (6d. E).
Az autofágia és az mTORC1 út aktivációjának változásai a vesében
A p62 immunhisztokémiai festése szignifikánsan fokozódott mind a tubuláris elváltozásokban, mind a WFR-k glomeruláris podocytáiban, és az LPD enyhítette a p62 festési intenzitást a WFR-k veséjében (7a., B. Ábra).
A p-S6RP (az mTORC1 downstream molekulája) immunhisztokémiai festése szintén megnőtt a tubuláris elváltozásokban és a WFR-ek glomeruláris podocytáiban, és az LPD csökkentette a festést a WLR-eknél megfigyelt szinthez hasonló szintre (7a., C. Ábra). A p-S6RP szintje nőtt a WFR-ek vesekéregében a WLR-ekhez képest, de szignifikánsan csökkent, miután az étrendet STD-ről 5,77% LPD-re cserélték már 2 hétig (7d. E). Ezenkívül nem volt különbség a p-Akt fehérje szintekben az STD- és LPD-táplált WFR-ek között (7d. Ábra, f). Az LC3-II szintet az LPD is szignifikánsan növelte, jelezve, hogy az LPD autofágia indukálta a vesekéregben (7d. Ábra, g). A 11,46% -os LPD azonban nem váltotta ki a p-S6RP szuppresszióját vagy az LC3-II szint növekedését a vesékben (7h – j. Ábra).
Ezenkívül a 4 hétig HFD-vel táplált egerek 48 órás éhezés okozta autofágia csökkenését mutatták a PTC-kben, összehasonlítva az STD-vel táplált egerekkel. Ezekben az egerekben azonban a HFD-ről az LPD-re való áttérés 2 napra helyreállította az éhség okozta autofágia PTC-kben. Így az LPD autofágia indukálta az LC3 – GFP transzgénikus egerek PTC-jeit (7k. Ábra).
Vita
Ebben a tanulmányban bebizonyítottuk, hogy az LPD-vel végzett diétás beavatkozás drámai módon javította az előrehaladott diabétesz által kiváltott vesekárosodásokat az autofágia helyreállításával az mTORC1 elnyomásával.
Az LPD befolyásolhatja az anyagcserét, azon az alapon, hogy magas szénhidráttartalmú étrendet képvisel az STD-vel összehasonlítva. Az egereken végzett legújabb vizsgálatok azonban kimutatták, hogy az ad libitum magas szénhidráttartalmú LPD-k javítják a glükóz és a lipid anyagcserét és a hosszú élettartamot [39]. Jelen tanulmányban a testtömeg, a zsírtömeg, a HbA1c és az összkoleszterin szint csökkent az LPD-vel táplált WFR-ekben, összehasonlítva az STD-vel táplált WFR-ekkel. Ezenkívül az FGF21 megnövekedett szintje összefüggésben lehet az LPD által kiváltott metabolikus javulással. Laeger és munkatársai kimutatták, hogy az FGF21 szérumszintje specifikusan emelkedett az LPD-nek való kitettség hatására, a teljes kalóriabeviteltől függetlenül, mind rágcsálókban, mind emberekben [40]. Az FGF21 jótékony hatással van az energia-anyagcserére, például növeli a glükóz felvételét a zsírszövetben és csökkenti a testtömeget a megnövekedett energiafelhasználás révén [41]. Noha az éhomi FGF21 szintekben nem tapasztaltak különbségeket a négy csoport között, a nem éhező FGF21 szintek mind a WLR-ekben, mind az LPD-vel táplált WFR-ekben nem csökkentek; azonban csökkentek WLR-ekben és STD-vel táplált WFR-ekben. Ezért azt javasoljuk, hogy mind az étkezésbevitel csökkentése, mind az FGF21 folyamatosan magas szintje összefüggésbe hozható a vércukorszint, valamint a test- és zsírtömeg csökkenésével a WFR-ekben.
Összefoglalva, ez a tanulmány egyértelműen jelzi, hogy a VLPD egy előnyös étrend-terápia az előrehaladott diabéteszes nephropathia javításában azáltal, hogy helyreállítja az autofágia mTORC1 útjának elnyomásával a 2-es típusú cukorbetegség és elhízás állatmodelljében. Néhány előrehaladott diabéteszes nephropathiában szenvedő beteg gyorsan átjut a végstádiumú vesebetegségbe, annak ellenére, hogy megfelelő multifaktoriális kezelést kapott. Ezért az alultápláltság nélküli VLPD-t tovább kell vizsgálni, mint klinikailag releváns eszközt a vesefunkció csökkenésének elnyomására az előrehaladott diabéteszes nephropathia során. Előfordulhat azonban néhány probléma a VLPD hosszú távú alkalmazásával kapcsolatban, beleértve a szarkopéniát, a gyengeséget vagy a fehérje-energiapazarlást, valamint a VLPD-hez való ragaszkodással kapcsolatos kérdéseket. Az sem ismert, hogy melyik aminosavakat szabad korlátozni a legnagyobb védelem érdekében. Ezért további vizsgálatokra van szükség ezen pontok megoldásához és a VLPD hasznosabb étrendi protokolljainak vagy helyettesítőinek kidolgozásához a diabéteszes nephropathia előrehaladott stádiumaiban.
- Halolajban és leucinban gazdag étrend javítja a hiperkalcémiát a tumor által kiváltott cachecticus egerekben
- A nagyon alacsony fehérjetartalmú étrend akut hatása az FGF23 szintekre Randomizált vizsgálat Amerikai Társaság
- Atkins diéta minta menü - Atkins diéta indukciós menü minta
- 3 napos cukorbeteg étkezési terv a keto diéta kezdetéhez alacsony szénhidráttartalmú Yum
- Szív metabolikus moduláció alacsony szénhidráttartalmú, alacsony fehérjetartalmú ketogén étrenden cukorbeteg patkányokban