A pektinázzal kezelt Panax ginzeng védelmet nyújt a krónikus, időszakos hőstressz okozta herekárosodás ellen azáltal, hogy patkányokban modulálja a hormonális és spermatogenezissel kapcsolatos molekuláris expressziót
Spandana Rajendra Kopalli
1 Élettudományi Tanszék, Orvostudományi és Egészségtudományi Főiskola, Konkuk Egyetem, Csungju, Koreai Köztársaság
Kyu-Min Cha
1 Élettudományi Tanszék, Orvostudományi és Egészségtudományi Főiskola, Konkuk Egyetem, Csungju, Koreai Köztársaság
Sang-Ho Lee
1 Élettudományi Tanszék, Orvostudományi és Egészségtudományi Főiskola, Konkuk Egyetem, Csungju, Koreai Köztársaság
Ji-Hoon Ryu
1 Élettudományi Tanszék, Orvostudományi és Egészségtudományi Főiskola, Konkuk Egyetem, Csungju, Koreai Köztársaság
Seock-Yeon Hwang
2 Biomedical Laboratory Science Tanszék, Alkalmazott Tudományos és Ipari Főiskola, Daejeon Egyetem, Daejeon, Koreai Köztársaság
Min-Sik Jeong
1 Élettudományi Tanszék, Orvostudományi és Egészségtudományi Főiskola, Konkuk Egyetem, Csungju, Koreai Köztársaság
Jong-Hwan Sung
3 Ilhwa Co., Ltd., Ginseng Research Institute, Guri, Koreai Köztársaság
Si-Kwan Kim
1 Élettudományi Tanszék, Orvostudományi és Egészségtudományi Főiskola, Konkuk Egyetem, Csungju, Koreai Köztársaság
Absztrakt
Háttér
A megemelkedett herehőmérséklet megzavarja a spermatogenezist és meddőséget okoz. Jelen tanulmányban az enzimatikusan biotranszformált Panax ginseng Meyer pektináz (GINST) protektív védőhatását vizsgálták patkányokban krónikus, időszakos hőstressz okozta herekárosodás ellen.
Mód
A hím Sprague – Dawley patkányokat (4 hét öreg, 60–70 g) négy csoportba soroltuk: normál kontroll (NC), hő-stressz kontroll (HC), hő-stressz plusz GINST-100 mg/kg (HG100) és hő-stressz plusz GINST-200 mg/kg (HG200) kezelési csoportok. A GINST minden egyes adagját (100 mg/kg és 200 mg/kg) külön-külön összekevertük egy szokásos pellet-étrenddel, és orálisan adtuk 24 hétig. A hőstressz kiváltásához az NC csoportban lévő patkányokat 25 ° C-on tartottuk, míg a HC, HG100 és HG200 csoportokban lévő patkányokat 32 ± 1 ° C hőmérsékleten tettük ki naponta 2 órán át 6 hónapig. A 25. héten az egyes állatok heréit és szérumát elemezték különböző paraméterek szempontjából.
Eredmények
Jelentős (p Kulcsszavak: hőstressz, meddőség, Panax ginseng, reaktív oxigénfajok, spermatogenezis
1. Bemutatkozás
A testhőmérséklet szabályozása kritikus fontosságú a különféle szervek optimális működésének biztosításához, az egyes folyamatokhoz kapcsolódó molekuláris és sejtes mechanizmusoktól függően [1], [2] A megemelkedett herehőmérséklet megzavarja a spermatogenezist és meddőséget okoz [3], [4]. Patkányokon, egereken és majmokon végzett kiterjedt preklinikai vizsgálatok azt mutatják, hogy az enyhe here hőhatás (43 ° C 15 percig) a spermium termelésének jelentős csökkenését, az oxidatív károsodást és a különböző jelátviteli utak aktiválódását idézi elő. A hipertermia káros hatása a normális felnőtt herére emberben jól ismert [5], [6]. A megemelkedett hőmérséklet egyre inkább elterjed a modern életmód és a foglalkozással kapcsolatos veszélyek miatt. Ezek a tényezők különösen befolyásolhatják a spermiumtermelést és hozzájárulhatnak a férfiak meddőségéhez [7], [8].
A herék hőstressze a csíra sejtek, a Leydig sejtek és valószínűleg a Sertoli sejtek oxidatív károsodásával jár [9]. A szabad gyökök és a reaktív oxigénfajok (ROS) termelése, beleértve a szuperoxid-aniont és a hidrogén-peroxidot, pozitív változásokat indukálhat a spermiumok működésében, például hiperaktiválást, kapacitást és akroszóma-reakciót [10], [11]. A ROS túltermelése azonban káros lehet a spermiumokra, és férfi meddőséghez vezethet. A spermiumok nagyon érzékenyek a ROS által kiváltott károsodásokra [12]. Mivel mind a spermatogenezis, mind a Leydig sejtek szteroidogenezise érzékeny az oxidatív stresszre, a peroxidatív károsodást tekintik a herék károsodásának legfontosabb okának. A megemelkedett testhőmérséklet negatívan megváltoztatja az anyagcsere funkciót, ezáltal fokozza a ROS képződését, ami súlyos oxidatív stresszhez vezet [13]. Az oxidatív stressz a ROS termelés és az antioxidáns védekező rendszerek egyensúlyának megzavarása után következik be [14]. Ezért a sperma minőségének biztosítása érdekében fontos megelőzni az egész test hőhatását.
2. Anyagok és módszerek
2.1. GINST előkészítés és nagy teljesítményű folyadékkromatográfia elemzés
2.2. Kísérleti állatok
Hím Sprague – Dawley patkányokat (összesen 40, 4 hét öreg, 60–70 g) a Samtako Bio Korea, Inc.-től (Osan, Korea) vásároltunk, és a kísérlet előtt 1 hétig az állatkezelő létesítményhez igazítottuk őket. Standard pellet-étrendet biztosítottak számukra, és állandó hőmérsékleten (23 ± 2 ° C) és relatív páratartalomban (55 ± 5%) tartották 12/12-órás világos/sötét ciklusban, étkezéshez és vízhez ad libitum hozzáféréssel . A patkányokat a Regionális Innovációs Központ kísérleti állattartó létesítményében, a koreai Konkuk Egyetemen tartották fenn, az Intézményi Állattenyésztési és Felhasználási Bizottság irányelveinek megfelelően. A vizsgálatot az Állatetikai Bizottság (engedélyszám: KU12052) hagyta jóvá a koreai kísérleti állatvédelmi törvény 14. cikkével összhangban.
2.3. Kísérleti terv
2.4. A szérum biokémiai paramétereinek mérése
A vért a hasi vénából vettük, és egy SST gél & alvadék aktivátor csőbe gyűjtöttük (Becton és Dickinson, Franklin Lakes, NJ, USA). A szérumot 1500 g-vel 10 percig szobahőmérsékleten végzett centrifugálással választottuk el. A szérum biokémiai paraméterei, például a szérum glutaminos oxoecetsav-transzamináz (GOT), a glutamikus piruvikus transzamináz (GPT), az albuminkoncentráció (ALB), a szérum összes koleszterinszintje (T-CHO), alacsony sűrűségű lipoprotein-koleszterin (LDL-C), triglicerid (TG) ) és a glükózt (GLU) elemeztük a megfelelő kereskedelemben kapható készleteikkel (Diagnostic Product Corporation, Los Angeles, CA, USA).
2.5. A spermium kinematikai értékeinek mérése
A spermiummintákat ollóval felvágva kivontuk a bal farok epididymából; egy csepp farokfolyadékot azonnal tenyésztőedénybe tettünk, amely 5 ml Hank 37 ° C-ra előmelegített, kiegyensúlyozott sóoldatát tartalmazta, és 10 mg/ml BSA-val (szarvasmarha szérum albumin) egészítettük ki. 5 percig 37 ° C-on végzett inkubálás után a szuszpenzió alikvot részét mikropipettával összegyűjtöttük, és 40 ± 10 spermiumot tartalmazó hígításra hígítottuk a meghatározott mikroszkopikus mező alatt (× 100 nagyítás). Ezután a szuszpenziót (10 μL) hozzáadtuk egy 2X-CEL tárgylemezhez (mélység: 80 μm, vastagság: 0,15 mm; Hamilton Thorne Res., Beverley, MA, USA), amelyet előmelegítettünk egy CO2 inkubátorban (Sanyo Electric Co., Oszaka, Japán) 37 ° C-on. A spermiumok mozgékonyságát számítógéppel segített spermium-analizátorral (CASA; Hamilton Thorne Res.) Rögzítettük, × 4-es objektívvel és töltéssel összekapcsolt eszközkamerával. Minden mintában legalább 200 spermiumot figyeltek meg a motilitási mintázat elemzéséhez.
2.6. Western blot elemzés
Az egyes mintákból azonos mennyiségű herefehérjét 10% -os nátrium-dodecil-szulfát-poliakrilamid-gélelektroforézissel elválasztottunk, és egy polivinilidén-fluorid-membránra vezettünk (Millipore, Billerica, MA, USA). Mindegyik membránt 1 órán át Tris-pufferolt sóoldatban inkubáltuk, amely 0,1% Tween-20 és 5% sovány tejet tartalmazott, hogy blokkolja a nem specifikus antitestkötést. A membránokat ezután specifikus primer antitestekkel inkubáltuk (1: 2 000 hígítás; Santa Cruz Biotech, Santa Cruz, Kalifornia, USA). Béta-aktint használtunk belső kontrollként. Mindegyik fehérjét torma-peroxidázzal konjugált másodlagos antitestek és kemilumineszcencia-detektáló rendszer segítségével detektáltuk (GE Healthcare Life Sciences, Little Chalfont, Egyesült Királyság).
2.7. RNS izolálás és valós idejű reverz transzkripciós polimeráz láncreakció
Az in vivo elemzéshez az összes RNS-t a hereszövetből az RNS-Bee reagens felhasználásával extraháltuk a gyártó utasításai szerint, és az RNS-t (1 μg) reverz átírással írtuk le a korábban leírt eljárások szerint [26]. Az alkalmazott primereket az 1. táblázat tartalmazza. A polimeráz láncreakciót (PCR) 30 ciklus alatt végeztük 95 ° C-on 40 másodpercig, 56 ° C-on 40 másodpercig, és 72 ° C-on 40 másodpercig. Az amplifikáció után a PCR termékeket elektroforézissel elválasztottuk 2,0% -os etidium-bromidot tartalmazó agarózgélen, és a sávokat ultraibolya fluoreszcenciával tettük láthatóvá. A sávok intenzitását az ImageJ szoftvercsomaggal elemeztük (1.410 verzió; National Institutes of Health, Bethesda, MA, USA).
Asztal 1
A vizsgálatban használt alapozók
| Peroxiredoxin (PRx) 4 | Előre: 5′-CTG ACT GAC TAT CGT GGG AAA TAC T-3 ′ |
| Hátlap: 5′-GAT CTG GGA TTA TTG TTT CAC TAC C-3 ′ | |
| Glutation-S-transzferáz (GST) m5 | Előre: 5′-TAT GCT CCT GGA GTT TAC TGA TAC C-3 ′ |
| Hátlap: 5′-AGA CGT CAT AAG TGA GAA AAT CCA C-3 ′ | |
| Glutation-peroxidáz (GPx) 4 | Előre: 5′-GCA AAA CCG ACG TAA ACT ACA CT-3 ′ |
| Hátlap: 5′-CGT TCT TAT CAA TGA GAA ACT TGG T-3 ′ | |
| Inhibin-a | Előre: 5′-AGG AAG GCC TCT TCA CTT ATG TAT T-3 ′ |
| Hátlap: 5′-CTC TTG GAA GGA GAT ATT GAG AGC-3 ′ | |
| Androgén receptor (AR) | Előre: 5′-CTG GAC TAC CTG GAT CTC TA-3 ′ |
| Hátlap: 5′-CCT GGG CTG TAG TTT TAT TG-3 ′ | |
| Follikulus-stimuláló hormon receptor (FSHR) | Előre: 5′-GGA CTG AGT TTT GAA AGT GT-3 ′ |
| Hátlap: 5′-TTC CAT AAC TGG GTT CAT CA-3 ′ | |
| Luteinizáló hormon receptor (LHR) | Előre: 5′-CTA TCT CCC TGT CAA AGT AA-3 ′ |
| Hátlap: 5′-TTT GTA CTT CTT CAA ATC CA-3 ′ | |
| Nektin-2 | Előre: 5′-AGT GAC CTG GCT CAG AGT CA-3 ′ |
| Hátlap: 5′-TAG GTA CCA GTT GTC ATC AT-3 ′ | |
| Gliceraldehid-3-foszfát-dehidrogenáz (GAPDH) | Előre: 5′-AAC TTT GGC ATT GTG GAA GGG C-3 ′ |
| Hátlap: 5′-ACA CAT TGG GGG TAG GAA CAC G-3 ′ | |
| cAMP-reszponzív elem-kötő fehérje 1 (CREB-1) | Előre: 5′-ACT GGC TTG GCA CAA CCA GA-3 ′ |
| Hátlap: 5′-GGC AGA AGT CTC TTC ATG ATT-3 ′ |
2.8. Statisztikai analízis
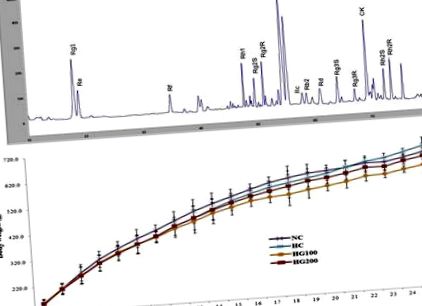
Az adatokat átlag ± szórásként fejezzük ki. A szignifikanciát Student t teszttel elemeztük két csoport összehasonlítására, és többszörös variancia-elemzésre a GraphPad Prism 4.0 verziójával (Graph Pad Software, San Diego, CA, USA). A p érték 1. ábra A. Korábban megfigyeltük, hogy a pektináz-kezelés során a fő szaponin-csúcsok, beleértve az Rg1, Rg2 R, Rb1, Rb2 és Rd ginsenozidokat a P. ginseng kivonatban, jelentősen csökkentek [26]. Korábbi adatainkkal összhangban a GINST-ben a ginsenozidokkal kapcsolatos csúcsok csökkentek a jelen tanulmányban használt tételben. Továbbá megnövekedett csúcsot figyeltek meg magasabb CK koncentrációk mellett. A GINST ginsenozidtartalma száraz tömegre vonatkoztatva a következő volt: Rg1 (46,72 mg/g), Re (18,66 mg/g), Rf (62,18 mg/g), Rh1 (33,68 mg/g), Rg2S sztereoizomer (10,02 mg/g), Rg2 R sztereoizomer (10,34 mg/g), Rc (53,49), Rb1 (18,99 mg/g), Rb2 (79,98 mg/g), Rd (103,77 mg/g), Rg3S (21,65) mg/g), Rg3 R (28,85 mg/g), CK (280,48 mg/g), Rh2S sztereoizomerek (35,68 mg/g) és Rh2R (53,94 mg/g).
A GINST HPLC ujjlenyomat-elemzése és a GINST hatása a testtömeg növekedésére hőstressz patkányokban. (A) HPLC-kromatogram. (B) Az NC, HC, HG100 és HG200 csoportok teljes testtömege az 1. és 25. hét között látható. Minden pont az átlagot jelenti (n = 10). testtömeg; GINST, pektinázzal kezelt Panax ginseng kivonat; NC, normál vezérlés; HC, hő-stressz szabályozás; HG100, hőterhelés és GINST 100 mg/ttkg; HG200, hőfeszültség és GINST 200 mg/ttkg; HPLC, nagy teljesítményű folyadékkromatográfia.
3.2. A GINST hatása a testtömeg növekedésére és a szerv súlyára hőstressz patkányokban
Amint az az 1. B ábrán látható, kisebb különbségeket figyeltek meg a testtömeg-növekedésben a csoportok között, de ezek az eltérések statisztikailag nem voltak szignifikánsak. Az NC csoport végső testtömege a 24. héten 624,8 ± 46,5 g, HC esetében 646,3 ± 59,3 g, HG100 esetében 598,3 ± 49,6 g, HG200 esetében pedig 610,4 ± 36,8 g. Valamennyi állat túlélte a kísérleti időszakot, és a vizsgálat folyamán nem figyeltek meg rendellenes viselkedést az NC, a HC és a HG100- és a HG200-csoporttal kezelt csoportokban.
Az adatokat átlag ± SEM-ben fejezzük ki (n = 10). A statisztikai elemzést Student t teszttel és egyirányú ANOVA-val hajtottuk végre, a GraphPad Prism 4.0 verziót használva.
- A tápanyagoktól mentes, teljes szövegű Panax ginzeng levélkivonatok elhízás elleni hatást fejtenek ki magas zsírtartalmú
- A táplálkozás időszakos éhomi anyagcsere-hatásai
- Megjegyzés Krónikus húgyúti fertőzés Candida utilis miatt
- A vékonybél baktériumok elszaporodása a krónikus hasnyálmirigy-gyulladásban szenvedő betegek körében
- Oxalate A krónikus fájdalom és a diszkomfort felismerhetetlen oka; Táplálkozási Gyógyító Központ