A prenatális alacsony fehérjetartalmú és karbenoxolon-expozíció nemspecifikus hatásai a vese angiotenzin-receptor expressziójára patkányokban
Absztrakt
A környezeti és életmódbeli tényezők sokasága kölcsönhatásba lép az uralkodó genotípussal, hogy meghatározza az egyén hipertónia kialakulásának kockázatát. 1 Az elmúlt évtizedben azonban nyilvánvalóvá vált, hogy a korai fejlesztés során tapasztalt környezet is jelentős hatást gyakorol. Emberi epidemiológiai vizsgálatok összefüggést mutattak a magzati növekedés paraméterei és a magas vérnyomás, 2, 3 vesebetegség, 4, 5 és a szívkoszorúér-betegség kialakulásának kockázata között. 6, 7 Ezeket a megfigyelési vizsgálatokat számos olyan kísérleti modell alátámasztja, amelyekben a kardiovaszkuláris és a vese rendszer rendkívül érzékenynek bizonyult az anyai táplálkozás viszonylag enyhe elmozdulására. 8 Ezek a kísérleti modellek most hasznos eszközt nyújtanak a pontos mechanizmusok vizsgálatához.
A renin-angiotenzin rendszer (RAS) megzavarása szerepet játszik a vérnyomás táplálkozási programozásában. Az RAS a vérnyomás elsődleges szabályozója, az érrendszeri tónusra és a folyadék homeosztázisára gyakorolt hatása révén, 9 és kritikus a normális vesefejlődés szempontjából is. Ennek a rendszernek a zavara tehát a felnőttek vérnyomás-szabályozását közvetlenül, a RAS aktivitásának hosszú távú megváltoztatásával, és közvetett módon, a vesefejlődés és az azt követő funkciók zavarásával is modulálhatja. Anyák alacsony fehérjetartalmú étrendjének (MLP) táplálása patkányoknál a terhesség alatt elnyomja a magzati intrarenalis RAS 12 aktivitását, és összefüggésben van a csökkent 13 nefron-komplementtel és az utódok gyorsított előrehaladásával a glomerulosclerosis 14 felé. Ezzel szemben a RAS-t a posztnatális életben az MLP utódaiban szabályozzák, 15 beleértve az 1-es típusú angiotenzin-receptor (AT1R) mind a szabályozását, amely közvetíti az Ang II, 16, 17-re adott klasszikus nyomóválaszokat, valamint a 2-es típusú ellenszabályozó receptor alacsony szintű szabályozását ( AT2R). 18 - 20 Ezeknek a változásoknak megfelelően fokozott angiotenzin II (Ang II) érzékenységet figyeltek meg MLP utódoknál 4 és 7 hetes korban. 18, 19
Mód
Állatok
Az összes állati eljárást az 1986-os Animals (Scientific Procedures) törvénynek megfelelően hajtottuk végre. Harminchárom szűz nőstény Wistar patkányt (Harlan Ltd, Leicestershire, Egyesült Királyság) pároztunk 250 és 300 g közötti tömegben. A párzást megerősítve a patkányokat a három kezelési csoport egyikébe osztottuk: kontroll (n = 11), alacsony fehérjetartalmú (MLP, n = 10) és karbenoxolon (CBX, n = 12). A kontroll patkányokat 18% fehérjét (180 g kazein/kg) tartalmazó étrenddel etették, az MLP patkányokat pedig 9% fehérjét (90 g kazein/kg) tartalmazó étrendet etették. A diéták teljes összetételét máshol teszik közzé. 28 CBX patkányt is tápláltunk a kontroll étrenddel, de az SC-be CBX-t (12,5 mg/kg) injektáltunk a terhesség utolsó 7 napján. A CBX gátolja a 11β-HSD-t, növelve a glükokortikoidok átjutását a placentán. A CBX-et olyan dózisban adták be, amelyről kiderült, hogy nincs káros hatása a reproduktív eredményre. 29 Kontroll és MLP patkányoknak ugyanabban az időszakban injekciós hordozót (sóoldatot) injektáltunk.
Születéskor (~ 22 nap) az összes állatot standard laboratóriumi étrendbe helyezték (B&K Universal Ltd), és az almokat legfeljebb 8 kölyökre selejtezték a szoptató táplálék variációinak minimalizálása érdekében. 2 és 4 hetes kor között a 3 kezelési csoportot további részekre osztották fel, az egyes prenatális kezelések aljainak felét az ivóvízen keresztül L158-809-nek adták, amely egy specifikus AT1R-gátló (amelyet Merck Sharpe és Dohme adományozott). Az L158-809-et alacsonyabb dózisban (25 mg/ml) adták be, mint az elődjével, a lozartánnal (100 mg/l 30) korábban használták, a farmakológiai vizsgálatok magasabb bizonyítékai miatt. 31 Az összes almot 3 hetes korban választották el. Négy hetes korukban minden alom felét (2 hím és 2 nő, ahol lehetséges) CO2-asfixia, majd méhnyak-diszlokáció ölte meg, és veséiket kivágták. A jobb vesét az RT-PCR előtt –80 ° C-on történő tárolás előtt folyékony N2-ben lefagyasztottuk, a bal vesét pufferelt formalinban rögzítettük a nephronszámlálás előtt. Az állatok maradékát egynemű csoportokban helyeztük el, és 20 hetesen, ugyanazokkal az eljárásokkal leöltük őket.
Nephron-szám
A nefronszámot macerációs módszerrel határoztuk meg, az előzőekben leírtak szerint. Minden vesénél 32 háromszoros alikvot részeket számláltunk. A variációs együttható 2,6%.
Angiotenzin-receptor mRNS-expresszió
A teljes RNS-t izolált fagyasztott vesékből izoláltuk TRIzol eljárással (Invitrogen). Az RNS-t DNázzal (Promega) kezeltük, majd fenol-kloroform extrakciónak és etanolos kicsapásnak vetettük alá. Az összes RNS-t (0,5 μg) reverz átírással írtuk le Moloney egér leukémia vírus reverz transzkriptáz (Promega) alkalmazásával. A valós idejű PCR-t egy ABI prism 7700 szekvencia detektáló rendszer (Applied Biosystems) alkalmazásával hajtottuk végre. Az AT1AR-ra, az AT1BR-re, az AT2R-re és a háztartási gén-β-aktinra specifikus sablon-specifikus primerpárt és egy oligonukleotid-szondát (σ-Genosys) terveztünk a Primer Express 1.5-ös verziójával (Applied Biosystems). A láncindítók és a próbák teljes szekvenciáit máshol publikálják. 20 Minden PCR-futtatáshoz negatív templátkontrollt, relatív standard görbét (összesített minta DNS-ből készítettünk) és minőségellenőrzést adtunk. Az összes mintát β-aktin expresszióra normalizáltuk.
Statisztikai analízis
ASZTAL 1
Az anya súlya párzáskor, az anya súlygyarapodása terhesség alatt, az alom száma, valamint a teljes és az átlagos születési súly a kontroll, az MLP és a CBX kezelési csoportokban
| Anya súlya párzáskor (g) | 261,8 ± 8,76 | 273,7 ± 7,5 | 267,4 ± 9,5 |
| Anya súlygyarapodása (g) | 168,6 ± 6,5 | 154,0 ± 10,4 | 158,0 ± 5,1 |
| Teljes születési súly (g) | 79,7 ± 4,7 | 73,6 ± 5,1 | 78,6 ± 2,7 |
| Átlagos születési súly (g) | 5,85 ± 0,20 | 5,77 ± 0,16 | 5,43 ± 0,13 |
| Sz. Alom. | 13,7 ± 1,3 | 12,9 ± 1,0 | 14,5 ± 0,5 |
Az anya párzási súlya és a terhesség alatti súlygyarapodás nem különbözött a prenatális kezelési csoportok között. Az alom méretét, a teljes alom súlyát és az átlagos születési súlyt szintén nem befolyásolta a prenatális kezelés.
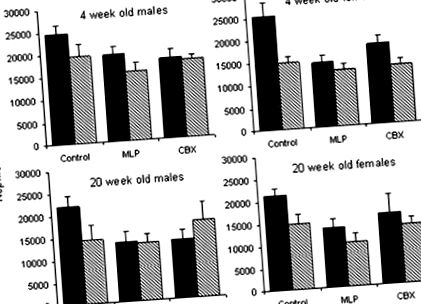
Test és vese súlya (2. táblázat)
2. TÁBLÁZAT
Testtömeg és vese súlya 4 és 20 hetes patkányokban a kontroll, MLP vagy CBX csoportokból L158-809 kezeléssel vagy anélkül a korai posztnatális életben
| 4 hét | n = 48 | n = 46 | n = 47 | n = 47 | n = 40 | n = 47 | |||||
| Testtömeg (g) | M | 103,5 ± 2,3 | 100,4 ± 4,4 | 95,4 ± 2,7 | 90,7 ± 2,4 | 108,6 ± 3,1 | 81,9 ± 2,3 | 0,000 | 0,000 | 0,000 | 0,000 |
| F | 94,5 ± 1,4 | 92,9 ± 3,3 | 91,0 ± 5,2 | 90,7 ± 2,4 | 97,6 ± 2,8 | 74,1 ± 1,7 | |||||
| Vese súlya (g) | M | 0,60 ± 0,02 | 0,56 ± 0,03 | 0,57 ± 0,03 | 0,49 ± 0,02 | 0,68 ± 0,02 | 0,48 ± 0,03 | NS | 0,000 | NS | NS |
| F | 0,56 ± 0,02 | 0,52 ± 0,02 | 0,52 ± 0,02 | 0,48 ± 0,02 | 0,60 ± 0,03 | 0,43 ± 0,03 | |||||
| 20 hét | n = 23 | n = 23 | n = 23 | n = 23 | n = 20 | n = 22 | |||||
| Testtömeg (g) | M | 587,9 ± 20,4 | 527,5 ± 28,4 | 542,3 ± 12,8 | 540,3 ± 18,0 | 561,3 ± 14,8 | 527,5 ± 17,4 | NS | 0,006 | 0,000 | NS |
| F | 310,5 ± 6,4 | 295,3 ± 5,9 | 289,6 ± 3,8 | 299,0 ± 7,0 | 320,8 ± 11,2 | 284,6 ± 7,9 | |||||
| Vese súlya (g) | M | 2,07 ± 0,10 | 2,06 ± 0,06 | 1,91 ± 0,03 | 1,97 ± 0,09 | 2,02 ± 0,05 | 2,10 ± 0,09 | NS | 0,020 | 0,000 | NS |
| F | 1,16 ± 0,03 | 1,126 ± 0,02 | 1,07 ± 0,02 | 1,16 ± 0,03 | 1,18 ± 0,05 | 1,10 ± 0,04 |
Korábban nem mutattunk változást az AT1AR vagy az AT1BR mRNS expressziójában 4 hetes MLP utódokban annak ellenére, hogy mások a fehérje expressziójának upregulációját mutatták, 17, 19 kezdetben csak a transzkripció utáni szinten sugallja az interferenciát. Azonban a vese-minták előzetes fehérje-elemzése az MLP-modellünkből azt mutatja, hogy a fehérje expresszió sem növekszik (N. Ashton, S. McMullen és S. C. Langley-Evans, publikálatlan megfigyelések, 2004). A jelenlegi tanulmány az alacsony fehérjetartalmú étrend általános csökkentő hatását mutatja az AT1AR mRNS expressziójára a 2 időpontban. Ez a tanulmány az előzőnknél nagyobb számú állatot használt fel az eredmények 2 postnatalis időpontban történő értékelésére, és ezért nagyobb erővel volt képes meghatározni azokat a fő hatásokat, amelyek nem voltak kölcsönhatásban az életkorral. Ez valószínűleg megmagyarázza, miért nem bizonyult szignifikánsnak az AT1AR mRNS expressziójának kicsi csökkenése a 4 hetes utódokra korlátozódó vizsgálatokban. Ennek és az eddigi 18, 20 vizsgálatainknak az AT1AR utregulációjának hiánya az MLP utódaiban hosszú távon nem támasztja alá ezt a mechanizmust, mint hipertóniájuk kiváltó okát.
Perspektívák
Köszönetnyilvánítás
Ezt a tanulmányt a British Heart Foundation és az Európai Unió EARNEST projektje finanszírozta. A szerzők elismerik Richard Plant technikai segítségét.
- Prenatális diethylstilbestrol expozíció és az elhízás kockázata felnőtt nőknél
- Prenatális kitettség perzisztens szerves szennyező anyagoknak és a gyermekek túlsúlyosságának 5 éves követéskor
- A vizeletkoncentrációs folyamat szerepe a magas fehérjebevitel vesehatásaiban -
- A krónikus kannabisz-dohányzó cukorbetegség anyagcsere-hatásai
- Csipkerózsika-diéta A nők nyugtatókat alkalmaznak a fogyáshoz, és veszélyes mellékhatásokat kockáztatnak