Prenatális kitettség perzisztens szerves szennyező anyagoknak és a gyermekek túlsúlyának/elhízásának 5 éves nyomon követéskor: prospektív kohortvizsgálat
Absztrakt
Háttér
Prenatális perzisztens szerves szennyező anyagok (POP) expozíció befolyásolhatja az utódok súlygyarapodását. További prospektív epidemiológiai vizsgálatokra van szükség az állatkísérletek egyre növekvő bizonyítékainak kiegészítéséhez.
Mód
Egy skandináv prospektív kohorsz vizsgálatban részt vevő 412 terhes norvég és svéd nő szérumát gyűjtötték össze 1986–88-ban, és két perfluor-alkil-anyagot (PFAS) és öt szerves klórt (OC) elemeztek. Lineáris és logisztikus regressziós modelleket használtunk 95% konfidencia intervallummal (CI) az anyai szérum POP-koncentrációinak a terhesség 17–20 hete és a gyermek túlsúlya/elhízása (testtömeg-index (BMI) ≥ 85. percentilis) közötti összefüggések értékelésére 5- évi utókövetés. Az eredményeket országonként tovább rétegeztük a hatásmódosítás tesztelése után. Felmértük a lehetséges nem monoton dózis-válasz (NMDR) összefüggéseket is.
Eredmények
Korrigált lineáris modellekben a megnövekedett BMI-értékeket figyeltük meg az életkor és a nemek szerint (β = 0,18, 95% CI: 0,01–0,35), és a tricepsz megnövekedett z-pontszámát (β = 0,15, 95% CI: 0,02–0,27) gyermekeknél, az anyai szérum perfluoroktán-szulfonát (PFOS) koncentrációjának növekedése után 5 éves követés után, egységnyi egységenként. Megfigyeltük a gyermek túlsúlya/elhízása (BMI ≥ 85. percentilis) valószínűségét az anya szérum PFOS-szintjének minden egyes egységnyi növekedésére (korrigált VAGY: 2,04, 95% CI: 1,11–3,74), a norvég gyermekek körében erősebb az esély (OR: 2,96, 95% CI: 1,42–6,15). Hasonló összefüggéseket találtunk az anyai szérum perfluoro-oktanoát (PFOA) koncentrációja és a gyermek túlsúlya/elhízása között. A PFOS és a poliklórozott bifenil (PCB) 153, valamint a gyermek túlsúlya/elhízása közötti NMDR kapcsolatokra utaló jeleket találtunk a svéd gyermekek körében.
Következtetés
Ötéves utánkövetés során pozitív összefüggéseket találtunk az anyai szérum PFAS-koncentrációja és a gyermek túlsúlya/elhízása között, különösen a norvég résztvevők körében. Megfigyeltünk néhány bizonyítékot a svéd résztvevők közötti NMDR kapcsolatokra.
Háttér
Számos perzisztens szerves szennyező anyag (POP), beleértve a perfluor-alkil-anyagokat (PFAS) és a szerves klórokat (OC-k), EDC-ként van besorolva [4]. A PFAS-ok és az OC-k mindenütt jelenlévő, perzisztens és bioakkumulatív vegyi anyagok, amelyeket az anya szérumában a terhesség alatt és a köldökzsinórvérben észleltek a szülés során. Noha egyes POP-k használata sok országban jelenleg tiltott vagy korlátozott [6], a POP-expozíció háttérszintjéhez kapcsolódó káros hatások továbbra is komoly közegészségügyi problémát jelentenek [7].
Az állatkísérletekhez képest az anyai szérum terhesség alatti POP-koncentrációja és az utód utáni elhízás közötti összefüggést vizsgáló prospektív epidemiológiai vizsgálatok kevésbé kiterjedtek [8, 9]. A PFAS-expozíció esetében a longitudinális vizsgálatok pozitívakról [10,11,12,13,14,15] és összefüggésekről sem számoltak be [16, 17]. OC-k esetén a prenatális expozíció p, p ’-diklór-difenil-diklór-etán (p, p ’-A DDE) összefüggésben van a megnövekedett testtömeg-indexgel (BMI) csecsemőben és gyermekkorban [8, 9], de kevésbé következetes eredményekről számoltak be a prenatális poliklórozott bifenil (PCB) és a hexaklór-benzol (HCB) asszociációival kapcsolatban [8, 9]. A legtöbb korábbi tanulmány antropometriai indexeket, például BMI-t használt az utódok testösszetételének proxyként [18]. Ugyanakkor az azonos testzsírmennyiségű gyermekek BMI-értéke meglehetősen eltérő lehet. Emiatt a bőrfelület vastagsága informatívabb mérőszám lehet a gyermekek testtömegének tömegében [19].
A jelenlegi tanulmány 412 anya-gyermek párot tartalmaz egy skandináv prospektív kohorsz vizsgálatból norvég és svéd résztvevőkkel. Célul tűztük ki az anyai szérum POP-koncentrációinak összefüggését a terhesség korai szakaszában és az utódok antropometriája között, ideértve a gyermekek túlsúlyát/elhízását is 5 éves követéskor.
Mód
A vizsgálat résztvevői
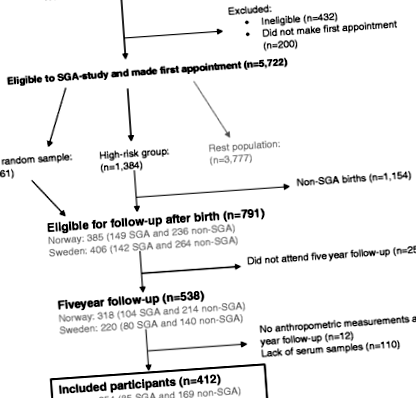
Ez a jelenlegi tanulmány az Egyesült Államok Nemzeti Gyermekegészségügyi és Emberi Fejlesztési Intézetének (NICHD) skandináviai szekvenciális, szülés utáni kismamák számára történő szülés tanulmányának adatait használja (The SGA Study) [20]. Az SGA-tanulmány egy nagy, több központból álló prospektív kohorszvizsgálat, amelyet Trondheimben és Bergenben (Norvégia) és Uppsalában (Svédország) végeztek 1986 és 1988 között. Az SGA tanulmányt a longitudinális magzati növekedés, valamint az anyák perinatalis és postnatalis eredményeinek tanulmányozására tervezték és gyermek [20]. Röviden, az összes terhes nő (1. ábra
A résztvevők folyamatábrája
Az anyai szérum POP-koncentrációjának expozíciójának értékelése
A vizsgálati protokoll (1986–88) szerint az anyai szérum mintákat a 2. trimeszterben (17–20. Terhességi hét) gyűjtöttük, és későbbi elemzés céljából mínusz 80 ° C-on tároltuk. Az anyai szérum PFAS és OC koncentrációinak elemzését végeztük.
PFAS elemzések
A PFAS elemzéseket a norvégiai Tromsø Norvég Légkutató Intézet (NILU) laboratóriumaiban végezték. Az anyai szérummintákat két célanalízishez számítottuk, ideértve a perfluor-oktanoátot (PFOA) és a perfluoroktán-szulfonátot (PFOS). A minta előkészítésével, az extrakciós módszerrel, az analitikai módszerrel, a reagensekkel és az eszközökkel kapcsolatos részletes információkról korábban beszámoltunk [21, 22]. Az anyai szérum PFAS-koncentrációit ultrahanggal elősegített folyadék-folyadék extrakció, aktivált ENVI-carb tisztítás [23] alkalmazásával határoztuk meg, és ultrahagy nagynyomású folyadékkromatográfiával háromszor négyszeres tömegspektrometriával (UHPLC-MS/MS) elemeztük. Az AMAP gyűrűs tesztben való részvétel [24] biztosítja, hogy az elemzés bizonytalansága a hozzárendelt értékek ± 15–20% -án belül legyen.
OC elemzések
Az anyai szérum OC koncentrációit az Institut National de Santé Publique du Quebec-ben (Centre Toxicologie, Quebec) elemeztük. Számos OC-t mértek, beleértve a hexaklór-benzolt (HCB), az oxiklordánt, a poliklórozott bifenilt (PCB) 52, 101, 118, 153, 156, 170 és 180, p, p ’-diklór-difenil-diklór-etilén (p, p ’-DDE), p, p ’-diklór-fenil-triklór-etán (p, p ’-DDT), β-hexaklór-hexán (β-HCH) és ford-nonaklór (t-NC). Röviden: 0,5–1 ml szérummintát extraháltunk hexánnal (2 × 6 ml), etanollal (2 ml) és telített ammónium-szulfát-oldattal (2 ml). Ez a módszer a Sandanger és munkatársai által leírt módszer enyhe módosítása. [25], ahol a mintákat 1 g aktivált fluoriszil alkalmazásával automatizált folyadékkezelő rendszeren tisztítottuk meg a GC-MS elemzés előtt [26]. Az elemzések bizonytalansága a hozzárendelt értékek ± 15–20% -án belül van, amit megerősít az AMAP Ring Testben való részvétel [24]. A lipideket enzimatikusan meghatároztuk, és az összesített lipidmennyiségeket trigliceridek és koleszterinszint mérések alapján számítottuk a következő képlettel:
Összes lipid = 1,33 * triglicerid + 1,12 * koleszterin +1,48 (g/l) [27]. Ez a képlet jó korrelációt mutatott a teljes formulákkal, beleértve a foszfolipideket is [28].
Kovariátusok
Az anya életkorára, magasságára, terhesség előtti súlyára, iskolázottságára, dohányzási szokásaira, a korábbi szoptatás időtartamára és a terhességek közötti intervallumra vonatkozó információkat személyes interjúk és önjelentő kérdőívek segítségével gyűjtöttük az eredeti vizsgálati időszakban az SGA Study protokoll szerint. Az anya terhesség előtti BMI-jét az első tanulmányi látogatás során önmaga által megadott magasság és súly alapján számították ki. Kiszámítottuk az anya súlygyarapodását akár 17 hetes terhességig, mint az ön által bejelentett terhesség előtti súly és a klinikailag rögzített, a 17. terhességi héthez legközelebb eső súly közötti különbséget (amelyet a nő saját szülésznője vagy háziorvosa végzett). A kedvezőtlen perinatális kimenetekkel, köztük a magzati növekedés korlátozásával járó, ismert J alakú összefüggés alapján [34] a terhességek közötti intervallumot 60 hónaposnak soroltuk az utolsó születésük óta.
statisztikai elemzések
Az anyai szérum PFAS és OC koncentrációit logaritmikusan (ln) transzformáltuk a normális eloszlás elérése érdekében. Nedves súlyú anyai szérum PFAS-koncentrációt és lipid-korrigált anyai szérum OC-koncentrációt használtunk [27].
Eredmények
Összességében az átlagos anyai életkor a tanulmány kezdetén 29 év volt, a nők 69% -a várta második gyermekét, és 31% várta a harmadik gyermekét (1. táblázat). Az előző szoptatás átlagos időtartama 7 hónap volt. Az anyák átlagosan 3,2 kg-ot híztak a fogantatástól a 17. terhességi hétig. Összességében az anyák 10% -a volt alulsúlyos (BMI 2) a fogantatáskor, 9% -a pedig túlsúlyos vagy elhízott (BMI ≥ 25 kg/m 2), némi eltéréssel országok között. A norvég anyák nagyobb arányban voltak alulsúlyosak (BMI 2) fogantatásukkor svéd társaikhoz képest (12% vs. 7%). A norvég anyák 53% -a számolt be dohányzásról fogantatáskor, míg a svéd anyák 33% -a.
Az 5 éves utánkövetés során a gyermekek egyenletesen oszlottak meg nemek szerint (51% fiú és 49% lány), ahol 1/3-a SGA-születésnek minősült (ami az SGA-születések túlmintavételét tükrözi). A norvég gyermekek születési súlya valamivel alacsonyabb volt (3401 vs. 3515 g), és hosszabb ideig szoptattak (6,8 hónappal 6,0 hónap), mint a svéd gyermekeknél. A norvég gyerekek szintén fiatalabbak voltak az 5 éves utánkövetés során (Norvégia: 61 hónap, Svédország: 65 hónap). Az 5 éves utánkövetés során összesen 55 gyermeket (12%) tekintettek túlsúlyosnak vagy elhízottnak (Norvégia: 14%, Svédország: 10%). Vizsgálati populációnkban a norvég gyermekek magasabb nemi és életkor-korrigált sub-capularis bőrréteg vastagságának (Norvégia: 0,18; Svédország: −0,32) és a tricepsz bőrréteg-vastagságának (Norvégia: 0,32; Svédország: −0,07) magasabbak voltak, mint Svéd gyerekek (1. táblázat).
A norvég anyáknál a szérum PFOA-koncentrációja lényegesen alacsonyabb volt (1,64 vs. 2,33 ng/ml), PFOS-koncentráció (9,62 vs. 16,3 ng/ml), PCB 153-koncentráció (79,9 vs. 117 ng/g lipid) és β-HCH-koncentráció (21,2 vs. 25,0 ng/g lipid) a svéd anyákhoz képest (2. táblázat). A norvég anyáknál magasabb volt az átlagos szérumérték t-NC-koncentráció (6,77 vs. 6,28 ng/g lipid) a svéd anyákhoz képest. Medián anyai szérum HCB koncentráció (17,0 vs. 18,4 ng/g lipid) és p, p ’-A DDE-koncentrációk (211 vs. 244 ng/g lipid) nem különböztek országonként (2. táblázat).
A PFAS-k és az OC-k anyai szérumkoncentrációinak korrigált lineáris és logisztikai összefüggéseit, valamint a gyermek adipozitásának mértékét az 5 éves utánkövetés során a 3. táblázat mutatja be. Ezeket az eredményeket lakóhely szerinti országonként rétegezzük, a hatásmódosítás országonkénti néhány jelzése alapján ( pinterakció = 0,039) az anyai szérum PFOS-koncentrációja és az utódok BMI z-pontszámai, valamint a gyermek túlsúlya/elhízása között 5 éves követéskor (pinterakció = 0,098). A teljes kohorszban a korrigált BMI-kor és nem szerinti z-pontszám 0,18-mal (95% CI: 0,01–0,35), a korrigált tricepsz bőrréteg z-pontszáma pedig 0,15-rel (95% CI: 0,02–0,27) nőtt a az anyai szérum PFOS-koncentrációinak minden egységnyi növekedése. Az anyai szérum PFOS-koncentrációjának minden egyes egységnyi növekedése esetén a korrigált OR a gyermek túlsúlya/elhízása szempontjából 2,04 volt (95% CI: 1,11–3,74). Az adatok azt is sugallják, hogy pozitív összefüggések vannak az anyai szérum PFOA-koncentrációja és a gyermek BMI z-pontszámai, a tricepsz bőrráncai z-pontszámai és a gyermek túlsúlya/elhízása között az 5 éves követés során (3. táblázat).
A norvég gyermekek körében az anya szérum PFOS-koncentrációjának minden egyes ln-egységnyi növekedésére (β: 0,30 (95% CI: 0,08, 0,51), és minden ln-egység növekedésre figyeltünk meg emelkedett BMI-értékeket az életkor és a nemek szerint az anyai szérum PFOA-koncentrációjában (β: 0,32 (95% CI: 0,05, 0,60) (3. táblázat). A norvég gyermekek emellett az anyai szérum PFOS-koncentrációjának ln-egységenként megnövekedett tricepsz bőrréteg z-pontszámát mutatták (β: 0,20, 95% CI: 0,06, 0,35) és az anyai szérum PFOA koncentrációja (β: 0,24, 95% CI: 0,05, 0,42). A BMI z-pontszámai 0,45 (95% CI: 0,03, 0,87) növekedtek az anyai szérum minden egyes egységnyi növekedése esetén A norvég PCB 153 koncentráció a svéd résztvevők között nem tapasztaltak összefüggéseket.
A korrigált logisztikus regresszióban az összevont elemzések során nem figyeltünk meg általános összefüggést az anyai szérum POP-koncentrációja és a gyermek adipozitása vagy túlsúlya/elhízása között. A norvég gyermekek körében az anya szérum PFOS-koncentrációjának (OR-ra igazítva: 2,96, 95% CI: 1,42–6,15) és az anyai szérum PFOA-koncentrációjának 5% -os követésénél megnövekedett esélyeket figyeltünk meg az 5 éves követés során. VAGY kiigazítva: 2,90, 95% CI: 1,10–7,63).
Az anyai szérum POP koncentrációja és a gyermek túlsúly/elhízás kimenetele közötti lehetséges NMDR kapcsolat vizsgálatához korlátozott 3 csomós köbös spline modellt használtunk. A svéd résztvevők között megfigyeltünk néhány bizonyítékot az anyai szérum PFOS-koncentrációja és az utódok BMI z-pontszámai közötti NMDR-kapcsolatra 5 éves követéskor (o = 0,09 nem-linearitás esetén, 2. ábra). Néhány jelzést találtunk az anyai szérum PCB 153 koncentrációja és az utódok BMI z-pontszámai közötti NMDR kapcsolatról is 5 éves követéskor (o = 0,02 nem-linearitás esetén, 3. ábra) a vizsgálat svéd részében.
Az anya szérum PFOS-koncentrációja és az utódok BMI-je az életkor és a nem szerinti z-pontszámhoz igazított, korlátozott köbös spline, 3 csomóval, 5 éves követés során, összességében és országonként rétegezve. Valamennyi modellt az anya életkorához, a terhesség előtti testtömeg-indexhez, az iskolai végzettséghez, a terhesség alatti dohányzási állapothoz, a terhességek közötti intervallumhoz, a korábbi szoptatás időtartamához és az anya súlyának növekedéséhez a terhesség 17 hetéig igazítják. A teljes modellt a származási országhoz igazítják. A folytonos vonal az átlagos BMI z-pontszámot, az árnyékos terület pedig a 95% -os konfidencia intervallumot képviseli
Az anya szérum PCB 153-koncentrációinak és utódainak BMI-je az életkor és a nem szerinti z-pontszámhoz igazított, korlátozott köbös spline, 3 csomóval, 5 éves követés során, összességében és országonként rétegezve. Valamennyi modell az anya életkorához, a terhesség előtti testtömeg-indexhez, az oktatáshoz, a terhesség alatti dohányzási állapothoz, a terhességek közötti intervallumhoz, a korábbi szoptatás időtartamához és az anya súlygyarapodásához igazodik, egészen a 17. terhességi hétig. A teljes modellt a származási országhoz igazítják. A folytonos vonal az átlagos BMI z-pontszámot, az árnyékos terület pedig a 95% -os konfidencia intervallumot képviseli
Eredményeink általánosíthatóságát egy réteggel súlyozott elemzésben teszteltük, amely figyelembe vette az eredeti SGA vizsgálati tervet, amely magában foglalta az SGA születések nagyobb arányát, az anya túlsúlyának alacsonyabb prevalenciáját és a fogantatáskor a dohányzó anyák nagyobb gyakoriságát a fogantatáskor általános terhes népesség. Réteggel súlyozott elemzésünk nem változtatott érdemben a jelentett eredményeinken (1. kiegészítő fájl: S1. Táblázat). A norvég nők körében az anyai halbevitel kiigazítása szintén nem változtatott a becslésen (az adatokat nem mutatjuk be). Az anyai szérum PFOS és PCB 153, valamint az anyai szérum PFOA és PCB 153 koncentrációk közötti kölcsönös kiigazítás nem változtatta meg a jelenlegi becsléseket. Mindazonáltal az anyai szérum PFOS és a PFOA koncentrációjának hozzáadása ugyanahhoz a modellhez a becslések némi gyengülését eredményezte, valószínűleg a PFAS-ok közötti magas korreláció miatt (1. kiegészítő fájl: S2. Táblázat).
Vita
Ebben a 412 norvégiai és svéd anya-gyermek pár prospektív kohorszvizsgálatában pozitív összefüggéseket figyeltünk meg az anyai szérum PFAS-koncentrációja, a gyermek BMI és a tricepsz bőrhajlati z-pontszámai, valamint a gyermek túlsúlya/elhízása között 5 éves utánkövetéskor, különösen a norvég nők körében. Emellett bizonyítékot találtunk az anyai szérum PFOS és a PCB 153 koncentrációk és az utódok BMI z-pontszámai közötti NMDR összefüggésekre a svéd résztvevők között.
A jelenlegi tanulmánynak számos erőssége van, beleértve az anya-gyermek párok viszonylag jelentős számát (n = 412). Megvizsgáltuk az anyai szérum PFAS és OC koncentrációját a terhesség korai szakaszában, és részletes klinikai alapú eredményértékelésekkel értékeltük az anyákat és gyermekeket a terhesség, a csecsemőkor és a kora gyermekkor alatt. A standardizált antropometriai mérések alkalmazása csökkentheti az esetleges téves osztályozást és javíthatja becsléseink statisztikai pontosságát. Tudomásunk szerint csak egy korábbi tanulmány értékelte az anyai szérum prenatális PFAS-koncentrációja, az utód tricepsz és a szubkapuláris bőrréteg vastagság közötti kapcsolatot [11]. A csak a BMI-t mérő tanulmányokat korlátozza az a tény, hogy a BMI nem közvetlenül a zsíreloszlás mérőszáma. Mint ilyen, az azonos BMI-vel rendelkező gyermekek jelentősen eltérhetnek a testzsír teljes mennyiségében [42]. A vizsgálatunkban alkalmazott Skinfold vastagság a szubkután zsír mérésére szolgál, amelyről beszámoltak, hogy szoros összefüggésben van a testzsír teljes mennyiségével [19, 43]. Több fontos prenatális és posztnatális tényezőt is megvizsgálhattunk és/vagy kiigazíthattunk. Vizsgálatunk egyike azon kevés vizsgálatoknak, amelyek az anyai szérum PFAS és OC expozíciójának különféle elemzésére szolgálnak.
Következtetés
Vizsgálatunk azt mutatja, hogy az anyai szérum PFAS-koncentrációjának növekedése a gyermek BMI-jének és a tricepsz bőrhajlati z-pontszámainak növekedésével járt együtt, a gyermek túlsúlya/elhízása mellett az 5 éves követés során, de ez az összefüggés földrajzilag és az anyai szérum PFAS-koncentrációja szerint eltérhet. Eredményeink rámutatnak az NMDR-kapcsolatok értékelésének fontosságára a POP-expozíciók szempontjából is. További prospektív vizsgálatokra van szükség az anyai szérum POP koncentrációja és az idősebb gyermekek és felnőttek túlsúlya/elhízása közötti összefüggésről.
- Prenatális diethylstilbestrol expozíció és az elhízás kockázata felnőtt nőknél
- A gyermekkori elhízás megelőzése a gyermek egészségügyi szolgáltatásaiban A PRIMROSE próba gyermekkorának nyomon követése
- A prenatális alacsony fehérjetartalmú és karbenoxolonexpozíció nemi specifikus hatásai a vese angiotenzinre
- Gyermekkori metadon bevitel A gyermekek bántalmazásának alulismert formája
- Nem minden keksz egészséges a gyermeke számára