A prosztatarák etiológiája
Kapcsolódó kifejezések:
- Neoplazma
- D-vitamin
- Mutáció
- Rákmegelőzés
- Rákkockázat
- Hibrid
- Androgén
- mikroRNS
- Prosztata rák
Letöltés PDF formátumban
Erről az oldalról
A dohányzás és a férfiak egészsége
Prosztata rák
A prosztatarák etiológiája továbbra is megfoghatatlan fogalom. Úgy gondolják, hogy számos tényező járul hozzá a fejlődéséhez: genetikai hajlam, étrend, fertőzések, hormonális egyensúlyhiány és a toxinoknak való kitettség (mint például a CS-ben találhatók) [120]. 2015-ben Carter és mtsai. csaknem egymillió (férfi és női) betegre kiterjedő longitudinális kohortvizsgálat publikált adatai az Egyesült Államokban. Ez feltárta a dohányzás jelentőségét a prosztatarákban. A dohányzás nemcsak növeli a prosztatarák előfordulását, hanem növeli az előrehaladott stádiumú megbetegedések kockázatát, és a dohányzóknál a halálozás 43% -kal magasabb volt [121]. A lehetséges etiopatológiáról nincs sok információ. Egy észak-indiai 2011-es tanulmány 578 prosztatarákos férfit értékelt. Dohányzó férfiaknál megnövekedett gyulladásos citokin IL-18 szintet találtak. Sőt, magasabb stádiumú betegséggel is társult. A krónikus gyulladás javasolt, hogy jelentősen hozzájáruljon a prosztatarák kialakulásához [122] .
Rákkockázat és vegetáriánus étrend
13 Prosztata rák
Kevéssé ismert a prosztatarák etiológiája, és az egyetlen jól megalapozott kockázati tényező az életkor, a családtörténet, a fekete etnikai háttér és a genetikai tényezők növekedése. Az ökológiai tanulmányok szerint a kockázat pozitívan társulhat a nyugati stílusú étrendhez, és a vörös húsban, tejtermékekben és állati zsírban gazdag étrend szerepet játszik a prosztatarák kialakulásában, de az adatok nem konzisztensek és összességében nem meggyőzőek. A vegetáriánusok esetében az Egyesült Királyság kohorszai a prosztatarák viszonylagos kockázatát jelentik a laktovegetariánusoknál a húsevőkhez viszonyítva 0,86 (0,61–1,11), az AHS 0,65 (0,44–0,95), az AHS-2 pedig a 0,96 (0,66–1,24) (19.2. Táblázat).
A prosztatarák kockázata pozitívan kapcsolódik az IGF-1 keringő szintjéhez, és a vegánok viszonylag alacsony keringési koncentrációban tartalmazzák ezt a hormont. Az Egyesült Királyság kohorszai a prosztatarák viszonylagos kockázatáról számolnak be a vegánoknál a húsevőkhez viszonyítva 0,61 (0,31–1,20), az AHS-2 pedig 0,66 (0,50–0,87) relatív kockázatot jelentenek (19.3. Táblázat); ezek a megállapítások összhangban állnak azzal a hipotézissel, miszerint a vegánoknál csökkenhet a prosztatarák kockázata, de a vegánoknál csak 68 eseten alapulnak, és további kutatásokra van szükség ebben a témában.
Hormonális karcinogenezis
III prosztatarák
Rengeteg adat kapcsolja össze az androgén hormonokat a prosztatarák etiológiájával. Az orchiectomia a prosztata involúciójához vezet, és a prosztatarák kezelésének hatékony terápiás programjaként ismerik el. A leendő vizsgálatok nem mutattak ki szoros összefüggést a prosztatarák kockázata és a tesztoszteron, dihidrotesztoszteron, androszténdion és számos más androgén hormon keringő szintje között. Számos tanulmány kimutatta azonban, hogy az androgénreceptort (AR) kódoló gén variánsos alléljai módosíthatják a prosztatarák kockázatát. Az AR gén az 1. exonban egy olyan polimorf CAG ismétlést tartalmaz, amely egy változó hosszúságú glutamin traktust kódol, amely úgy tűnik, hogy befolyásolja az AR képességét a gén transzkripció aktiválására. Úgy tűnik, hogy a prosztatarák kockázata fordítottan korrelál az AR-ban lévő CAG-ismétlések számával. Az AR 1. exonjában egy polimorf GGC ismétlés, amely változó hosszúságú glicin traktust kódol, szintén módosíthatja a prosztatarák kockázatát.
Az epidemiológiai vizsgálatok a D-vitamin-hiányt a prosztatarákkal társítják, és számos laboratóriumi tanulmány rámutat a D-vitamin hormonálisan aktív formájának, az 1,25-dihidroxi-D3-vitamin szerepének a prosztatarák sejtvonalainak proliferációjának és túlélésének szabályozásában. Az 1,25-dihidroxi-D3-vitamin egy receptoron keresztül működik, amely a nukleáris receptor szupercsalád tagja. A D-vitamin receptor számos allélváltozatát azonosították, és tanulmányok azt sugallják, hogy ezek a variánsok megváltozott prosztatarák-kockázattal járhatnak. Bár ezek a tanulmányok nem mindegyikében értenek egyet a specifikus polimorfizmusok és a kockázat összefüggéseivel, együttesen azt sugallják, hogy a D-vitamin-receptort kódoló gén a prosztatarák kialakulásának alacsony penetrancia-módosítójaként működhet.
Noble elsőként jelentette, hogy a tesztoszteron vagy a tesztoszteron ösztrogénnel kombinált folyamatos kezelése prosztatarák kialakulását indukálja az NBL patkányokban. S.-M. tanulmányainak sora Ho és munkatársai azt mutatják, hogy az ép NBL patkányok tesztoszteronnal és E2-vel történő kezelése 16 héten keresztül az epitheliális dysplasia magas előfordulását idézi elő a prosztata dorsolaterális lebenyében. A környező hámhoz viszonyítva a diszpláziás elváltozások számos olyan változást mutatnak a génexpresszióban, amelyek hozzájárulhatnak fejlődésükhöz vagy azokból származhatnak, beleértve a Ha-ras és a progeszteron receptor mRNS-ek fokozott expresszióját. A diszpláziás elváltozások kiváltását gátolja a bróm-kriptinnel történő kezelés, ami arra utal, hogy a prolaktin hozzájárul a fejlődésükhöz. Érdekes módon úgy tűnik, hogy a hormon által kiváltott elváltozások elhelyezkedése a prosztatában függ a beadott ösztrogén mennyiségétől és/vagy típusától. Például a tesztoszteron a megnövekedett E2-vel kombinálva atipikus hiperpláziát indukál a prosztata hasi lebenyében. Hasonlóképpen, az NBL patkányok tesztoszteronnal és DES kezeléssel történő kezelése diszpláziát vált ki a ventrális prosztatában.
Bosznia és munkatársai tanulmányai azt mutatják, hogy az NBL patkányok tesztoszteronnal és E2-vel történő hosszú távú kezelése az adenokarcinóma 100% -os előfordulását indukálja az NBL patkány dorsolateralis, de nem ventrális prosztatájában. Tesztoszteronnal és E2-vel 16 hétig vagy hosszabb ideig kezelt NBL patkányok dorsolaterális, de nem ventrális prosztatájában ismeretlen szerkezetű DNS-adduktot detektáltak. Nemrégiben Y. C. Wong és munkatársai tanulmányok sorozatát publikálták az NBL patkány ventrális prosztatájában történő karcinóma indukciójáról, tesztoszteron és nagy dózisú E2 kezelés folyamatos kezelésével.
Gyulladás és fertőzés a prosztatarák etiológiájában
Siobhan Sutcliffe PhD, Michel A. Pontari MD, a prosztatarákban (második kiadás), 2016
Absztrakt
A fertőzés és a gyulladás szerepe a prosztatarák (PCa) etiológiájában nem teljesen egyértelmű. Egyes bizonyítékok arra utalnak, hogy a PCa-hoz társulnak gyulladásos elváltozások, amelyek szintén korrelálnak a prognózissal. Maga a biopsziás gyulladás azonban nem mindig korrelál a PCa-val. Vannak olyan mechanizmusok, amelyek megmagyarázzák, miért járulhat hozzá a gyulladás a PCa-hoz, és néhány gyulladásos gén, amelyek fontosak lehetnek. A specifikus gyulladásos biomarkerek bizonyítéka korlátozott. Az étrend és a fertőzés szerepe nem biztos. A gyulladás és talán a fertőzés kapcsolata valószínűleg magában foglalja a genetikailag fogékony emberek környezetének hatására történő események ösztönzését a PCa fejlődéséhez.
Prosztata rák
Etiológia
Frissítés a prosztatarák apoptózisának szabályozásáról
R. William,. John M. Fitzpatrick, Prosztatarák, 2003
Kaspázok: relevanciájuk a prosztata sejtek apoptózisában
A kaszpázok szerepe a prosztata mirigyek önmegújulásának normális folyamatában és a prosztatarák etiológiájában a prosztatarák kutatásának egyik fő területévé válik. Annak megértése, hogy a kaszpázok deregulációja hogyan járul hozzá a rák kialakulásához, valószínűleg segít olyan terápiás stratégiákban, amelyek célja az androgén-érzéketlen állapotba történő progresszió megakadályozása.
A prosztata immunhisztokémiája kimutatta a kaszpáz-3 és a kaszpáz-1 expresszióját, amelyek korrelálnak a sejttípussal és a fiziológiával. 85 A kaszpáz-3 festése alacsony bazális sejt expressziót mutat a mirigy szekréciós sejtjeihez képest. A kaszpáz-3 magas expressziója a luminalis szekréciós sejtekben magas sejtforgalommal korrelál, megmagyarázva, hogy miként lehet fenntartani a mirigyek önmegújulásának egyensúlyi állapotát. A legújabb vizsgálatok azt is kimutatták, hogy a kaszpáz 3 86, 87 és a kaszpáz 1 87 csökkent expressziója fokozott Gleason fokozattal.
Kimutatták, hogy a kasztrák részt vesznek a kasztrálást követő prosztata regresszióban is. A kasztrált egerekből és patkányokból nyert prosztata szöveti szakaszok kifejezetten a feldolgozott kaszpázokra festenek. Hasonlóképpen, a kaszpázok gátlása a kaszpáz aktivitás vírusos inhibitorának, a CrmA-nak a túlzott expressziójával megakadályozza az androgén-megvonás indukálta apoptózist in vitro. 89 Az androgén-érzéketlen daganatok androgén megvonása utáni folyamatos növekedése tehát megváltozott apoptotikus szignalizációból származhat, amelyet a kaszpáz gátlás közvetít. Hasonlóképpen, a prosztatarák metasztázisának lehetősége magában foglalhatja a kaszpáz gátló mechanizmusokat. Az LNCaP prosztatarák sejtvonal nem metasztatikus variánsa (LNCaP-Pro5) segítségével kiderült, hogy ezek a sejtek érzékenyebbek az apoptotikus indukcióra, mint metasztatikus társaik. 90 Ezek a vizsgálatok legalább in vitro azt sugallják, hogy az apoptotikus rezisztencia (kaszpáz gátlás) növekszik az emberi prosztatarák sejtvonalainak metasztatikus potenciáljával együtt.
Ezek a vizsgálatok szerepet játszanak a kaszpázok terápiás manipulációjában prosztatarákban, akár fokozott aktivációjuk révén, akár gátlásuk csökkenésével az IAP expressziója révén, vagy az AKT út aktiválásával.
D-vitamin hormon
Eiji Munetsuna,. Toshiyuki Sakaki, Vitaminok és hormonok, 2016
3.1 D-vitamin és prosztatarák
Diétás beavatkozások
LAHA KHAODHIAR, GEORGE L. BLACKBURN, a táplálkozási onkológiában (második kiadás), 2006
Diétás zsír
Annak ellenére, hogy a prosztatarák korai felismerése és kezelése terén jelentős előrelépés történt, a betegséget okozó környezeti és genetikai tényezőkről keveset tudni. A prosztatarák karcinogenezisének fő kérdése nem a betegség megindulása, hanem annak elősegítése és progressziója (Fleshner et al., 2004). A boncolások eredményei azt mutatták, hogy a férfiak ~ 80% -ának volt 80 évesen a prosztatarák mikroszkópos gócai (Sakr et al., 1996). Noha a látens rák ezen gócainak előfordulása az egész világon hasonló, országonként akár 20-szor is változhat (Wynder et al., 1971). Ezek a gócok kiterjedtebbnek, multifokálisabbnak és magasabb fokúnak tűnnek a nyugati országokból származó férfiaknál is (Breslow et al., 1977).
Bizonyíték - hogy a migráns férfiak hajlamosak elérni a befogadó ország incidenciáit (Haenszel és Kurihara, 1968), és hogy a prosztatarák aránya drasztikusan változik ugyanazon etnikai populációban, különböző földrajzi helyeken élve (Kolonel et al., 1999) - erősen azt sugallja, hogy a környezeti tényezők befolyásolhatják a látens rák agresszívebb állapotba kerülését (Haenszel és Kurihara, 1968; Kolonel és mtsai, 1999). Az ökológiai vizsgálatok közvetlen összefüggést mutatnak a prosztatarák nemzetközi halálozási aránya és az étkezési zsír becsült egy főre eső fogyasztása között (Rose és mtsai, 1986). A prosztatarák állatmodelljében az alacsony zsírtartalmú étrend csökkentette a tumor növekedésének sebességét (Wang et al., 1995).
A prosztatarák és az étkezési zsír vagy az adott zsíros ételtípusok közötti kapcsolatról szóló 33 publikált eset-kontroll és kohorsz tanulmány áttekintésében 8 tanulmány talált jelentős összefüggést. Ezenkívül számos tanulmány javasol egyesületeket a zsíros ételek meghatározott típusaihoz (Fleshner et al., 2004). Az eset-kontroll vizsgálatok közül mintegy fele talált megnövekedett kockázatot az étkezési zsír, állati zsír, valamint a telített és egyszeresen telítetlen zsír magas bevitelével (Zhou és Blackburn, 1997; Fleshner et al., 2004). Hét kohortvizsgálat közül csak a HPFS talált összefüggést a teljes zsírfogyasztás és az előrehaladott prosztatarák kockázata között (RR = 1,79, a bevitel legmagasabb kvintilisével összehasonlítva) (Giovannucci et al., 1993).
Ebben a vizsgálatban az asszociáció elsősorban az állati zsírokkal, különösen a vörös húsból származó zsírokkal (de nem a növényi zsírokkal) nyugodott. A tejtermékekből származó zsír (a vaj kivételével) vagy a hal nem volt összefüggésben a kockázattal. Két másik kohorszvizsgálat pozitív összefüggéseket jelentett akár telített zsírokkal, akár zsírtartalmú ételekkel (például tej, sajt, vaj, hús és tojás). Hawaii-szigeteken élő japán származású férfiak egy csoportjában a tej, a tojás és a sajt a prosztatarák kockázatával járt együtt, bár az összes zsír, telített és telítetlen zsír nem (Severson és mtsai, 1989). Hasonlóképpen, a hetednapi adventista felnőttek egy csoportja pozitív összefüggéseket mutatott ki a végzetes prosztatarák és a tej, sajt és tojás fogyasztása között (Snowdon et al., 1984; Snowdon, 1988).
Az étrendi zsír és a prosztatarák közötti lehetséges kapcsolatért felelős mechanizmusok nem ismertek. Számos hipotézist javasoltak, többek között a következőket:
Az étkezési zsír növelheti a szérum androgén szintjét. Az androgén valószínűleg szerepet játszik a prosztatarák etiológiájában (Kolonel et al., 1999). Az androgének szabályozzák a prosztata sejtnövekedését (Ford és mtsai., 1994), az androgéntermelés csökkenése pedig a prosztatarák kezelésének fő eleme. Ezenkívül a fiatalon kasztrált férfiaknál nem alakul ki prosztatarák (Sakr et al., 1996). Megfigyelési tanulmányok kimutatták, hogy az étkezési zsírbevitel változásai befolyásolják a férfiak androgének szérum- és vizeletszintjét (Hill és mtsai., 1979; Howie és Shultz, 1985). Egy ikertanulmányban a több zsírt fogyasztó ikernek magasabb volt a tesztoszteronszintje (Bishop et al., 1988). Az alacsony zsírtartalmú, magas rosttartalmú és magas zsírtartalmú, alacsony rosttartalmú étrendi beavatkozás randomizált, keresztezett vizsgálatában a magas zsírtartalmú és alacsony rosttartalmú étrendet folytató férfiak 13–15% -kal magasabb plazmakoncentrációja volt a teljes és a nemi kötő globulin (SHBG) –kötött tesztoszteron és vizelet tesztoszteron, mint a férfiak alacsony zsírtartalmú, magas rosttartalmú étrendben (Dorgan et al., 1996).
A zsírsavak vagy metabolitjaik bizonyos típusai elindíthatják vagy elősegíthetik a prosztatarákot. Bár az adatok korlátozottak, az in vitro vizsgálatok kimutatták, hogy a linolsav, egy omega-6 többszörösen telítetlen zsírsav, stimulálhatja az emberi prosztatarák növekedését, míg a dokozahexaénsav (DHA) és az eikozapentaénsav (EPA), két jelen lévő omega-3 zsírsav halolajokban gátolja (Rose és Connolly, 1991; Connolly és mtsai, 1997). Egy másik in vitro vizsgálat arról számolt be, hogy a linolénsav (szintén omega-3 zsírsav) és az EPA alacsony koncentrációja elősegítette a prosztata sejtek növekedését (Pandalai et al., 1996). Uruguay-ban végzett humán esetkontroll-vizsgálat pozitív összefüggést jelentett az α-linolénsav és a prosztatarák között (De Stefani et al., 2000). Hasonlóképpen, a HPFS adatai szerint az a-linolénsav, de nem a linolsav, összefügg a fejlett prosztatarák kockázatával (Giovannucci et al., 1993). A linolénsav fő forrásai ezekben a vizsgálatokban a vörös hús, a tejtermékek, a majonéz, a margarin és a vaj voltak.
Az étkezési zsír prooxidáns és növelheti az oxidatív stressz markereit (Fleshner és Klotz, 1998). A többszörösen telítetlen zsírsavak fogékony célpontot kínálnak ezen oxidáló fajok közül sokan, lipidgyököket és hidroperoxidokat képezve, amelyek további oxigéngyököket és/vagy DNS-károsodást generálhatnak (Kolonel et al., 1999).
Az emberi betegség állatmodelljei
A prosztatarák progressziója lassú és többlépcsős folyamat; klinikailag kimutatható prosztatarák általában idős férfiaknál nyilvánul meg, bár az elváltozások életük sokkal korábban keletkezhetnek. Az emberi prosztatarák kezdetét, progresszióját és áttétét utánzó állatmodellekre szükség van a prosztatarák etiológiájának megértéséhez és új kezelések kidolgozásához. Az egér géntechnológiai technológiájában a közelmúltban elért eredmények eredményeként egy sor egérmodell jött létre a prosztatarák kutatásához, amelyeket széles körben alkalmaztak egyetlen génmódosítás vagy kombináció kombinációinak a prosztatarák kialakulására, progressziójára és áttétjeire gyakorolt hatásainak tesztelésére., valamint a környezeti, klinikai és preklinikai gyógyszerek hatásainak felmérésére a prosztatarák megelőzésére és kezelésére. Bár lehetséges, hogy egyetlen „tökéletes” modell nem képes összefoglalni ennek a rendkívül heterogén betegségnek minden aspektusát, várható, hogy a prosztatarák bizonyos aspektusait utánzó modellek továbbra is preklinikai útmutatót nyújtanak majd ennek az elterjedt betegségnek a kezelésében.
D-vitamin, napfény és a prosztatarák természettörténete
GARY G. SCHWARTZ, TAI C. CHEN, D-vitamin (második kiadás), 2005
B. A prosztatarák leíró epidemiológiája: az életkor, a faj és a hely hatása
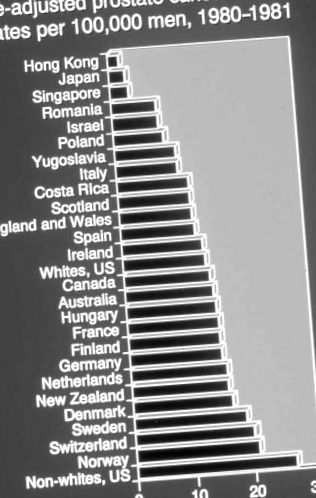
A prosztatarák a leggyakoribb (bőr nélküli) rák az amerikai férfiak körében, és a tüdőrák után a halálos kimenetelű, 2003-ban hozzávetőlegesen 221 000 új esetet és 29 000 halálesetet jelentett [11]. A klinikai prosztatarák erősen életkorfüggő: a halálozási arány logaritmikusan növekszik az életkorral, és az afro-amerikaiak körében körülbelül 50% -kal magasabb, mint a kaukázusiaknál. Az életkoron és a fajon kívül a prosztatarákos halálozás legszembetűnőbb jellemzője a helyenként markáns eltérés: az életkorral igazított halálozási arány világszerte húszszorosára változik, és a legmagasabb az afro-amerikaiak és észak-európaiak körében [12] (lásd 1. ábra) . Az afro-amerikaiak és az észak-európaiak közötti halálozási arány hasonlósága fontos nyom, mivel azt sugallja, hogy ezeknek a populációknak lehet közös tényezője, amely megalapozza hasonló halálozási tapasztalataikat. Bármelyik elméletet is javasoljuk a prosztatarák etiológiájáról, meg kell válaszolnia a kérdést: Hogyan vannak egyformán afro-amerikaiak és észak-európaiak?
1.ÁBRA . A prosztatarák világszerte korrigált halálozási aránya Kurihara et al. A halálozási arány húszszoros eltérést mutat, és a legmagasabb az afroamerikai férfiak és az észak-európai populációk között.
A prosztatarák epidemiológiájának egyedülálló vonása az „esetleges” (más néven „szubklinikai” vagy „boncolás”) rák magas előfordulása. A prosztataráktól eltérő okok miatt elhunyt férfiak boncolásakor kiderül, hogy a 40 év körüli férfiak körülbelül 27% -ának és az 50 év körüli férfiak 34% -ának van szövettani prosztatarákja [13]. Ezeknek a szubklinikai daganatoknak a prevalenciája a 80 év feletti férfiaknál eléri a 60% -ot, és az életkor előrehaladtával növekszik [14]. Szövettanilag ezek az elváltozások nem különböztethetők meg a potenciálisan életveszélyes prosztatarákoktól, és természettörténetük korábbi szakaszában rákot jelentenek. A mortalitási rátákkal szemben az esetleges prosztatarák előfordulása világszerte hasonló az idősebb férfiak körében, faji vagy földrajzi eredetüktől függetlenül [15, 16]. A klinikai és szubklinikai prosztatarák előfordulása közötti eltérés arra utal, hogy a klinikai rák olyan tényezőkből származik, amelyek a szubklinikai rák növekedését szabályozzák. Így a prosztatarákra vonatkozó etiológiai hipotéziseknek meg kell magyarázniuk azt is, hogy a szubklinikai prosztatarák miért mindenütt jelen van, míg a klinikai prosztatarák nem.
- Rágógumi - áttekintés a ScienceDirect témákról
- Funkcionális ital - áttekintés a ScienceDirect témákról
- Bőr vasculitis - áttekintés a ScienceDirect témákról
- Diétás bevitel - áttekintés a ScienceDirect témákról
- Funkcionális emésztőrendszeri rendellenességek - áttekintés a ScienceDirect témákról