A prosztatarák zsíroldala
Giorgia Zadra
1 Orvosi Onkológiai Osztály, Dana-Farber Cancer Institute, Harvard Medical School, Boston, MA, USA
Cornelia Photopoulos
1 Orvosi Onkológiai Osztály, Dana-Farber Cancer Institute, Harvard Medical School, Boston, MA, USA
Massimo Loda
1 Orvosi Onkológiai Osztály, Dana-Farber Cancer Institute, Harvard Medical School, Boston, MA, USA
2 Molekuláris Onkológiai Patológiai Központ, Dana-Farber Cancer Institute, Harvard Medical School, Boston, MA, USA
3 Patológiai Osztály, Brigham és Női Kórház, Harvard Medical School, Boston, MA, USA
4 A Broad Institute, Cambridge, MA, USA
5 Rákkutatási részleg, King's College London, London, Egyesült Királyság
Absztrakt
Bevezetés
A lipidek szerepe a rákban
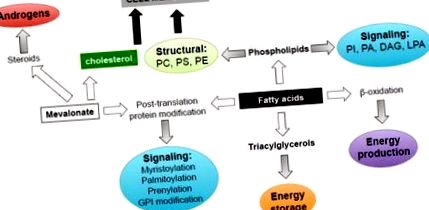
A lipidek a tumorbiológia számos aspektusához hozzájárulnak biológiai szerepeik sokfélesége miatt (1. ábra). Először a biológiai membránok építőköveiként támogatják a rákos sejtek magas proliferációs arányát. Számos endogén úton szintetizált zsírsavat (FA) észtereznek foszfolipidekké, amelyek sarkalatos szerkezeti lipideket biztosítanak, megkönnyítik a detergens-rezisztens membrán mikrodomének kialakulását a ráksejtekhez szükséges jelátvitelhez, sejten belüli kereskedelemhez, polarizációhoz és migrációhoz [9, 14]. A membránszintézis fontosságát a rákos sejtekben hangsúlyozta az a megfigyelés, hogy a foszfatidilkolin és a foszfatidil-etanolamin (a sejtmembránokban található fő foszfolipidek) szintéziséhez szükséges enzim, a kolin-kináz expressziója és aktivitása több szövet daganataiban megnő. beleértve a PCa-t is, és korrelál a rossz prognózissal [15, 16]. A kolin-kináz túl expresszálódása esetén onkogén aktivitása van, ami arra utal, hogy a foszfolipidek szintézise az átalakulás sebességét korlátozza [17, 18].
A lipidek számos biológiai funkciót töltenek be a rákos sejtekben, beleértve az energiaellátást és -tárolást, a membránépítő elemeket, a jelzőmolekulákat, a fehérje transzláció utáni módosításait, a szteroidok szubsztrátjait a PCa-sejtek túlélésének, szaporodásának, migrációjának és inváziójának támogatására. PI, foszfatidil-inozit, PA, fopshatidinsav; DAG, diacilglicerin; LPA, lizofoszfatidsav; PC, foszfokolin; PS, foszfatidil-szerin; PE, foszfatidil-etanol-amin; GPI, glikozil-foszfatidil-inozit.
A lipid anyagcsere megváltozása prosztatarákban
Az FA bioszintézisének szabályozása és pleiotróp szerepe a rákos sejtekben
a. Energia homeosztázis
Mint már említettük, a rákos sejtek nagy mennyiségű glükózt használnak energetikai és bioszintetikus célokra [8], ami magas laktáttermelés és szekréciót eredményez, ami a tumor mikrokörnyezetének savasodásához vezet [65]. Így lehetséges, hogy a lipidszintézis szénelnyelőként működhet a piruvát feleslegének megkötésére és a laktáttermelés elkerülésére az intracelluláris pH egyensúlyának megteremtése érdekében. Ezenkívül hozzájárulhat a redox egyensúlyhoz is. Valóban kimutatták, hogy a PCa-sejtekben az FA szintézis útjának oxidáló ereje olyan nagy, hogy a redox előnyösebben stabilizálódik (jobban oxidálódik), mint a normál prosztata sejtekben. Ez a FASN által elősegített redox javulás annak ellenére következik be, hogy a rosszindulatú sejtek O2-korlátozottabbak, ezért több HIF-1α és hipoxiával szabályozott gént expresszálnak [66]. Ezenkívül a hipoxiás sejtekben a lipidszintézisből származó NADP + szintén növelheti a glikolízis fenntartásához szükséges citoplazmatikus NAD + rendelkezésre állását, a nemrégiben javasolt mitokondrium-citoszolos NADPH transzfernek köszönhetően [67]. A lipidszintézis tehát kiaknázná oxidáló erejét, hogy javítsa a citoplazma és a mitokondrium redox egyensúlyát, és hozzájárul a glikolízis maximalizálásához.
b. Ellenáll az oxidatív stressznek
Egy nemrégiben tömegspektrometrián alapuló foszfolipid elemzés feltárta, hogy a lipogén fenotípust mutató prosztatarákok (a megnövekedett FASN expresszió miatt) a telített és egyszeresen telítetlen FA-k (SFA-k és MUFA-k) következetes növekedését és a többszörösen telítetlen fajok csökkenését mutatják a normál szövetekhez képest [68]. . A lipogén fenotípus visszafordítása a kismolekulát gátló szorbáf A vagy siRNS által jelentősen csökkenti a telített és egyszeresen telítetlen foszfolipid fajokat, és növeli a többszörösen telítetlen relatív mértéket. Úgy tűnik, hogy ez az SFA-kat támogató lipogén kapcsoló megvédi a rákos sejteket az oxidatív stressztől és a doxorubicin által kiváltott sejthaláltól [68]. Ezenkívül az elsősorban SFA-kat tartalmazó foszfolipidek hajlama lipid tutajokká/detergens-rezisztens membránokká szegregálódni jelentősen megváltoztatná a jelátviteli kaszkádokat, a vezikuláris kereskedelmet és a sejtek migrációját [69].
c. Sejtpolaritás
A legújabb bizonyítékok azt mutatják, hogy a de novo lipogenezis és különösen az SREBP-1c aktiválása torzítja a sejtek polarizációját és elnyomja a primer cilium képződését [70]. Ez a mikrotubulus alapú szenzoros organella szinte minden sejttípus felszínén expresszálódik, és sok rákban elveszik, beleértve a PCa-t is [71]. Mivel az elsődleges cilium több jelátviteli utat koncentrál és szabályoz, az elsődleges cilium SREBP által kiváltott elnyomása kevésbé teheti függővé a rákos sejteket a külső jelektől és az anti-növekedési jelektől. Ez hozzájárulhat a rákkal társított jelátviteli utak, például a Wnt jelátvitel konstitutív aktiválódásához is, amelyről további beszámolók szerint a PCAS-sejtekben FASN-indukálta palmitoilezés aktiválja [27]. Az elsődleges cilium SREBP-1 és de novo lipogenezissel történő elnyomása szintén közvetlen fizikai korlátozást szabadíthat fel a sejtciklusban, mivel az elsődleges cilium ugyanazokból a szerkezeti elemekből áll, amelyeket a mitotikus orsó kialakításához használnak [72]. Ezek a megállapítások nemcsak új betekintést nyújtanak a de novo lipogenezis PCa sejtekben betöltött szerepébe, hanem indokolást nyújtanak a lipogenezis inhibitorok daganatellenes szerként és kemoterápiás szenzibilizátorként történő alkalmazásához.
Az FA átalakításának szabályozatlansága
Az FA katabolizmusának változásai
a) Fokozott FA-bontás
b) Fokozott β-oxidáció
Fokozott koleszterinszint és endogén szteroid szintézis a PCa-ban
A koleszterin fokozott felhalmozódása a PCa-sejtekben
A sztatingyógyszereket a máj HMGCR-jének, a koleszterinszintézis sebességkorlátozó enzimjének gátlására tervezték, és eredetileg szív- és érrendszeri betegségek kezelésére javallták; a sztatin gyógyszerek hosszú távú alkalmazása azonban jótékony hatást mutatott a fejlett PCa kockázatának csökkentésében [áttekintve 96-ban]. Ezért jelentős erőfeszítéseket tettek a sztatinok hatásmechanizmusainak megértésére [áttekintve a 106–108-ban].
Fokozott intra-tumorális szteroidogenezis
A fejlett PCa-kban a de novo szteroidogenezis gátlására irányuló új gyógyszereket nemrég fejlesztettek ki ígéretes eredménnyel [3]. 2011-ben az FDA jóváhagyta az abirateron-acetátot, a CYP17A gátlót CRPC-vel rendelkező férfiak kezelésére, akik korábban docetaxelt kaptak. 2012. december 10-én az FDA kiterjesztette prednizonnal együtt történő alkalmazását a CRPC-ben szenvedő férfiak kemoterápia előtti kezelésére [http://www.fda.gov].
Az onkogének és a tumorszuppresszorok szorosan szabályozzák a de novo lipogenezist
Az AMPK egy master energiaérzékelő, amely reagál a megnövekedett AMP/ATP arányra az ATP-generáló utak bekapcsolásával, miközben kikapcsolja az ATP-fogyasztókat, beleértve az mTORC1-et és a lipogenezist is. Az LKB1 tumorszuppresszor negatívan szabályozza a lipogén enzimeket azáltal, hogy aktiválja a downstream cél AMPK-t. Az AMPK transzkripciós és poszttranszlációs szinten egyaránt gátolja a FASN, ACLY, ACC, SCD1 és HMGCR enzimet [135, 136]. Ez utóbbi az ACC és a HMGCR közvetlen gátló foszforilezésével történik. A lipogén enzimek transzkripciójának AMPK által közvetített redukcióját az SREBP-1 közvetlen foszforilezésével érhetjük el, megakadályozva ezzel proteolitikus aktiválódását vagy expressziójának csökkentését [137, 138] (3. ábra).
A metabolikus szindrómában (SM), a magas fokú PCa fokozott kockázatával járó metabolikus betegségben szenvedő betegeknél [139, 140] az LKB1/AMPK útvonal deregulációját mutatják [141], ezáltal fokozott lipogenezis fordulhat elő. Más tumorszuppresszorok, például Rb és p53 is részt vesznek a lipogenezis szabályozásában. Valójában az Rb tumorszuppresszor inaktiválása (az elsődleges PCa 5% -ában és az előrehaladott daganatok 37% -ában számolt be) fokozza az onkogén N-Ras izoprenilációját és aktiválódását az SREBP-1 és 2 indukciója révén [142]. Ezenkívül a genom egészére kiterjedő expressziós elemzés a mevalonát útvonalat szignifikánsan felfelé szabályozottnak találta a p53 mutáns sejtekben (ami a PCas kb.
A lipid anyagcsere zavarása terápiás megközelítésként
Úgy tűnik, hogy az FA és a mevalonát szintézis útvonalainak aktiválása mind a prosztata tumorgenezisében, mind a progresszióban elengedhetetlen. Ezenkívül a lipidszintézis különösen aktív metasztatikus, kasztrálódásnak ellenálló betegségben. Így jelentős erőfeszítéseket tettek a lipogén enzimek és kulcsfontosságú upstream szabályozóik megcélzására. Két vonzó cél a FASN FA szintézisének kulcsfontosságú enzime és az AMPK mesterséges metabolikus szenzor (4. ábra).
Sok erőfeszítést fordítottak a de novo FA és a koleszterinszintézis gátlóinak, valamint a daganaton belüli de novo szteroidogenezis gátlóinak a rákterápiában történő alkalmazására. Ebben a diagramban az FA és a koleszterin szintézisének inhibitorait piros, illetve kék négyzettel ábrázoljuk. A két útvonalhoz tartozó enzimeket megfelelő vörös és kék színnel emelik ki. A közelmúltban kifejlesztettek a zsírsav-szintáz (FASN), az AMP-aktivált protein-kináz (AMPK) és az androgének tumoron belüli szintézisét célzó új kismolekulákat. ACLY, ATP-citrát-liáz; ACC, acetil-CoA karboxiláz; ACAT, acetil-CoA acetiltranszferázok; HMGCS, HMG-CoA szintáz; HMGCR, HMG-CoA reduktáz; SCD1, sztearoil-CoA deszaturáz 1; CYP11A1, p450, 11. család, A alcsalád, 1. polipeptid; CYP17A1; p450, 11. család, A alcsalád, 1. polipeptid; 3β-HSD1, 2, 3-p-hidroxi-szteroid-dehidrogenáz/Δ-5-4 izomeráz 1,2; 17p-HSD, 17p-hidroxi-szteroid-dehidrogenáz; SRD5A 1,2, szteroid-5a-reduktáz 1, 2.
A FASN gátlói
Jelenleg újabb, hatékonyabb FASN-gátlókat azonosítottak gyógyszerkémiai programok és nagy áteresztőképességű szűrés révén: az Astra Zeneca kifejlesztett egy sor bisamid-származékot, a Merck egy sor 3-aril-4-hidroxi-kinolin-2 (1H) -on-származékot, és A GlaxoSmithKline előállította a GSK837149 nevű FASN-gátlót, amelynek nanomoláris hatékonysága [áttekintve 146-ban]. A GlaxoSmithKline tudósai a közelmúltban szabadalmaztatták az új triazolon-származékok mint FASN-gátlók molekuláris szerkezetét is (US20120316151 A1, www.google.com/patents). Legjobb tudomásunk szerint azonban a rendelkezésre álló FASN-gátlók egyike sem szerepel rák klinikai vizsgálatokban. A FASN-gátlók klinikai kudarcának egyik fő oka eddig a FASN-gátláshoz kapcsolódó anorexia és tartós testsúlycsökkenés volt. Ezenkívül néhány elérhető FASN-gátlót, például az Orlista-t, gyengén felszívja a gyomor-bél traktus. A másik kérdés az a megválaszolatlan kérdés, hogy vajon az exogén lipidek képesek-e megmenteni a lipidszintézis gátlásának hatásait.
A lipogenezis egyéb inhibitorai
AMPK aktivátorok
Mivel az AMPK a sejtek anyagcseréjének és a növekedés szabályozásának központja, ideális terápiás célpontot jelent a metabolikus betegségek, valamint a rák számára. Számos olyan gyógyszerről, amelyet nagyrészt cukorbetegség és más anyagcsere-betegségek kezelésében használnak, beleértve a metformint, kimutatták, hogy főként az AMPK-aktiváció révén csökkentik a rák kockázatát [152], és állati modellekben csökkentik a tumorsejtek szaporodását és a tumor növekedését [áttekintve 146-ban]. . Az AMPK aktivátorok két osztályba sorolhatók: a) közvetett aktivátorok, beleértve biguanidokat és tiazolidindionokat b) közvetlen aktivátorok, beleértve az AICAR-ot és a kis molekulák utolsó generációját.
Közvetett AMPK aktivátorok
Metformin
Tiazolidindionok
A metforminhoz hasonlóan a tiazolidinedionokat (TZD) klinikailag használják a 2-es típusú cukorbetegség kezelésére. Aktiválják az AMPK-t valószínűleg a légzési lánc I komplexének gátlásán keresztül [160]. Jelenleg rákellenes szerként végzett tevékenységük értékelés alatt áll. Valójában a CZP 52608 TZD származékról kimutatták, hogy erős citosztatikus aktivitással rendelkezik az LNCaP sejtekben azáltal, hogy csökkenti a sejtproliferációt és befolyásolja a sejtciklus eloszlását a sejtciklussal kapcsolatos gének expressziójának modulálásával [161].
Közvetlen AMPK aktivátorok
AICAR
A nukleozid-5-amino-imidazol-4-karboxamid-1-β-ribofuranozid (AICAR) volt az első olyan vegyület, amelyről beszámoltak arról, hogy intakt sejtekben és in vivo aktiválja az AMPK-t, és széles körben alkalmazták állatokban az AMPK-aktiváció downstream hatásainak vizsgálatára. Az AICAR-ot adenozin-transzporterek veszik fel a sejtekbe, majd az adenozin-kináz átalakítja a monofoszforilezett ZMP-származékká, amely az 5′-MP analógja, és így utánozza számos sejtes hatását. Az AICAR gátolja a tumorsejtek növekedését in vitro és in vivo. Különösen kimutatták, hogy gátolja a PCa sejtek proliferációját és a tumor növekedését a PCa xenograft modellekben [157, 162]. Az AICAR azonban nem teljesen specifikus az AMPK-ra, AMPK-független hatást fejt ki elsősorban az AMP-szabályozott enzimekre és a mitokondriális oxidatív foszforilációra. Ráadásul korlátozott az orális biohasznosulása, ezért rossz jelölt az emberi szervezetben történő hosszú távú alkalmazásra [163]. Ennélfogva aktívan keresik az új, kis molekulájú, csökkentett célhatású AMPK aktivátorok tervezését, és az AMPK alegységek kristályszerkezetének publikálása jelentősen elősegítette [164].
Kis molekulájú AMPK aktivátorok
A lipid-dereguláció kihasználása a PCa diagnosztizálásához és terápiájához szükséges új képalkotó technikák kifejlesztése érdekében
Az egész test lipidanyagcseréje és a prosztatarák
Elhízás, metabolikus szindróma és PCa
Étrendi zsír- és prosztatarák
Záró megjegyzések
A lipidómás technológiák megjelenésének és a terület iránti érdeklődésnek köszönhetően jelentős felismerések gyűlnek össze a lipidanyagcsere rákban betöltött szerepéről. Egyértelművé válik, hogy a de novo és az étrendi lipidek egyaránt fontos szereplők a PCa fejlődésében és progressziójában. Különösen a de novo lipogenezis a rákos sejtek membrán lipidösszetételének modulálásával messze meghaladja a membrán biogenezisének növekedését, és jelentős szerepet játszik olyan folyamatokban, mint például a jelátvitel, a tápanyagok szállítása, az ioncsatorna aktivitása, a sejthalál jelzése és energia-anyagcsere. Ezenkívül számos bizonyíték hangsúlyozta, hogy a lipid-anyagcsere diszregulációja a PCa-ban nem korlátozódik a megnövekedett lipid-bioszintézisre, hanem magában foglalja az aberrált lipid-átalakulást, az FA-katabolizmust és a mevalonát-út közötti intermedierek szintézisét, amelyek nagymértékben részt vesznek a rák és a különösen hormonálisan függő daganatok, például a prosztata. E változások következményeinek részletesebb megértése az a cél, hogy a lipid-anyagcserét a jövő rákkutatásának középpontjába helyezzük, ideértve a PCa-t is, és új terápiás és diagnosztikai utakat nyithat meg.
Fénypontok
Váltás a lipid anyagcserében a PCa fejlődése és progressziója alatt
A de novo lipogenezis célzása a PCa terápiás stratégiájaként
- A prosztatarák terhe Kanadai Kanadai Urológiai Egyesület folyóiratban
- Az ascites világos oldala petefészekrákban
- Az „Éclair-diéta” és a prosztatarák; Naturopathic Doctor News and Review
- A hideg vírus felszabadítása a rák elpusztításához MD Anderson Cancer Center
- Miért olvassák az evangéliumot az Oltár bal oldalán; liturgikus srác