A quinoa és az amarant kiegészített étrend hatékony összehasonlítása az étvágy kontrollálásában; biokémiai vizsgálat patkányokon
M. V. Mithila
Biokémiai és nanotudományi fegyelmi védelmi élelmiszer-kutató laboratórium (DFRL), Siddhartanagar, Mysore-11, India
Farhath Khanum
Biokémiai és nanotudományi védelmi élelmiszerkutató laboratórium (DFRL), Siddhartanagar, Mysore-11, India
Absztrakt
A vizsgálat célja két jelenlegi cinulációs fehérje-helyettesítő hatékonyságának felmérése volt; quinoa és amarant a patkányok rövid távú táplálékfelvételének és jóllakottságának szabályozásában. A kísérleti patkányokat három csoportba soroltuk (n = 8 csoportonként), és táplálékkal tápláltuk a kazeint, a quinoát és az amarantot, mint fő fehérjeforrást, kontrollként a kazein-étrendet. A kísérlet végén azt figyelték meg, hogy a quinoa és az amarant kiegészített étrendet elfogyasztó patkányok kevesebb táplálékot fogyasztottak (p Kulcsszavak: Quinoa, Amarant, plazma glükóz táplálékfelvétel, hormonok, patkányok
Bevezetés
Az étrendi összetevők közötti változatosság egyértelműen és hatékonyan elősegíti a változatos fiziológiai reakciókat. Egyes ételek hatékonyabban csökkenthetik az étvágyat, mint mások, és meghosszabbíthatják a következő étkezés bevitelét. Ennek oka elsősorban az étkezést tartalmazó makrotápanyagok hatása. Ezek a beérkező makrotápanyagok érzékenyek a testünk által kibocsátott perifériás jelekre, legyen az éhezés vagy jóllakottság. Ezek a jelek segítenek a bél agy tengelye mentén az információk összehangolásában az étrendből származó tápanyagok optimális felhasználása és tárolása érdekében.
Figyelembe véve a különféle orexigén és szatietogén jelek komplex kölcsönhatását, valamint az energia homeosztázis szabályozásához szintetizált/metabolizált vérváltozók ezt követő kibontakozását, e vizsgálat elsődleges hipotézise az volt, hogy a quinoa és az amarant jóllakottsági hatását a biológiai a rövid és hosszú távú táplálékfelvétel fő közvetítőinek reakciómintái. Ezt a két fehérjében gazdag gabonafélét hasonlítottuk össze a hagyományos tejfehérje, a kazein ugyanazon paraméterekre gyakorolt hatásával.
Anyagok és metódusok
Anyagok
A quinoa és az amarant magjait egy egészséges élelmiszerboltból vásárolták, és finom porra őrölték, mielőtt összekeverték volna az étrenddel. A diéták készítéséhez felhasznált ásványi keveréket az SRL vegyi anyagoktól szerezték be (kód: 1940128), és követik az U.S.P. XIV. A vitaminkeveréket a Hyderabad Nemzeti Táplálkozástudományi Intézet állati étrendekhez, laboratóriumi technikákhoz készített kézikönyvében meghatározott összetétel szerint készítették el. A plazmahormonok elemzésére szolgáló készleteket a BioVendor Laboratorni medicina a.s-től, Csehországtól vásároltuk. A lipidprofil (trigliceridek, összkoleszterin, HDL, LDL) meghatározására szolgáló készleteket az Agappe diagnosztikától (India) vásároltuk. Az összes többi vegyszer analitikai minőségű volt.
Az étrend elkészítése
A diétákat az 1. táblázatban megadott következő séma szerint állítottuk össze. A fehérjeforrást mindhárom étrendben, azaz kontroll kazeint, quinoa lisztet a quinoa étrendben és az amarant lisztet az amarant étrendben az összes étrendi alkotóelem 20% -ában rögzítettük. Mindhárom étrend fehérje-, zsír-, rosttartalma és energiasűrűsége a 2. táblázatban található .
Asztal 1
Az állati étrend elkészítésének rendszere
| Kukoricaszarka | 68 |
| Kazein/Quinoa/Amaranth | 20 |
| Vitamin keverék | 02 |
| Ásványi keverék | 04 |
| Földimogyoró olaj | 05 |
| Csukamájolaj | 01 |
| Dextróz | 04 |
| DL-metionin | 0,3 |
| α tokoferol | 0,01 |
2. táblázat
Az energiasűrűség, a fehérje, zsír és rost teljes mennyisége az étrendben
| Fehérje (g/kg étrend) | 124,4 | 135.4 | 140.2 |
| Zsír (g/kg étrend) | 24.6 | 23.1 | 23.5 |
| Rost (g/kg étrend) | 23.4 | 24.4 | 25.0 |
| Energia (kcal/g étrend) | 3.71 | 4.41 | 4.60 |
Mivel ez a tanulmány a makrotápanyagok összetételének és az étvágyat szabályozó biomolekulákra gyakorolt hatására helyezi a hangsúlyt, három étrend energia sűrűségének enyhe változásait nem vették figyelembe.
Állatkísérletek
Az összes kísérleti protokollt az Állati Kísérletek Etikai Bizottsága hagyta jóvá. A Wistar albino törzsből származó hím patkányokat (házi állattartó telepről, DFRL, India) 100-120 g tömegűek higiéniai körülmények között tartották és standard rágcsáló-étrenden tartották. Összesen 24 állatot lemértünk, és 3, egyenként 8 állatból álló csoportba soroltuk. A patkányokat 3 csoportba soroltuk oly módon, hogy mindegyik csoport átlagos és teljes testtömege hasonló legyen a többi csoporthoz. A kísérlet megkezdése előtt az összes patkányt külön-külön rozsdamentes acél hálós ketrecekben helyezték el, egyedi táplálékcsészékkel a lemért étrendekhez, és könnyű, ellenőrzött helyiségben (12 órás világos/sötét ciklus) helyezték el, szabadon hozzáférve az ivóvízhez. Az összes állatot akklimatizációs periódusként 7 napig kontroll étrenden tartottuk, majd etetési szokásuk alapján csoportosítottuk át. Az I. csoport kazein diétával etetett és kontrollként tartottuk, míg a másik két csoport quinoa és amarant diétát kapott. A táplálékfelvételt napi szinten rögzítették, ahol a súlygyarapodást az egyes patkányok által heti átlagosan megnövelt tömegként számították ki.
Vér- és plazmavétel
15 nap elteltével a patkányokat egy éjszakán át éheztettük, és a következő napon a vért szúrás útján heparinizált kapilláris csövek segítségével vettük fel. Mind éhomi, mind étkezés utáni vérmintákat nyertünk. A plazmát a vérminták centrifugálásával 2500 fordulat/perc sebességgel 15 percig elválasztottuk, és további elemzésig -80 ° C-on tároltuk.
A vércukorszint becslése
A vérmintákat rendszeres időközönként a patkányok farka hegyének megpattintásával végeztük. Az ARKRAY digitális glükométert használták mind az éhomi, mind az étkezés utáni vércukor-válasz meghatározására. A glükózkoncentrációt mg/dl vérben adtuk meg.
A Ghrelin, a leptin és a kolecisztokinin becslése a plazmában
A BioVendor Rat Unacylated Ghrelin ELISA kettős antitestes szendvics technikán alapul. A készlethez mellékelt lemez üregeit a ghrelin C-terminális részére specifikus monoklonális antitesttel vonjuk be. Ez az antitest megkötődik a lyukakba bejuttatott bármilyen grelinnel (standard vagy minta). A lyukakhoz hozzáadjuk az acetil-kolin-észteráz (AChE) - Fab'-konjugátumot is, amely felismeri az acilálatlan ghrelin N-terminális részét. Ez lehetővé teszi, hogy a két antitest szendvicset képezzen a patkány acilálatlan ghrelin különböző részeihez kötődve. A szendvicset rögzítik a lemezen, így a felesleges reagensek lemoshatók. A patkány acilálatlan ghrelin koncentrációját az Ellman-reagens alkalmazásával az immobilizált AChE enzimatikus aktivitásának mérésével határozzuk meg. Az AChE nyomjelző az Ellman-reagensre hatva sárga vegyületet képez. A szín intenzitása, amelyet spektrofotometriával határozunk meg, arányos a patkány acilálatlan ghrelin mennyiségével, amely a kútban jelen van az immunológiai inkubáció során.
A BioVendor Mouse és Patkány Leptin ELISA-ban a standardokat és a mintákat az egér elleni leptin antitesttel előzetesen bevont mikrolemez üregekben inkubáljuk. 60 perces inkubálás és mosás után biotinnal jelölt poliklonális anti-egér leptin antitestet adunk a lyukakhoz, és immobilizált antitest-leptin komplextel 60 percig inkubáljuk. Újabb mosás után streptavidin-HRP konjugátumot adunk hozzá. 30 perces inkubálás és az utolsó mosási lépés után a maradék konjugátumot hagyjuk reagálni a szubsztrátoldattal (TMB). A reakciót savas oldat hozzáadásával állítjuk le, és megmérjük a kapott sárga termék abszorbanciáját. Az abszorbancia arányos a leptin koncentrációjával. Standard abszolút görbét készítettünk az abszorbancia értékek ábrázolásával a standardok koncentrációival szemben, és ismeretlen minták koncentrációit határoztuk meg ezzel a standard görbével
DRG® Cholecystokinin (CCK) (humán, patkány, egér) ELISA; ebben a kitben az immunlemezt előzetesen szekunder antitesttel vonják be, és a nem specifikus kötőhelyek blokkolva vannak. A szekunder antitest kötődhet az elsődleges antitest (peptid antitest) Fc fragmentumához, amelynek Fab fragmensét mind a biotinilezett peptid, mind a mintában lévő standard vagy célzott peptid megköti. A biotinilezett peptid képes kölcsönhatásba lépni a sztreptavidin-torma-peroxidázzal (SA-HRP), amely a 3,3 ', 5,5'-tetrametil-benzidinből (TMB) és a hidrogén-peroxidázból álló szubsztrátoldatot kék színű oldat előállítására katalizálja. Az enzim-szubsztrát reakcióját hidrogén-klorid (HCI) állítja le, és az oldat sárgára változik. A sárga intenzitása egyenesen arányos a biotinilezett peptid-SA-HRP komplex mennyiségével, de fordítottan arányos a standard oldatokban vagy mintákban lévő peptid mennyiségével. Ennek oka a biotinilezett peptid és a standard oldatokban vagy mintákban lévő peptid kompetitív kötődése a peptid antitesthez (primer antitest). Ennek megfelelően hoztuk létre az ismert koncentrációjú peptid standard görbéjét. A mintákban ismeretlen koncentrációjú peptideket erre a standard görbére extrapolálással határoztuk meg.
A plazma lipidprofil becslése (trigliceridek, összkoleszterin, HDl, LDL)
A plazma trigliceridek, az összes koleszterin, a HDL és az LDL koncentrációit az AGAPPE Diagnostics, Trissur, Kerala, INDIA kereskedelemben kapható kitjeivel leírt protokoll szerint határoztuk meg, az Erba Mannheim (EM 200), Németország automatizált kémiai elemző rendszerével.
A szabad zsírsavak (FFA) becslése a plazmában
A szabad zsírsavakat Falholt és munkatársai módszerével becsültük meg. (1973) a minta térfogatának és inkubációs idejének kismértékű módosításával. Az alkalmazott extrakciós közeg kloroform-heptán-metanol keveréket tartalmaz foszfátpufferrel (pH 6,4). Ez az extrakciós keverék lehetővé teszi az FFA elegendő extrahálását a szérumból, és elkerülhető az interferáló szerekkel való szennyeződés. Az FFA rézszappanjait kolorimetriásan határozzuk meg difenilkarbaziddal 550 nm-en.
Statisztikai analízis
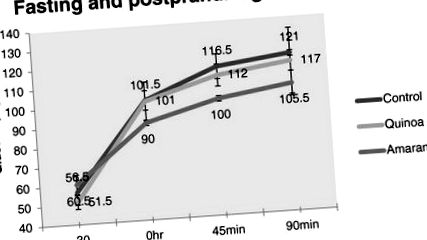
Minden adat átlag SD-ként van ábrázolva (n = 8). Az ANOVA egyik módja a kontrollcsoport és a különféle étrenddel etetett tesztcsoportok közötti lehetséges különbségek meghatározása volt. A statisztikai adatok elemzéséhez mikro-eredetű szoftvert használtunk. A p 3 értékek, bár szignifikánsak (p 1) szignifikánsan csökkentek az amarant csoportban (p 4 képet ad arról, hogy a három különböző étrend hogyan befolyásolta ezeket a hormonokat az éhomi és étkezés utáni körülmények között. Nyilvánvaló, hogy az amarant dominálta a jelenetet, amikor a szabályozásról volt szó. mind a három hormon szignifikánsan (p 1), ezáltal korlátozva az élelmiszer- és kalóriafogyasztást. Az amarant csoportban 15% -os javulás volt megfigyelhető a kontrollhoz képest 90 percnél, ahol a quinoa csoportban csak 3,4% -os javulás volt tapasztalható. százalékos javulást a képlet ad (2. ábra)
Az átlagos vércukor-koncentráció az idő függvényében három különböző táplálékkal etetett patkányokban
- Csináljon magas fehérjetartalmú étrendet a jóllakottság és az étvágycsökkentő orvosi hírek közleménye Egészségügyi hírek és
- A növekedés, a szérum biokémia és az n-6 zsírsav-anyagcsere összehasonlítása táplált patkányokban
- A testtípusú étrendek összehasonlítása
- Két fehérjében és szénhidrátban alacsony zsírtartalmú étrend összehasonlítása a pszichológiai jólét szempontjából
- Rostban gazdag táplálékkal etetett patkányok limfocitáinak és makrofágjainak zsírsavösszetétele Összehasonlítás