A Smac utánzó szerek veleszületett immuningerekkel kombinálva tökéletes citokin-vihart hoznak létre a daganatsejtek elpusztítására
Shawn T Beug
1 Solange Gauthier Karsh Molekuláris Genetikai Laboratórium; Apoptózis Kutatóközpont; Kelet-Ontario Kutatóintézet Gyermekkórháza; Ottawa, Kanada
Eric C LaCasse
1 Solange Gauthier Karsh Molekuláris Genetikai Laboratórium; Apoptózis Kutatóközpont; Kelet-Ontario Kutatóintézet Gyermekkórháza; Ottawa, Kanada
Robert G Korneluk
1 Solange Gauthier Karsh Molekuláris Genetikai Laboratórium; Apoptózis Kutatóközpont; Kelet-Ontario Kutatóintézet Gyermekkórháza; Ottawa, Kanada
2 Biokémiai, Mikrobiológiai és Immunológiai Tanszék; Ottawa Egyetem; Ottawa, Kanada
Absztrakt
Kettős immunterápiás megközelítés, amely apoptózis (IAP) fehérje-antagonisták kis molekulájú inhibitorait és veleszületett immun ingereket kombinálva alkalmazza, nagyon szinergikusnak és hatásosnak bizonyult állatdaganatos modellekben. Ez a stratégia legyőzi az egyes szerek terápiájának számos korlátját, és eredményeink azt sugallják, hogy a kombináció könnyen és hatékonyan lefordítható a klinikára.
A pro-apoptotikus fehérje kémiai utánzói, a DIABLO, ismertebb nevén a kaszpázok második mitokondrium-eredetű aktivátora (Smac), kis molekulájú antagonisták, amelyek elnyomják az apoptózis (IAP) fehérjék kulcssejtjeit - a celluláris IAP1 (cIAP1) és a celluláris IAP2 (cIAP2) ) - azáltal, hogy megkötik és megcélozzák őket a lebomlás érdekében. A vegyület affinitásától, specificitásától és dózisától függően a Smac utánzó szerek szintén antagonizálják vagy egy másik apoptotikus szuppresszor fehérje, X-kapcsolt IAP (XIAP) lebomlásához vezetnek. Ezek közül a Smac-utánzók közül jelenleg rákellenes szerként korai fázisú klinikai vizsgálatokat végeznek. A cIAP1/cIAP2, a tumor nekrózis faktor (TNF) receptor szupercsalád két kritikus szabályozója és a nukleáris faktor-κB (NF-κB) szignalizáció Smac mimetikusan kiváltott vesztesége szenzibilizálja a rákos sejteket a TNFα- vagy TNF-rokon apoptózist kiváltó TNF ligandumra (azaz VONAT) által közvetített halál. 1 Fontos, hogy a Smac mimetikumok a maximális hatékonyság érdekében megkövetelik ezeknek a halál-megelőző citokin ligandumok jelenlétét. A mai napig azonban még nem kell kidolgozni azokat a módszereket, amelyek biztonságos és hatékony módon biztosítják ezeknek a citokineknek az eredetét a Smac-utánzó szerekkel kezelt daganatos betegek számára. Ez a cselekvés fogalmilag fokozhatja a daganatellenes hatékonyságot.
Nemrégiben fedeztük fel, hogy a daganatot hordozó egerek onkolitikus vírussal történő fertőzése vagy alternatív megoldásként szintetikus immunimimetikummal történő kezelés elegendő intenzitású citokin-vihart (beleértve a TNFα-t és a TRAIL-t is) okozhat ahhoz, hogy elpusztítsák a különböző sejtekkel együtt kezelt tumorsejteket. egy- vagy kétértékű Smac-utánzók (egy vagy két IAP-kötő motívumot tartalmaznak). 2 Többféle kezelésre-refrakter rákmodellben in vivo, például emlő- és vastagbélrákban mutattuk ki a daganatsejtek szinergikus elpusztítását, ami megnövekedett túléléshez és egyes esetekben tartós kúrákhoz vezetett. Ezenkívül számos más típusú rosszindulatú daganat (például vese, glioblastoma és myeloma multiplex) kezelése szinergikus kombinatorikus aktivitást mutatott in vitro. Ez a közzétett tanulmány a következő fő szempontokat is bemutatta:
1. Az onkolitikus vírussal való Smac mimetikus szinergia kifejezetten a vesiculovírusok osztályán belül erősödött meg, amelyet tanulmányunkban az onkolitikus rhabdovírusok két példája, a vezikuláris stomatitis vírus (VSV) és a Maraba in vitro vizsgálatokkal jellemeztek. Az attenuált onkolitikus rhabdovírusok negatív szenzorú RNS vírusok, amelyek gyorsan replikálódnak és erős interferon (IFN) választ eredményeznek. Ez az immunválasz korlátozza a vírus terjedését, ezáltal elnyomja az onkolitikus vírus rákölő hatékonyságát, de megvédi a gazdaszervezetet a virémiától. 3 A vírusfertőzés, a lízis, a tumorantigének és a károsodáshoz kapcsolódó molekuláris mintázatok (DAMP) felszabadulása azonban végül kiváltja az immunválaszt, hogy elősegítse a daganatok felszámolását. 4
2. A kombinációs hatás nem igényelte kizárólag a citokinek helyi termelését a daganat helyén, így azt tapasztaltuk, hogy a citokinek szisztémás termelése rendkívül hatékony. Ezenkívül a kombinációt az állatok jól tolerálták, elfogadható és átmeneti testsúlycsökkenéssel.
3. A rák citotoxikus hatásait különféle citokinek, nevezetesen az I. vagy II. Típusú IFN, valamint a TNFα vagy a TRAIL közvetítette. Ez volt az első demonstráció a Smac mimetikus szinergiájáról az IFN-ekkel. Eredményeink felvetik a rekombináns IFN-t és Smac-utánzó szereket tartalmazó meglévő immunterápiák kombinációjának lehetőségét a rák kezelésében.
4. A kombinatorikus kezelés rákellenes hatását elsősorban a veleszületett immunválasz közvetítette. Nem tudtuk azonban teljesen kizárni az adaptív válasz részvételét, mivel az immunrendszer ezen ága általánosan ismert, hogy hozzájárul a hosszú távú remisszióhoz vagy gyógyuláshoz. Dougan és munkatársai egy külön jelentésben azt mutatják, hogy a Smac utánzó szerek fokozzák a T-sejt daganatellenes immunitást egy rákos vakcina egérmodellben, 5 ami arra utal, hogy a Smac utánzó szerek különféle mechanizmusok révén számos jótékony tumorellenes immunhatással járhatnak. Valójában az IAP-k az immunitás számos aspektusát szabályozzák (áttekintést lásd a 6. hivatkozásban), és a Smac-utánzókkal való IAP-antagonizmusnak daganatos betegeknél várhatóan számos immun-közvetített rákellenes hatása lesz.
5. A veleszületett immunválasz kiváltó onkolitikus vírus helyettesíthető nem fertőző immunstimuláló molekulákkal, például poli (I: C) vagy CpG oligonukleotidokkal. Ezek a szintetikus kórokozó-utánzók hatékonyan szinergizálnak a Smac-utánzó szerekkel, hogy jelentősen kiváltsák a daganat visszafejlődését, ami tartós kúrákat eredményez.
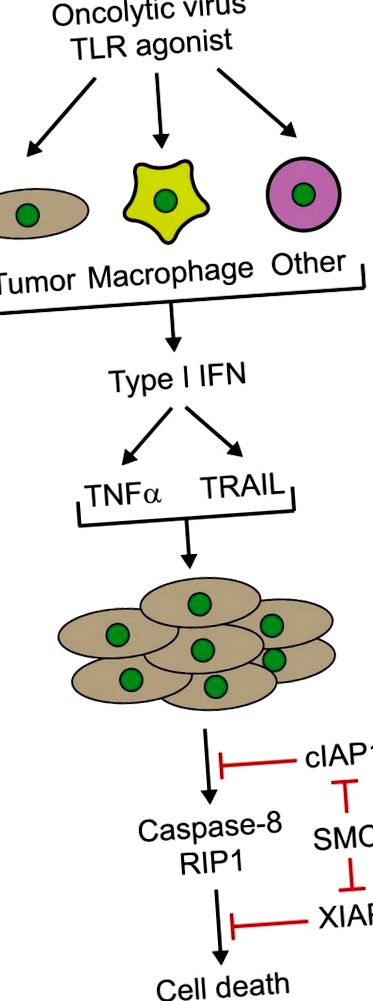
6. Nem volt szükséges az összes rákos sejt közvetlen onkolitikus vírussal való fertőzése, mivel a nem fertőzött daganatos sejteket egy kívülálló mechanizmus képes elpusztítani, legalábbis részben a diffúz és keringő citokinek indukciója miatt (1. ábra). Ez a citokin-vihar felhő daganatsejt-pusztulást eredményez, amelyet egy vírusterjesztési vizsgálatban agaróz-fedőréteg segítségével egyértelműen láthatóvá lehet tenni (lásd a 2. hivatkozás kiegészítő adatait).
1.ábra. A Smac mimetikumok és egy onkolitikus vírus vagy szintetikus Toll-szerű receptor (TLR) agonista citokin által közvetített szinergiája. Onkolitikus vírusokkal történő fertőzés vagy immunstimuláló TLR agonistákkal történő kezelés különféle sejttípusokban (tumor, makrofágok vagy a gazdaszervezet egyéb sejtjei) interferonok, például IFNβ termeléséhez vezet, amely viszont citokinek, például tumor nekrózis termeléséhez vezet. faktor (TNFα) és a TNF-hez kapcsolódó apoptózis-indukáló ligandum (TRAIL). Nevezetesen, ezeknek a citokineknek a termelését fokozzák Smac-utánzók jelenlétében. A daganatsejtek Smac-utánzó szerekkel történő kezelése az apoptózis (cIAP1/2) és az X-kapcsolt IAP (XIAP) fehérjék celluláris inhibitorainak lebomlásához és/vagy gátlásához vezet. Ezt követően a citokinek kaszpáz-8- és RIP1-függő mellékállók halálát indukálják a Smac mimetikus kezelt tumorsejtekben. RIP1, receptor kölcsönhatásban lévő protein-kináz 1; Smac, a kaszpázok második mitokondrium eredetű aktivátora; SMC, Smac utánzó vegyület.
7. A Smac mimetikus kezelés nem változtatta meg és nem veszélyeztette a gazdaszervezet vírusellenes válaszát az onkolitikus VSV fertőzésre, ellentétben egy korábbi jelentéssel, amelyben a cIAP1/2 elvesztése a VSV titerének növekedését eredményezte. Valójában két további tanulmány is bebizonyította, hogy a Smac utánzó kezelések nem akadályozzák az egerek vírusellenes válaszait. 8, 9
A lehetséges összeférhetetlenség nyilvánosságra hozatala
R.G.K. tudományos alapítója és részvényese az Aegera Therapeutics-nak (Pharmascience Inc.), amelynek Smac-utánzata klinikai fejlesztés alatt áll.
Szójegyzék
Rövidítések:
| cIAP | az apoptózis sejtes gátlója |
| CTLA-4 | citotoxikus T-limfocita antigén-4 |
| NYIRKOS | a károsodáshoz kapcsolódó molekuláris minta |
| IFN | interferon |
| NF-κB | nukleáris faktor-κB |
| PD-1 | programozott sejthalál 1 |
| PD-L1 | programozott sejthalál ligand-1 |
| poli (I: C) | poliinozin-policitidilsav |
| Smac | a kaszpázok második mitokondrium-eredetű aktivátora |
| TLR | autópálya-szerű receptor |
| TNFa | tumor nekrózis faktor α |
| NYOM | TNF-rel kapcsolatos apoptózis-indukáló ligandum |
| VSV | Vesikuláris stomatitis vírus |
| XIAP | X-kapcsolt apoptózis inhibitor |
Megjegyzések
Idézet: Beug ST, LaCasse EC, Korneluk RG. A Smac utánzó szerek veleszületett immuningerekkel kombinálva tökéletes citokin-vihart hoznak létre a daganatsejtek elpusztítására. OncoImmunology 2014; 3: e28541; 10.4161/onci.28541
- A kávébab fogyásának reagálása a pörkölés során - tökéletes napi őrlés
- A legjobb 3 maradék savanyú kezdő receptem a tökéletes cipót
- Nővérek gyógyszertár phentermine Vital Max Keto fogyás gyógytea - ájurvédikus gyógyítás - vihar
- Hasi zsírégető termékek és növekvő fizikai teljesítmény BodyStart Keto - Storm Ventures Group
- A szupermodell nem sokkal a szülés után felfedi a tökéletes hasizmokat - Emirates247