A soros MRI képalkotás feltárja a ketogén étrend minimális hatását a megállapított májdaganat növekedésre
Frances L. Byrne
1 Biotechnológiai és Biomolekuláris Tudományi Iskola, Új-Dél-Wales Egyetem, Sydney, NSW 2052, Ausztrália; [email protected]
Stefan R. Hargett
2 Farmakológiai Tanszék, Virginia Egyetem, Charlottesville, VA 22908, USA; ude.ainigriv@qh4hs (S.R.H.); [email protected] (S.L.)
Élvezze Lahirit
2 Farmakológiai Tanszék, Virginia Egyetem, Charlottesville, VA 22908, USA; ude.ainigriv@qh4hs (S.R.H.); [email protected] (S.L.)
R. Jack Roy
3 Radiológiai Osztály, Virginia Egyetem, Egészségügyi Rendszer, Charlottesville, VA 22908, USA; ude.ainigriv@a5rrj (R.J.R.); ude.ainigriv@b4BS (S.S.B.)
Stuart S. Berr
3 Radiológiai Osztály, Virginia Egyetem, Egészségügyi Rendszer, Charlottesville, VA 22908, USA; ude.ainigriv@a5rrj (R.J.R.); ude.ainigriv@b4BS (S.S.B.)
Stephen H. Caldwell
4 Orvosi Osztály, Virginia Egyetem, Charlottesville, VA 22908, USA; ude.ainigriv@c5chs
Kyle L. Hoehn
1 Biotechnológiai és Biomolekuláris Tudományi Iskola, Új-Dél-Wales Egyetem, Sydney, NSW 2052, Ausztrália; [email protected]
2 Farmakológiai Tanszék, Virginia Egyetem, Charlottesville, VA 22908, USA; ude.ainigriv@qh4hs (S.R.H.); [email protected] (S.L.)
Absztrakt
1. Bemutatkozás
Az elsődleges májrák, amelynek a hepatocelluláris carcinoma (HCC) a leggyakoribb formája, a hatodik leggyakoribb rák, a harmadik fő oka a rákkal kapcsolatos halálozásoknak, és a cirrhosisban szenvedő betegek vezető halálozási oka [1]. A krónikus májbetegségek, köztük a hepatitis B és C, az aflatoxin B1 és az alkoholmentes zsírmájbetegség elősegítik a cirrhosist, majd a hepatocelluláris adenoma (HCA) és a HCC kialakulását [1]. Az anyagcsere-betegségek, beleértve az elhízást és a cukorbetegséget, szintén fontos kockázati tényezők a HCC szempontjából, és valószínűleg hozzájárulnak a HCC növekvő gyakoriságához a fejlett világban [1].
A májrák kezelési lehetőségei magukban foglalják a transzplantációt, a műtéti reszekciót, a képvezérelt ablációt, a kemoembolizációt és a szisztémás terápiákat, beleértve a vírusellenes szereket és a VEGFR/multitozin-kináz inhibitor szorbafenibet. Számos klinikai vizsgálat hasonlította össze hasonló szerek, köztük a lenvatinib és a regorafenib hatékonyságát, de a szarafenib továbbra is az egyetlen jóváhagyott első vonalbeli kezelés a HCC számára [2]. Sajnos a sorafenib csak hónapokkal javítja a túlélési arányt [1], kiemelve az elsődleges májrák jobb kezelési lehetőségeinek sürgős szükségességét.
Az étrendi beavatkozások felhasználásának kilátásai a rák növekedésének megfordítására vagy megakadályozására nagy érdeklődést váltottak ki. Az egyik ilyen diétás beavatkozás a magas zsírtartalmú és nagyon alacsony szénhidráttartalmú ketogén étrend, amely keton testek termeléséhez vezet (ketogenezis) [3]. Az emlősmáj a ketontestek fő forrása, amelyek zsírsav oxidáció által indukált acetil-koenzim A (CoA) termelésén keresztül keletkeznek. Amikor a máj szénhidrátellátása alacsony, az acetil-CoA metabolizálódik acetoacetáttá (AcAc), majd β-hidroxi-butiráttá redukálódik. Az epilepszia kezelésére jelenleg közepes láncú trigliceridekből álló ketogén étrendet alkalmaznak [4]. Ez a diéta és a klasszikus ketogén étrend hasznos lehet más rendellenességek esetén is, beleértve az Alzheimer-kórt, a cukorbetegséget, az alkoholmentes zsírmáj betegségeket és a központi idegrendszer rákos megbetegedéseit [3,4].
A ketogén étrend terápiás potenciálját számos rosszindulatú daganat esetében vizsgálták in vitro és in vivo [3], és néhány előrehaladott betegségben szenvedő betegen kipróbálták [5]. Tudomásunk szerint azonban még nem vizsgálták, hogy a ketogén étrend előnyös lehet-e az elsődleges májrák kezelésében. Korábbi vizsgálataink kimutatták, hogy mind a hím [6], mind a nőstény [7] egerek, amelyeket 2 hetes korban dietil-nitrozaminnal (DEN) kezeltek, markánsan védettek voltak a májdaganatképződéstől, amikor 6 hetes kortól kezdve ugyanazt az itt használt ketogén étrendet táplálták. A jelenlegi vizsgálat célja annak meghatározása volt, hogy a daganat megkezdése után alkalmazott ketogén étrend megállíthatja-e vagy megfordíthatja-e a daganat progresszióját.
2. Eredmények
2.1. Diethylnitrosamine által kiváltott máj tumorourenesis
Ebben a vizsgálatban a máj tumorigenesisének DEN modelljét alkalmaztuk egereknél. A DEN egy prokarcinogén, amelyet a máj citokróm P450 enzimjei metabolizálnak, reaktív oxigénfajták előállítására, és aktív karcinogén, amely mutagén DNS-alkilezési adduktokat képez [8]. A sejthalál és a regeneráció progresszív köre hepatocelluláris adenoma kialakulásához vezet, amely HCC-vé alakul. A májdaganat hét különböző egérmodelljével végzett globális gén-expresszió-összehasonlító vizsgálat megállapította, hogy a DEN-modell leginkább a legrosszabb túléléssel rendelkező betegek HCC-daganataira hasonlít [9].
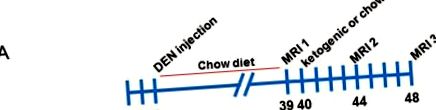
A hím C57BL/6 egerekbe 2 hetes korukban 25 mg/kg DEN-t injektáltunk. Az egereket 3 hetes korban elválasztottuk, és 3–39 hetes korukig standard chow-étrenden tartottuk, majd mágneses rezonancia képalkotással (MRI) vizsgáltuk a tumor terhet (az 1. A. ábra szemlélteti). Az egereket két csoportba soroltuk, hasonló tumorterheléssel, és a felüket ketogén diétával etették, míg a másik fele a chow-étrenden maradt. Az egereket ismét 44 hetes és 48 hetes korban készítettük. Az egyes MRI-felvételeknél a tumorok reprezentatív képeit az 1. B. ábra mutatja. Ezután az egereket leöltük, a szérumot és a szöveteket összegyűjtöttük.
A dietil-nitrozaminnal injektált egerek mágneses rezonancia képalkotó elemzése chow és ketogén étrenddel. (A) A kísérleti vizsgálat sematikus áttekintése. (B) Az egér májának reprezentatív sorozatképei a chow-táplált kontrollcsoportból, minden MRI időpontban.
2.2. A ketogén diéta beavatkozásának validálása
A szérumelemzések megerősítették, hogy a ketogén táplálékkal táplált egerekben a β-hidroxi-butirát szintje szignifikánsan magasabb volt a chow-val táplált egerekhez képest, és megerősítette, hogy az étrend ketózist indukált (a medián medián szintje 0,2997 mM, míg a ketogén csoportban 0,7781 mM, p Ábra 2 A). A ketogén étrenddel táplált egerek testtömegének szignifikáns növekedése volt a 39. héttől a 48. hétig, összehasonlítva a chow-vel táplált egerekkel (medián hajtásváltás chow csoport = 0,985 vs. medián hajtásváltozás ketogén csoport = 1,088, p 2. B ábra). A ketogén étrendet fogyasztó egereknél a szubkután zsír is szignifikánsan megnőtt (az egyik zsírpárna középsúlya 0,095 g volt a tehénnel táplált egerekben, míg 0,188 g a ketogén étrendet fogyasztó egereknél, p 2. ábra C, D).
A ketogén étrenddel táplált egerek szérum-keton-, testtömeg- és zsírtömeg-szintje megnövekedett, mint a chow-val táplált egereké. (A) Chow vagy ketogén étrendet fogyasztó egerek szérum keton testei. Az egér szérumot a vizsgálat befejezésekor (48 hét) gyűjtöttük. A Mann – Whitney-teszttel elemzett adatok (p. 3 A, C ábra) és a multiplicitás (a daganatok száma egérenként, 3. B ábra). A felszíni vérzéses daganatok képeit a 3. C ábra mutatja minden egyes állatnál ebben a vizsgálatban, és az egyes állatok teljes daganatterhelését a 3. D. ábrán számszerűsítik. Összességében ezek az eredmények azt mutatják, hogy a tumor iniciálása után alkalmazott ketogén étrend nem hatékony csökkentésében vagy csökkentésében. megakadályozza a DEN által kiváltott májdaganat növekedését.
A ketogén étrendet tápláló egerek nem voltak védettek a tumor progressziójától. (A) Az MRI által látható daganatokkal rendelkező egerek száma minden időpontban (n = 7). (B) Az MRI által látható tumorok száma minden egérmájban (n = 7, ns = nem szignifikáns, p = 0,9664). (C) Képek az összes egérből származó májról, akár chow-, akár ketogén étrenddel. (D) A boncoláskor egérenkénti teljes tumorterhelés (n = 7, ns = nem szignifikáns, p = 0,7087). Kétirányú ANOVA-val elemzett adatok Sidak többszörös összehasonlító teszttel (alfa = 0,05) B-hez és párosítatlan Student-féle T-teszt D-hez. A skála 1 cm.
3. Megbeszélés
A legtöbb rákos sejt, beleértve a májrákot is, metabolikus átalakításon megy keresztül, hogy növelje a glikolitikus anyagcserét. Ezt a metabolikus fenotípust Warburg és munkatársai fedezték fel először a patkány májkarcinóma szövetében [10]. Ma már széles körben elismert tény, hogy a rák sok típusa a glükóztól válik függővé a glikolízis magas arányának elősegítése érdekében. Ezt a Warburg-típusú anyagcserét széles körben tekintik a terápiás beavatkozás potenciális bejáratának [11].
A ketogén étrend korlátozza a glükóz elérhetőségét és korlátozza a Warburg típusú anyagcserét. Ezért a ketogén étrend mind a preklinikai állatkísérletek, mind az emberi vizsgálatok során egyre népszerűbbé vált a tumor növekedésének megelőzésére vagy visszafordítására való képességük miatt. Általában az eddigi klinikai és preklinikai vizsgálatok többsége kimutatta a ketogén étrend jótékony rákellenes hatását [12,13]. A melanoma, a glioblastoma, az asztrocytoma és a hasnyálmirigyrák néhány állatmodellje azonban ellenálló volt a ketogén étrenddel szemben, és egyes tanulmányokban a ketogén étrend protoror hatást fejtett ki veserákban és melanomában [12]. Klinikai körülmények között a vizsgálatok 42% -a (24-ből 10) kimutatta, hogy a ketogén étrendnek daganatellenes hatása van, míg egy tanulmány protoror hatásról számolt be, a többi pedig nem volt hatással [12]. Ezért egyértelműen vannak szövetspecifikus és genetikai összetevők, amelyek meghatározzák, hogy a daganatok érzékenyek-e a ketogén étrendre.
A máj karcinogenezisének DEN-modellje a leggyakoribb modell ezen a területen. A DEN markáns genomiális instabilitást okoz, és heterogén mutációkkal, valamint kromoszómális nyereséggel és veszteséggel rendelkező tumorokat produkál [14]. A genotoxikus károsodás ezen sokfélesége és mértéke összhangban áll a rossz prognózisú humán HCC-vel [9]; így ez a modell alkalmas annak megvizsgálására, hogy a ketogén étrendnek lehet-e rákellenes hatása, amelyet át lehetne fordítani a klinikára. Korábbi, ugyanazt a DEN protokollt alkalmazó vizsgálataink során egy ketogén étrend, amelyet 6 hetes kortól kezdve egereknek alkalmaztak, jelentősen megakadályozta a májdaganat kialakulását [6,7]. Ezért kezdetben azt feltételeztük, hogy a betegség előrehaladása során később alkalmazott ketogén étrendnek van néhány védő daganatellenes hatása. Azt tapasztaltuk azonban, hogy a késői kezdetű ketogén étrend, amelyet a vizsgálati protokoll utolsó 8 hetében alkalmaztak, nem volt hatással a tumor teljes terhelésére. Ez az eredmény összhangban áll Klement és munkatársai megfigyeléseivel, miszerint a ketogén diéták jobban védenek, ha a tumorátültetést megelőzően kezdik őket [15].
A tanulmány korlátai között szerepel az anyagcsere-fenotípusok és a tumorterhelés közötti összefüggések hiánya. Például a táplálékfelvételt nem határozták meg, mivel az állatokat csoportos elhelyezésben tartották, és továbbra sem világos, hogy a glükóz toleranciához kapcsolódó paraméterek, ideértve az etetett és éheztetett inzulin- és glükózszinteket, vagy a glükóz-keton indexet [16], hogyan korrelálnak a tumor terhelésével. Ezenkívül az öregedés a keton testtermelés csökkenésével jár [17]; ezért nem lehet kizárni a ketogén étrend kisebb hatásait, ha az egereknek 40 hetes korban kerülnek bevezetésre a 6 hetes korhoz képest.
4. Anyagok és módszerek
4.1. Diétás beavatkozás egerekben
A C57BL/6N hím egereket egy szabályozott hőmérsékletű helyiségben (22 ° C) tartottuk és tenyésztettük 12 órás világos/sötét ciklusban, szűrő tetejű ketrecekben, ad libitum hozzáféréssel az ételhez és a vízhez. Az egereket 2 hetes korban dietil-nitrozaminnal (DEN) (25 mg/kg) injektáltuk intraperitoneális (i.p.) injekcióval, és 21 napos korukban elválasztottuk. Az egereket 39 hetes korukig chow-étrenden tartották, majd ketogén diétára váltottak, vagy a chow-diétát tartották a 40. héten. A ketogén étrend házon belül készült és 4 tömeg% AIN-76 (Harlan) ásványi anyag keverékből állt. Teklad), 1% AIN-76 vitaminkeverék (Harlan Teklad), 0,4% kolin-bitartarát, 0,3% metionin, 2% zselatin, 71% zsírzsír, 16% kazein és 6% pórsáfrányolaj, a korábban leírtak szerint [6], energiával (kcal% -ban) a fehérje, a zsír és a szénhidrát esetében 8%, 90% és 2%. A chow-étrend Teklad LM-485 egér diéta volt, 7012 (Envigo), fehérje, zsír és szénhidrát energiája (kcal% -ban) 25, 17%, illetve 58% volt.
4.2. MRI egérmájról
Az MRI vizsgálatokat a 39., 44. és 48. héten végeztük 7T Clinscan MR rendszer alkalmazásával (Bruker, Ettlingen, Németország). A rádiófrekvenciás (RF) átvitelhez és vételhez egy madárketrec RF tekercset használtak, amelynek átmérője 35 mm. A pulzusszámot, a légzést és a test testhőmérsékletét száloptikával, MR-kompatibilis rendszerrel (Small Animal Imaging Inc., Stony Brook, NY, USA) követtük nyomon. Az érzéstelenítést fenntartottuk 1,25% izoflurán/O2 alkalmazásával, orrkúpon keresztül belélegezve. Az egerek altatását követően gadolíniumot (Gd) adtunk (gadobenát-dimeglumin injekció, MultiHance, Bracco Diagnostics) 0,6 mmol/kg oldatban intramuszkuláris injekció formájában a bal quadricepbe. Ezután az egereket 5 percig tartottuk a nyomjelző keringéséhez. A képeket T1-súlyozott, gadolinium-fokozott spin-echo impulzus szekvenciával szereztük be. A képalkotási paraméterek a következők voltak: TR (ismétlés) = 797 ms, TE (visszhang) = 15 ms, 2 átlag, 192 × 192 mátrix (nulla kitöltéssel 256 × 256-ig), FatSat (erős mód), 21 szelet 100% -os réssel. Ezt 21 szomszédos szelettel megismételtük, hogy 42 képből álló összefüggő készletet kapjunk. A nyers DICOM fájlokat a DICOMSort segítségével rendezték és átnevezték, majd képeket importáltak az ImageJ Fidzsi-szigetekre a májdaganatok számolásához. A minimálisan kimutatható tumorméret 1,5 mm átmérőjű volt.
4.3. Egérszövetek és vér gyűjteménye
48 hetes korukban az egereket méhnyak-diszlokációval eutanizálták, és a vért szívpunkcióval vették fel. A vérmintákat 5000 fordulat/perc sebességgel 15 percig 4 ° C-on centrifugáltuk, a szérumot pedig további elemzésekig -80 ° C-on tároltuk. Az egérmájat kivágtuk, leképeztük, lemértük, majd megszámoltuk a felszíni vérzéses daganatokat. Az egér szubkután és ivarmirigy zsírpárnáit (a jobb oldaluktól egy-egy betétet) lemértük és gyorsfagyasztottuk. Minden állatkísérletet a Virginia Egyetem Állatgondozási és Felhasználási Bizottsága hagyott jóvá (az etikai kódex 3942: „Metabolikus beavatkozás a rákban”).
4.4. Szérum mérések
Β-hidroxi-butirát (keton test) kolorimetrikus vizsgálati készletet (Cayman Chemical) alkalmaztunk a szérum keton test mérésére a véletlenszerűen táplált egerekből szüretkor összegyűjtött vérben, a gyártó utasításainak megfelelően.
4.5. Statisztikai elemzések
A normál eloszlású adatokat paraméteres tesztekkel elemeztük, az egyenlőtlen varianciákkal rendelkező adatokat pedig nem paraméteres tesztekkel elemeztük (az ábrák jelmagyarázatában feltüntetve). Az összes statisztikai elemzést a GraphPad Prism alkalmazásban végeztük.
5. Következtetések
Összességében ez a tanulmány azt mutatja, hogy a ketogén étrend nem állítja le vagy gátolja a kialakult daganatok növekedését; ez a tanulmány azonban egérmodell-rendszert képvisel, és az eredményeket ebben a kontextusban kell értelmezni, ahol nem lehet széles körben extrapolálni a megállapításokat minden genetikailag sokféle daganattal rendelkező emberre. Az eredmények azonban egyértelműen azt mutatják, hogy a máj tumorigenesisének ez a közös egérmodellje ellenáll a ketogén étrendnek. Ezek az adatok arra engednek következtetni, hogy a ketogén étrend profilaktikus beavatkozásként lehet a leghatékonyabb.
Szerző közreműködései
Konceptualizáció, K.L.H., S.H.C. és S.S.B .; Methodology, S.R.H., S.L. és R.J.R .; Formális elemzés, S.R.H. és F.L.B .; Írás - eredeti vázlatkészítés, F.L.B .; Írás - Felülvizsgálat és szerkesztés, F.L.B. és K.L.H.
Finanszírozás
Ezt a tanulmányt részben egy Cancer Institute New South Wales Early Career Fellowship (FLB, ECF171121), NHMRC Project Grant (KLH, APP1108211), NIH R01 (KLH,> DK101803) és NIH berendezés-támogatás finanszírozta a 7T Clinscan MR számára. rendszer (SSB, RR019911).
Összeférhetetlenség
A szerzők nem jelentenek összeférhetetlenséget.
- Reddit - keto - Megemelkedett májenzimek ketogén étrenden
- PRIME PubMed A ketogén étrend metabolikus hatása az elhízott gyermekek hipokalorikus étrendjéhez képest
- A táplálkozási szakember titkot tár fel Jose Aldo drámai fogyásának - a „ketogén diéta” - mögött; Keto
- Nutrex Lipo 6 Black Keto fogyás kiegészítő Ketogén étrendhez
- A pikkelysömör és a zsírmáj gyakori kísérője - Ha pikkelysömörben szenved, fontolja meg a NAFLD diétát