A súlyos kardiomiopátia sikeres kezelése III-as típusú glikogén tárolási betegségben D-, L-3-hidroxi-butirát-, ketogén és magas fehérjetartalmú étrenddel
Tárgyak
Absztrakt
A III. Típusú glikogén tárolási betegség (GSD) (OMIM 232400) a glikogén-leágazó enzim (GDE; EC 3.2.1.33) hiányának köszönhető, amelyet a AGL gén. A betegség becsült előfordulási gyakorisága 1: 100 000 élveszületés. A betegség klinikai formái közé tartozik egy túlnyomórészt májforma (hepatomegalia, hipoglikémia és hipertrigliceridémia) és egy izomforma (miopátia és kardiomiopátia) (1).
Annak ellenére, hogy jelenleg hiányoznak a természettudományi jelentések, a III. Típusú glikogéntároló betegség (GSD III) a máj formáinak kedvező kimeneteléhez kapcsolódik, mivel az étrend kezelése kevésbé szigorú, mint más GSD-k, például az I. típusú GSD (glükóz-6-foszfatáz) hiány), míg az izomformák magas morbiditással és mortalitással társulnak, elsősorban a kardiomiopátia, a szívelégtelenség forrása és a hirtelen halál miatt (1–3).
A GSD III kezelésével kapcsolatban nincs konszenzus. A szokásos ajánlások azonban a magas szénhidráttartalmú napi étkezést és a nyers kukoricakeményítőt vagy az éjszakai folyamatos etetést (4), amelyek megakadályozzák a hatékony éhomi hipoglikémiát, de általában nem befolyásolják a szív és az izom megnyilvánulásainak lefolyását.
Ennek a tanulmánynak a célja a d, l-3-hidroxi-butirát (3OHB) és ketogén és magas fehérjetartalmú étrend együttesének értékelése volt 24 hónap alatt a GSD III okozta súlyos kardiomiopátia javítása érdekében 2 hónapos csecsemőben.
Türelmes.
2 hónapos afrikai származású férfi csecsemő hipertrófiás kardiomiopátiában szenved. A szülői rokonság és a 11 hónapos korban elhunyt nővér családi kórtörténete miatt a GSD III miatt súlyos kardiomiopátia miatt a diagnózis születéskor gyorsan megállapításra került. Idősebb nővére 8 hónapos korában hipoglikémiát, az aszpartát-transzamináz (AST) és az alanin-transzamináz (ALT) emelkedésével járó hepatomegáliát és magas kreatin-kináz (CK) szinttel járó hipertrófiás kardiomiopátiát mutatott. Gyakori étkezésekkel és éjszakai folyamatos enterális táplálással kezelték a hipoglikémia megelőzése érdekében. A kardiomiopátia a kezelés első hónapjában gyorsan romlott. A tachycardia több epizódja miatt acebutolollal kezelték. Egy hónappal később a kardiomiopátia nem változott, de a tachycardia megszűnt. Végül 11 évesen meghalt szívmegállás miatt.
Az enzimaktivitás mérése hiányzott GDE aktivitást mutatott friss leukocitákban, míg a molekuláris analízis c.2157 + 1G> T homozigóta splice mutációt mutatott ki a 16–17. AGL gén. Erről a szekvenciaváltozásról korábban nem számoltak be, de az előrejelzések szerint befolyásolhatja a splice donor helyét, és így patogén lehet.
A tünetmentes hipertrófiás kardiomiopátia mellett a fiú, nővéréhez hasonlóan, hepatomegáliát, éhomi hipoglikémiát és hipertrigliceridémiát mutatott, amelyeket hagyományos étrendi megközelítéssel, gyakori étkezésekkel és folyamatos éjszakai etetéssel nasogastricus csövön keresztül sikerült kezelni. A 24 órás Holter-EKG felvétel nem mutatott semmilyen szívritmuszavart.
Mivel a nővér állapota gyorsan romlott a magas szénhidráttartalmú étrend alatt, feltételeztük, hogy ez utóbbi a glikogén felhalmozódásának fokozásával ronthatja a kardiomiopátiát a GSD III-ban (5,6).
Feltételeztük továbbá, hogy a magas szénhidráttartalmú étrend által kiváltott magas inzulinszekréció gátolhatja a lipolízist és ezáltal a szív energiaellátását azáltal, hogy csökkenti az acetil-CoA és keton testek zsírsav oxidációval történő képződését (FAO). Következésképpen úgy döntöttünk, hogy csökkentjük a szénhidrátbevitelt, hogy korlátozzuk a glikogén felhalmozódását, és növeljük a lipidbevitelt a FAO és a ketogenezis fokozása érdekében. A normál glükózszint fenntartása érdekében a plazmában azt javasoltuk, hogy fokozzuk a neoglükogenezist azáltal, hogy magas fehérjetartalmú étrenddel növeljük a glükoneogén szubsztrátok, például a glicerin (a ketogén étrendből) és az aminosavak elérhetőségét. Végül bevezettük a d, l-3-hidroxi-butirátot, mint alternatív energia szubsztrátot a szív számára.
MÓD
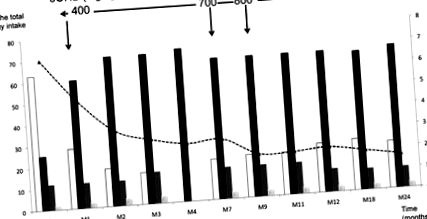
Olyan étrenden kezdtük a beteget, amely az energia 65% -át lipidekből, 15% -át fehérjéből és 20% -át glükózból biztosította (az étrend részletes összetételét lásd az 1. táblázatban). Az első 6 hónapban a nasogastricus csövön keresztül történő folyamatos táplálást alkalmaztuk, hogy elkerüljük az alacsony glükózbevitel miatti hipoglikémiát. 7-től bevezettük az orális táplálást, és a 12. hónapban a gyermek négy ételt és egy éjszakai táplálékot kapott. A 3OHB-t 400 mg/kg/nap dózissal kezdték, 3 óránként adva, amint arról korábban beszámoltunk (7). Az 1. ábra az étrend változását mutatja be a vizsgálat során a szénhidrát-, lipid- és fehérjebevitelben a teljes energiafogyasztás (TEI)% -ában kifejezve a vizsgálat 24 hónapja alatt, valamint a 3OHB-dózis fokozatos növelését 800 mg/kg-ig./d. A szénhidrátbevitel drámaian csökkent a TEI 65-ről 20% -ára (4 g/kg/d), míg a lipid- és fehérje-bevitel 65% -ra (6 g/kg/d) és 15% -ra (3 g/kg) nőtt/d).
A szénhidrát (□), a lipid (▪) és a fehérje () bevitelének változása a teljes bevitt energia százalékában (bal tengely), a fehérjében g/kg-ban kifejezve (kikelt oszlopok, bal tengely) és glükózsebességben mg/kg/perc (fekete pontozott görbe, jobb tengely) a tárgyalás során. Nyilak jelezze a 3OHB dózisait a vizsgálat során.
A klinikai és biológiai értékeléseket háromhavonta végezték, beleértve a növekedést, a máj méretét (klinikailag és ultrahangvizsgálattal), a máj transzaminázait, a kreatin-kinázt, a plazma glükózát, a laktátot, a 3-OH butirátot, az acetoacetátot, az FFA-t és a szérum inzulinszintjét. A szívértékelést ultrahangvizsgálattal, standard EKG-vel és 24 órás Holter-EKG monitorozással végeztük. A Z-pontszámot számítottak az interventricularis septum minden egyes mérésére.
Tájékozott beleegyezést kaptunk a szülőktől, és a tanulmányt az Intézményi Felülvizsgálati Testület (Conseil d'Ethique, Necker-Enfants Malades) hagyta jóvá.
EREDMÉNYEK
Az étrend és a 3OHB kezelés jól tolerálható volt. További hipoglikémiát nem figyeltek meg, annak ellenére, hogy az éjszakai glükóz aránya 2 mg/kg/perc alá esett a 24 hónapos követés során.
A kardiomiopátia javult. A kamrai fal (IVW) vastagsága szignifikánsan csökkent a Z-pontszám 7,4-től a-ig Z-pontszám 3,6 a vizsgálat végén (2. ábra). Mo 6 és mo 14 között azonban az IVW vastagságának átmeneti növekedését figyelték meg. Ez egybeesett a plazma ketontestek csökkenésével, és megfordult, miután a 3OHB-kiegészítés 400-ról 800 mg/kg/napra nőtt. Az EKG-n a Q hullámok amplitúdója és a Sokolow-index csökkent, és szívritmuszavar nem fordult elő.
A kamrai falvastagság változása mm-ben kifejezve (fekete görbe) és mint Z-pontszámok (sötét szürke pontozott görbe). Átlagos, -2 SD és +2 SD görbék láthatók (világosszürke pontozott görbék).
Az izomtónus, valamint az izomerő normális maradt, és a gyermek normális motoros fejlődést mutatott, és 12 hónapos korában támogatatlanul járt. A szomatikus növekedés normális maradt (2 éves korban).
A máj mérete a kezelés első 6 hónapjában nőtt, majd a vizsgálat során stabil maradt. Bár a májenzimek megemelkedtek (mind az ALT, mind az AST esetében 2,5-szeresek) stabilak maradtak a vizsgálat során. Nem figyeltek meg változást a gamma-glutamil-transzpeptidázban (gGT) és az alfa-fetoproteinben, echográfiai változásokat nem találtak a májban.
A kreatin-kináz szintek kezdetben emelkedtek (520 U/L; felső referencia tartomány, 180), és az első 3 hónap alatt maximum 720 U/L-re emelkedtek, majd a következő 9 hónap alatt csökkentek a kezdeti szintre. A glükóz- és inzulinértékek a plazmában csökkentek a vizsgálat során (glükóz-medián: 4,5 mM a kezelés előtt és 3,8 mM a kezelés után; inzulin: 4 mU/L a kezelés előtt és 1,8 mU/l a kezelés után), míg a medián laktátszint stabil maradt (medián 1,4 mM) annak ellenére, hogy a kezelés előtt nem regisztráltak magas értékeket, szemben azzal, amit általában a GSD III-ban szenvedő betegeknél megfigyelnek. A ketontestek (3-OH-butirát és aceto-acetát) és az FFA a plazmában a várakozásoknak megfelelően növekedtek (3. ábra). A koleszterin normális volt, de a trigliceridek értéke kezdetben megemelkedett (koleszterin: 3 mM; felső referencia tartomány: 4,5 mM; és trigliceridek: 2,9 mM; felső referencia tartomány: 1 mM), és stabilak maradtak a vizsgálat során.
Az összes ketontest változása (KB, mmol/l, fekete pontozott görbe) és FFA (FFA, g/l, szürke görbe) szintjei a vizsgálat során.
VITA
Beszámolunk a szintetikus keton testek ketogén és magas fehérjetartalmú étrenddel történő együttes használatáról egy 2 hónapos csecsemőnél, aki súlyos GSD III családi hepatomuscularis formában szenved, kardiomiopátiával komplikálva és testvére korai halálához vezetve. A kardiomiopátia javulását figyeltük meg páciensünknél, és további szívvel kapcsolatos szövődményeket nem tapasztaltunk a vizsgálat 24 hónapja alatt. Ráadásul betegünknek a mai napig nem jelentkeztek izomtünetei.
A ketogén étrend és a keton testek pótlása állandó ketózist eredményezett páciensünknél. A d, l-3-hidroxi-butirátot korábban sikeresen alkalmazták a kardiomiopátia kezelésére többszörös acil-CoA-dehidrogenáz-hiányban, a ketózis hiányával járó zsírsav-oxidációs rendellenességben (7). Más jelentések rávilágítottak a keton testek fontosságára a szív anyagcseréjében azáltal, hogy növelik a szukcinát-dehidrogenáz aktivitását és ezáltal a légzési lánc kimenetét (8), vagy ezek kardioprotektív hatásait egy koszorúér iszkémiás esemény után (9). Feltételezzük, hogy az étrend és a d, l-3-hidroxi-butirát, ezáltal megkönnyítve a FAO-ból történő ATP-képződést, és a ketolízis hozzájárulhatott a kardiomiopátia javulásához.
Az IVW vastagságának átmeneti növekedése, amelyet mo 6 és mo 14 között figyeltünk meg, a ketózis szintjének csökkenésével járt, amelyet korrigált a d, l-3-hidroxi-butirát dózisának emelése (400-ról 800 mg/kg/kg-ra). d) míg az étrend változatlan maradt. Ez utóbbi arra utal, hogy a ketózis csökkentheti a kardiomiopátia progresszióját.
A korlátozott glükózszintű étrend csökkent inzulinszinthez és esetleg a glikogén felhalmozódásának csökkenéséhez vezetett, amint azt a GDE-gátlás állatmodelljében bemutatták, ahol a magas inzulin- és laktátszint a glikogén-tárolás 50% -os növekedéséhez vezetett ( 10).
A plazma glükózszintje a normál tartományon belül maradt annak ellenére, hogy a szénhidrátbevitel drámai módon csökkent, valószínűleg a diéta által biztosított magas glicerin- és fehérjeszint, valamint a tartós ketózis miatt a glükoneogenezis fokozódása miatt. Érdekes, hogy egy nemrégiben készített jelentésben a cardiomyopathia javult egy GSD III-as betegnél is, amikor fehérjében gazdag étrendet kezdett kapni (11). Ez a korábbi jelentésekben fehérjében gazdag étrend mellett javuló izomtünetekre is vonatkozott (12,13).
Nem észleltek mellékhatásokat, beleértve a koleszterin- és trigliceridszinteket, amelyek stabilak maradtak a vizsgálat során. A májméret és a májenzimek stabilak maradtak, és ultrahangvizsgálattal nem figyeltek meg változásokat, ami azt jelzi, hogy az étrend a máj számára is előnyös lehet.
A CK csökkent, de emelkedett maradt, annak ellenére, hogy a GSD III-ban nem látszik összefüggés az izom patológiás változásai és a CK szint között (14).
Összegzésként beszámolunk a GSD III új kezelési koncepciójáról d, l-3-hidroxi-butiráttal, ketogén és magas fehérjetartalmú étrenddel, amely a kardiomiopátia javulásával, a betegség súlyos és halálos szövődményével járt együtt testvér. Mivel azonban ez egyetlen betegvizsgálat, nem tudjuk megerősíteni, hogy eredményeink kizárólag terápiás beavatkozásainknak köszönhetőek, és még a családon belül sem kapcsolódhatnak a betegség változékonyságához. Ezeket a biztató adatokat tehát meg kell erősíteni több GSD III-os kardiomiopátiában vagy izomtünetben szenvedő betegnél.
- Paget; s csontbetegség - Kezelés - NHS
- A PRIME PubMed A metabolikus diszfunkcióval járó zsírmájbetegség növeli a súlyos Covid-19 kockázatát
- Tejtövis nem alkoholos zsírmájbetegség kezelésére Hepatitis havi teljes szöveg
- A kisérbetegség tünetei, kezelése és megelőzése
- Vegyes kötőszöveti betegség tünetei, okai és kezelése