A szintetikus útdíj-szerű 4 receptor (TLR4) és a TLR7 ligandok a MyD88-on keresztül additívan működnek protektív vírusellenes immunitás kiváltása érdekében
Peter H. Goff
mikrobiológiai tanszék, Icahn Orvostudományi Egyetem, a Sínai-hegyen, New York, New York, USA
b Orvosbiológiai Orvostudományi Kar, Icahn Orvostudományi Egyetem, a Sínai-hegyen, New York, New York, USA
Tomoko Hayashi
c Moores UCSD Rákközpont, Kaliforniai Egyetem, San Diego, La Jolla, Kalifornia, USA
Wenqian He
mikrobiológiai tanszék, Icahn Orvostudományi Egyetem, a Sínai-hegyen, New York, New York, USA
b Orvosbiológiai Orvostudományi Kar, Icahn Orvostudományi Egyetem, a Sínai-hegyen, New York, New York, USA
Shiyin Yao
c Moores UCSD Rákközpont, Kaliforniai Egyetem, San Diego, La Jolla, Kalifornia, USA
Howard B. Cottam
c Moores UCSD Rákközpont, Kaliforniai Egyetem, San Diego, La Jolla, Kalifornia, USA
Gene S. Tan
mikrobiológiai tanszék, Icahn Orvostudományi Egyetem, a Sínai-hegyen, New York, New York, USA
Brian Crain
c Moores UCSD Rákközpont, Kaliforniai Egyetem, San Diego, La Jolla, Kalifornia, USA
Florian Krammer
mikrobiológiai tanszék, Icahn Orvostudományi Egyetem, a Sínai-hegyen, New York, New York, USA
Karen Messer
c Moores UCSD Rákközpont, Kaliforniai Egyetem, San Diego, La Jolla, Kalifornia, USA
Minya Pu
c Moores UCSD Rákközpont, Kaliforniai Egyetem, San Diego, La Jolla, Kalifornia, USA
Dennis A. Carson
c Moores UCSD Rákközpont, Kaliforniai Egyetem, San Diego, La Jolla, Kalifornia, USA
Peter Palese
mikrobiológiai tanszék, Icahn Orvostudományi Egyetem, a Sínai-hegyen, New York, New York, USA
d Orvostudományi tanszék, Icahn Orvostudományi Egyetem, a Sínai-hegyen, New York, New York, USA
Maripat Corr
e Orvostudományi Kar, Kaliforniai Egyetem, San Diego, La Jolla, Kalifornia, USA
ABSZTRAKT
FONTOSSÁG Újfajta adjuvánsok kifejlesztésére van szükség az immunogenitás fokozásához, a szezonális influenza vírusfertőzés elleni jobb védelem és a járványra való felkészülés javítása érdekében. Itt megmutatjuk, hogy a szintetikus TLR4 és TLR7 ligandumok számos dóziskombinációja hatékony adjuváns a rekombináns influenza vírus hemagglutinin antigénjének humorális és sejtes immunitás vírusproblémákkal szembeni indukciójához. A kombinált adjuváns összetevői additív módon működnek, lehetővé téve mind az antigén, mind az adjuváns dózismegtakarítást a hatékonyság megőrzése mellett. Az adjuváns hatásmechanizmusának megértése kritikus eleme a preklinikai biztonsági értékelésnek, és itt bemutatjuk, hogy a kombinált TLR4 és TLR7 adjuváns jelek a megfelelő receptorokon és a MyD88 adapterfehérjén keresztül jelennek meg. Ez az új adjuváns kombináció hozzájárul egy szélesebb védőoltáshoz, miközben vonzó biztonsági profilt mutat.
BEVEZETÉS
Az influenza továbbra is fő globális egészségügyi probléma, és a jelenleg rendelkezésre álló oltóanyagok hatékonysága korlátozott (1, 2). Az influenza A H1 és H3 altípusú vírusok és az influenza B vírusok voltak az etiológiai tényezők a legutóbbi szezonális járványokban (3). Az A-influenza vírusok a múlt század több globális járványáért is felelősek voltak, köztük az 1918-as spanyol influenza (H1N1), az 1957-es ázsiai influenza (H2N2), az 1968-as Hong Kong-influenza (H3N2) és a 2009-es sertés eredetű influenza (H1N1) járványok ( 4). A jelenlegi influenza elleni vakcinák humorális védelmet váltanak ki, amely korrelál az immunodomináns globuláris fej hemagglutinációt gátló (HAI) válaszával (5). Míg a semlegesítő antitestek többsége epitópokat céloz meg a vírusos hemagglutinin (HA) gömbfejű doménjében, antigén régiói nagyon változóak, és folyamatosan antigén sodródáson mennek keresztül, ami a természetes fertőzés és immunizálás által kiváltott semlegesítés elkerülését eredményezi (3, 5). Az influenza vakcina fejlesztésének egyik fő fókusza az ésszerű antigénösszetétel volt (6, –13). A megfelelő adjuváns kifejlesztése azonban ugyanolyan fontos lehet az optimális oltóanyag-tervezésnél (14, –18).
A jelenlegi szezonális influenza vírus vakcinák azon előrejelzéseken alapulnak, hogy az influenza vírustörzsek mely keringenek a következő szezonban. A H1N1 és H3N2 influenza A vírus antigéneket, valamint egy vagy két influenza B vírus komponenst tartalmazó három- vagy négyértékű vakcinák terjednek a legszélesebb körben (6). Az influenza vírussal összefüggő halálozás többsége az idős népességnél fordul elő. 2015-ben az Egyesült Államok Élelmezési és Gyógyszerügyi Hivatala (FDA) jóváhagyta az idős lakosságnak szánt vakcina forgalmazását; ez a vakcina, a Fluad volt az első szezonális influenza vírus vakcina, amely adjuvánst tartalmazott (19, 20). A három influenza vírustörzsből (két A típusú altípus és egy B típus) előállított háromértékű Fluad vakcinát az MF59 (Novartis) adjuvánssal, a szkvalénolaj olaj-a-víz emulziójával állítják elő. Az adjuváns hozzáadása magasabb szintű védő antitesteket eredményez a veszélyeztetett populációkban, például idős embereknél (21).
EREDMÉNYEK
A kombinált TLR4/TLR7 adjuváns elősegítette a tüdő vírustiterének csökkenését és a morbiditás csökkenését a homológ influenza vírus okozta fertőzést követően.
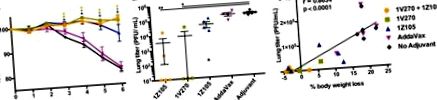
Az egyesített 1V270/1Z105 adjuvánst tovább vizsgáltuk kettős deficiens Tlr4. Tlr7 -/- egerekben és Myd88 -/- egerekben (lásd az Anyagok és módszerek részleteket az ebben a vizsgálatban használt mutáns egér törzsekről). A kombinált adjuvánssal az antitestválasz és a vírusfertőzés elleni védőhatás a TLR4, TLR7 és MyD88 jelenlététől függ (2G-toI ábra). I). A Tlr4.Tlr7 -/- és Myd88 -/- egerek adjuváns rPR/8 HA-re való reagálási képességét poli (I · C), a TLR3 és a melanoma differenciálódáshoz kapcsolódó fehérje-5 (MDA5) agonistájának felhasználásával igazoltuk., egy intracelluláris retinsavval indukálható I gén (RIG-I) -szerű receptor. A Tlr4.Tlr7 -/- és Myd88 -/- egerek, amelyeket poli (I · C) -vel adjuvánssal adszorbeált rPR/8-mal immunizáltak, a WT egerekéhez hasonló antitest-választ eredményezett (2J ábra). Ezeket az immunizált Tlr4.Tlr7 -/- és Myd88 -/- egereket megvédték a súlyvesztéstől és túlélték a PR/8 vírusfertőzést, hasonlóan a WT egerekhez (2K. És L. Ábra). L). Ezért a Tlr4.Tlr7 -/- és Myd88 -/- egerek képesek alternatív adjuvánssal védő vírusellenes immunválaszokat kialakítani, és az 1V270/1Z105 in vivo hatékonysága függ a MyD88 adapteren keresztüli ép TLR4 és TLR7 jelzésektől.
A csontvelő eredetű és a radiorezisztens sejtek hozzájárulnak az antigénspecifikus humorális immunitás és a védőoltás hatékonyságának kombinált 1V270/1Z105 indukciójához.
Az 1V270/1Z105-adjuváns rHA által indukált IgG és CD4 + sejtek hozzájárulnak a vírusfertőzés elleni védelemhez.
Az IgG szerepének formális felmérése érdekében a kombinált adjuváns által kiváltott védelemben a WT (BALB/c) egereket 0. és 3. héten immunizáltuk PR/8-ból származó rHA-val vagy influenza A/Kalifornia/04/2009 (H1N1 pandémiával) (Cal/09) plusz 1V270/1Z105 vagy adjuválatlan antigénnel. Az egereket 10 héttel az első immunizálás után elvéreztettük, a szérumokat hővel inaktiváltuk és passzívan továbbítottuk intraperitoneális (i.p.) injekcióval a befogadó WT (BALB/c) egerekbe. Az egereket homológ PR/8 vírussal fertőztük, majd követtük morbiditásukat, súlycsökkenéssel (P 4A ábra) és mortalitással (P 4B ábra) vizsgáltuk vagy egérrel adaptált heterológ NL/09-vel fertőztük, és követtük morbiditással (P ábra 1). 4C) és a mortalitás (P 4D ábra). Az rCal/09-gyel immunizált és influenza A/Netherlands/602/2009 (NL/09) fertőzött egerek kontroll csoportját felvették a homológ védelem bemutatására a pandémiás H1N1 modellben. Az 1V270/1Z105-gyel immunizált egerekből származó antitestek passzív átvitele gyengítette a fogyást és védelmet nyújtott a halálos fertőző homológ provokációval szemben, de nem a heterológ provokációval szemben.
Az 1V270 és az 1Z105 additív módon antigénspecifikus IgG-t indukál és védi az egereket az influenza vírus okozta fertőzéstől.
Bár az adjuváns oltások javíthatják az immunitást, a szabályozó ügynökségek megfelelően foglalkoznak az oltások biztonságával (16, 45, 46). Itt megvizsgáltuk a kombinált adjuvánst a célon kívüli hatásokra, és szisztematikusan értékeltük a dózis csökkentését a lehetséges toxicitások minimalizálása érdekében. Korábban beszámoltunk arról, hogy a kombinált 1V270/1Z105 adjuváns nem váltott ki szisztémás gyulladásos választ, és ebben a tekintetben jól hasonlított a szkvalén alapú AddaVax emulzióhoz (18); az in vivo hatásmechanizmus meghatározása azonban kritikus lépés az új adjuvánsok preklinikai értékelésében. Kiütéses egérmodellekkel bebizonyítottuk, hogy az 1Z105 és az 1V270 szigorúan a TLR4-től és a TLR7-től függ, a MyD88-on keresztül jeleznek, anélkül, hogy bármilyen észrevehető off-target hatás lenne. A TLR4-et és a TLR7-et megcélzó kis molekulák kombinációja lehetővé teszi az adjuváns dózis jelentős csökkentését.
A többféle molekuláris és sejtes célpontú adjuvánsok kívánatosak, ha a preklinikai modellek hatékonysági eredményeit genetikailag eltérő háttérrel rendelkező emberekben kell felhasználni. Az 1V270/1Z105 mind a TLR4, mind a TLR7 révén működik, és hatásait mind a perifériás radiorezisztens sejtekre, mind a csontvelő eredetű sejtekre gyakorolja. Több receptor aktiválása az adaptív és veleszületett immunsejtek különböző populációin segíteni fogja a vakcinaválasz javulását a közösségen alapuló populációkban. Ennek a stratégiának különösen nagy lehetősége van az immun öregedés legyőzésére az idősebb betegeknél, akiknél az influenzavírus-fertőzések szövődményeinek kockázata a legnagyobb. Amint azt korábban leírtuk, a TLR4: TLR7 arány befolyásolja a Th1: Th2 típusú immunitás egyensúlyát (18). Haladva a TLR4: TLR7 arány optimalizálásának lehetőséget kell adnia mind a biztonság, mind a hatékonyság optimalizálására, mivel a vegyületeket klinikai fejlesztésre formulázzák, és ez fontos kutatási terület a következő generációs adjuváns vakcinák kifejlesztésében.
ANYAGOK ÉS METÓDUSOK
Állatok.
MyD88 és WT csontvelő kiméra egerek előállítása.
Csontvelő kiméra egereket állítottunk elő 107 csontvelő sejt intravénás injektálásával az egész testet besugárzó (950 cGy) befogadó egerekbe (47). A kiméra egereket rHA plusz adjuvánssal immunizáltuk 6 héttel a csontvelő transzferje után. A kimérizmus értékeléséhez CD45.1 és CD45.2 kongén markereket alkalmaztunk WT és Myd88 -/- egerekben. Öt és 11 héttel a csontvelő transzferje után a befogadó egerek perifériás vérének mononukleáris sejtjeit CD45 markerekre festettük, hogy a donorsejtek százalékos arányát áramlási citometriával elemezzük. A csontvelő transzfert követő 5. és 11. héten az átlagos kiméra százalékos arányt 91,3% ± 3,1%, illetve 96,4% ± 2,0% (átlag ± szórás).
Reagensek.
Az 1Z105 és 1V270 vegyületeket az UCSD-n található Carson laboratóriumban szintetizáltuk az előzőekben leírtak szerint (22, –24), dimetil-szulfoxidban (DMSO; Sigma-Aldrich, St. Louis, MO) oldva 20–100 mM törzsoldatokként, és tároltuk. -20 ° C-on. Ezeknek a vegyületeknek az endotoxinszintjét az Endosafe (Charles River Laboratory, Wilmington, MA, USA) alkalmazásával határoztuk meg, és megerősítették, hogy azok 10 endotoxin egység (EU)/μmol alatt vannak. Az AddaVax és a VacciGrade nagy molekulatömegű (HMW) poli (I · C) termékeket az Invivogen-től (San Diego, Kalifornia) vásároltuk.
Rekombináns HA-t készítettünk a korábban leírtak szerint (48, 49). Röviden: az A/Puerto Rico/8/1934 (H1N1) (PR/8) és az A/Kalifornia/04/2009 (H1N1 pandémiás) (Cal/09) influenza vírusból származó rHA antigéneket expresszáltuk bakulovírus vektorokból a High Five sejtekben (BTI-TN-5B1-4 sejtek; a Bécsi Biotechnológiai Intézet szubklónja) a laboratóriumban oldható trimerekként, a T4 fág fibritin természetes trimerizációs doménjének és egy C-terminális hexahistidin tag felhasználásával a tisztításhoz, az előzőekben leírtak szerint (48, 49 ). A fehérjét Ni-nitrilotriacetsav (NTA) –agaróz gyöngyökkel tisztítottuk (Qiagen, Hilden, Németország).
In vivo immunizációs vizsgálatok.
A BALB/c WT, C57BL/6 WT, Tlr4 -/-, Tlr7 -/-, Tlr4. TLr7 -/- (kettős kiesés), Myd88 -/- és Ticam Lps2 egereket i. 1V270-vel (10,8 μg/injekció, ami 10 nmol/állatnak felel meg), 1Z105-tel (89,4 μg/injekció, egyenértékű 200 nmol/állat), vagy 1V270 (10 nmol/állat) és 1Z105 (200 nmol/állat) kombinációjával, vagy olyan dózisokban, amelyeket a dózis-válasz kiértékeléshez az ábra jelmagyarázatában másként megadunk, 50 μl 10% DMSO sóoldatban (vivőanyag) teljes térfogatában. A kontrollok nem tartalmaztak adjuvánst (antigén 10% DMSO-ban sóoldatban), vivőanyagot, poli (I · C) [10 μg poli (I · C) plusz antigént a hordozóban] és AddaVax-ot (1: 1 arány az antigénnel sóoldatban) . A csak adjuváns kontrollt (10 nmol 1V270 és 200 nmol 1Z105 hordozóban) korábban értékelték, és megállapították, hogy nincs hatása a fertőzött egerekre önmagában a hordozóhoz viszonyítva (18). Minden egeret i. rHA-val (2 μg rPR/8 HA/egér, vagy 5 μg rPR/8 HA/egér az adjuváns dózis-válasz kísérletben). Az összes immunizálást i.m. a gastrocnemius izomba.
Egérinfluenza vírus okozta fertőzés.
Egérhez igazítva (egér tüdőn keresztüli soros áthaladással a Gain-of-Function Moratorium előtt végzett munkában) A/Hollandia/602/2009 (H1N1) (NL/09) és A/Puerto Rico/1934 (H1N1) ( PR/8) 8-10 napos embrionált csirketojásban növesztették. Az egér 50% -os letális dózisa (mLD50s) 10 PFU és 30 PFU volt, a 8-10 hetes nőstény BALB/c egerekben meghatározva. Az egereket ketamin-xilazinnal altattuk és megfertőztük i.n. 50 μl foszfáttal pufferolt sóoldatban (PBS) 100 PFU NL/09 vagy 300 PFU PR/8 térfogattal. Minden vizsgált állatot naponta ellenőriztünk testtömegük szempontjából, és felöltük őket, amikor elérték az IACUC által jóváhagyott végpontokat.
Passzív szérumtranszfer-vizsgálat.
A passzív szérumtranszfer vizsgálathoz 6–8 hetes WT BALB/c nőstény egereket 0 és 3 héten immunizáltunk rPR/8 HA plusz 1V270/1Z105 vagy rPR/8 HA hordozóban. Az egereket 10 héttel az első immunizálás után elvéreztettük, és a szérumokat mikrocentrifugálással tisztítottuk. A szérumokat 56 ° C hőmérsékleten inaktiváltuk, és a szérumok 200 μl-es alikvot részeit átadtuk i.p. injekció naiv 6–8 hetes BALB/c nőstény egereknek. Az egereket passzív szérumtranszfer után 3 órával 10 ml D50 PR/8 vírussal fertőztük, és naponta ellenőriztük a testtömeg változását.
CD4 + sejtek kimerülésének vizsgálata.
A vakcinálás után a CD4 + sejtek kimerültek. Röviden, a BALB/c egereket rPR/8 HA plusz 1V270/1Z105-gyel immunizáltuk, és 3-4 hét múlva a monoklonális antitestet (MAb) GK 1.5 (200 μg/injekció; BioXCell, West Lebanon, NH) adtuk be i.p. a –2. és a +1. napon a vírusfertőzéshez (0. nap) viszonyítva a CD4 + sejtek kimerítésére. Izotípus kontrollként a MAb LTF-2-t (BioXCell) használtuk. Az egereket homológ PR/8 vírussal vagy heterológ NL/09 vírussal fertőztük, és a súlycsökkenés és a mortalitás alapján vizsgáltuk morbiditást.
Antigén-specifikus antitestek mérése.
Az anti-influenza vírus antitesteket ELISA-ban mértük szubsztrátként, a PR/8 vírust 30% -os szacharózpárnán keresztül ultracentrifugálással, standard módszerekkel tisztítottuk (18). Az EPT-ket a szérum legnagyobb hígításaként határoztuk meg, amely a háttérszint háromszorosát eredményezte. A teljes IgG-t a korábban leírtak szerint detektáltuk (18).
Influenza vírus titerek.
Az influenza vírustitereket MDCK sejtekben határoztuk meg, korábban ismertetett plakk-vizsgálattal (50).
- Az étrendem jobb, mint a tiéd, Abel James vad étrendje az életed számára mindennapi égetéssel működhet
- Csokoládét kell bevenni az étrendbe Harvard Health
- Narancs fogyáshoz 4 ital narancslével, amely csodákat tehet az étrenddel - NDTV étel
- A Pramlintide gyakorlati tippjei a Symlin jobb diaTribe működéséhez
- Vényköteles 90 napos vőlegény Larissa fogyás rangsor Dr. Simon T Garza súlycsökkentő munka Slcrb