A szokásos lipidpanel nem elegendő a magas zsírtartalmú, alacsony szénhidráttartalmú ketogén étrendben lévő betegek ellátásához
Nicholas G. Norwitz
1 Élettani, anatómiai és genetikai tanszék, Oxfordi Egyetem, Oxford, Egyesült Királyság
2 Harvard Medical School, Boston, MA, Egyesült Államok
Vyvyane Loh
3 Transform Alliance for Health, Newton, MA, Egyesült Államok
Társított adatok
A tanulmányhoz készült összes adatkészlet a cikkben/kiegészítő anyagban található.
Absztrakt
A zsíros, alacsony szénhidráttartalmú ketogén étrend nemrégiben népszerűvé vált a fogyás és számos krónikus betegség kezelésében; az általános orvosi közösség azonban továbbra is aggodalmának ad hangot a magas zsírtartalmú étrend szérum lipidekre és kardiovaszkuláris kockázatra gyakorolt hatása miatt. Ebben egy fiatal férfiról számolunk be, aki ketogén étrendet alkalmazott gyulladásos bélbetegségének kezelésére. Egyébként a szérum lipidjeiben olyan változásokat figyeltek meg, amelyeket a jelenlegi szabványok szerint károsnak tartanának. Lipidprofiljának kritikusabb elemzése azt sugallja, hogy az általa tapasztalt változások nem lehetnek veszélyesek, és legalábbis számos paraméter tekintetében javulást jelenthetnek. Ez az esettanulmány bemutatja, hogy a lipidpanelek jelentésének és felülvizsgálatának módja hogyan vezethet félrevezető következtetésekre, és rámutat arra, hogy legalább az ketogén étrendben lévők gondozásában árnyaltabb elemzéseket kell végezni a lipid szubfrakcionálásokról az orvosok érdekében optimális ellátás és klinikai ajánlások biztosítása érdekében.
Bevezetés
A ketogén diéták magas zsírtartalmú, alacsony szénhidráttartalmú étrendek, amelyek a májat ketontestek létrehozására késztetik, különösen a keton test β-hidroxi-butirát, metabolikus energiaforrás és jelzőmolekula, amelyet evolúciósan úgy terveztek, hogy hatékonyan táplálja az agyat és a testet szénhidráthiány idején. Bár a ketogén étrendet végrehajtó klinikai vizsgálatokat eddig nehéz volt elvégezni, és további kutatásokra van még szükség, számos adat bizonyítja, hogy a ketogén étrend számos olyan krónikus betegség kezelésében hasznos lehet, amelyeknél közös gyulladás van, mint közös patológia ( 1–7). E betegségek egyike a fekélyes vastagbélgyulladás, egy gyulladásos bélbetegség. A ketogén diéták csillapíthatják a gyomor-bél traktus gyulladását azáltal, hogy gátolják az NLRP3 gyulladásos aktivitását (8), elősegítik a bél őssejt-regenerálódását és a bélgyógyulást (9), valamint serkentik az epesavak felszabadulását, amelyek megkönnyítik a bél immunrendszerének homeosztázisát (10, 11 ).
Eset leírása
300 g), 15–20% fehérjéből származik (
130 g), és 4-5% szénhidrátból származik (
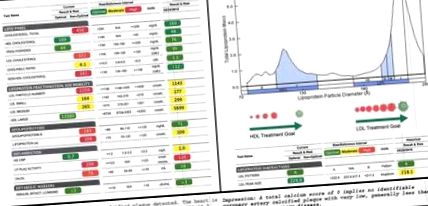
30 g). Saját maga szerint a legfontosabb zsír-, fehérje- és szénhidrátforrások között volt az extra szűz olívaolaj és az avokádó, a tenger gyümölcsei, valamint az alacsony szénhidráttartalmú, magas rosttartalmú zöldségek. A mediterrán stílusú ketogén étrend elfogadásától számított egy héten belül gyomor-bélrendszeri tünetei javultak, fekális kalprotektinje 123-ról 19 μg/g-ra esett vissza, ami az 1A. Ábra normális tartományába esik). Ezeket a látszólag kedvezőtlen és drámai változásokat kis részben ellensúlyozta HDL-C-értékének javulása 48-ról 109 mg/dl-re. Mivel az összkoleszterin, a HDL-C és az LDL-C a szokásos lipidpanelen jelentett koleszterinparaméterek, ezeket az intézkedéseket általában az alany gondozásának irányítására használják. Valójában a Framingham-től kapott, de a 15–34 éves korosztály számára megállapított, módosítható kockázati tényező-pontozási kritériumok szerint ezek a változások látszólag az alany érelmeszesedés kockázatának négyszeres növekedését jelentik (16). Azonban ebben a témában egy teljes frakcionált panelt folytattak, amely tartalmazta az alany LDL és HDL lipoprotein részecskéinek, az LDL és a HDL részecskeszámának, az Apo (B) tömegének, az oxLDL, az Lp (a) és a PL méretarányos lebontását. -PLA2 aktivitás (1A, B ábra).
Lipid szubfrakcionálás. (A) Az alany lipidjei a ketogén étrend megkezdése előtt a jobb oldalon láthatók. 7 hónapos lipidjei a bal oldalon láthatók. A zöld, a sárga és a piros optimális, közepes és magas kardiovaszkuláris kockázatot jelent, az izolált változók standard referenciatartománya alapján. (B) Az alany lipoprotein-méreteloszlását a HDL multimodális eloszlása jellemzi, a legnagyobb csúcs a nagy HDL-ben van, és az LDL-ben erős torzítás áll távol az aterogén, kicsi LDL-től és a nagy LDL-től. (C) Az alany koszorúér-kalcium-vizsgálatának eredménye, amelyet a 7 hónapos követés idején hajtottak végre, jelezve, hogy alig vagy egyáltalán nem meszesedett plakk-felhalmozódás.
Megjegyzendő, hogy a 7 hónapos követés idején a koszorúér kalciumvizsgálatát is elvégezték a plakkok képződésének funkcionális vizsgálataként. Jelentős eredményt nem tárt fel, és 0-os pontszámot jelentett, ami arra utal, hogy nincsenek meszesedett aterogén plakkok (1C ábra).
Vita
Egy szokásos lipidpanel azt mutatta volna, hogy ebben a témában a ketogén étrend az összkoleszterin és az LDL-C nagymértékű növekedését indukálta, mindkét paramétert az „optimális” tartományról a „magas kockázatú” küszöbértékének kétszeresére növelve. hatótávolság. Már a szubfrakcionálásnál is a jelentés látványa klinikai aggodalomra adott okot: a színparaméterek elsöprő eltolódása a zöld/sárga normalizálódásától a riasztó sárga/piros színig (1. ábra). Ezért valószínű, hogy ha ezt a vizsgálati alanyot csak egy szokásos lipidpanel elemezte, vagy ha a szubfrakcionálás eredményeit nem holisztikusan és kritikusan vizsgálták, akkor a klinikai ajánlás az volt, hogy az alany abbahagyja ketogén étrendjét, amely vélelmezett szere vastagbélgyulladás remissziója. Továbbá, ennek a betegnek 24 évesen statint is írhattak. Tekintettel a statinok elsődleges megelőzésre vonatkozó vegyes bizonyítékaira és annak lehetőségére, hogy az alacsony kockázatú egyéneknél (ideértve azokat is, akiknek a koszorúér-kalcium pontszáma 0), hosszú távú használat hozzájárulhat az érelmeszesedéshez (17), egy ilyen ajánlás negatív hosszú távú kardiovaszkuláris egészségi következményekkel jártak.
A következők egy árnyaltabb elemzése és megbeszélése a vizsgálati alany lipidpanelének legrelevánsabb változásairól, amelyek azt javasoljuk, hogy ne jelentenek akkora kockázatnövekedést, mint egyes izolált intézkedések felületes elemzése, és a jelentés színskálája egyébként utal rá. Akár azt is fel lehetne hozni, hogy ezek a változások javulást jelentenek.
Ezután megvizsgálhatjuk az LDL-koleszterint, mint az alany teljes koleszterinszint-növekedésének fő hozzájárulóját. A kiindulási érték és a követés között az alany LDL-C-értéke 90-ről 321 mg/dl-re emelkedett, az előbbi mértéket „optimálisnak”, az utóbbit pedig riasztó piros színnel jelölték meg, amely kétszerese a „magas kockázatú” küszöbértékének ( 1A. Ábra).
Azonban nem minden LDL részecske egyenlő. Az LDL-C és a kardiovaszkuláris kockázat közötti összefüggést az LDL-C és az atherogén kis sűrű és/vagy oxidált LDL közötti kapcsolat vezérli (12, 13). Elsősorban a kis sűrű és/vagy oxidált LDL részecskék képesek behatolni az endoteliális falba, keringő makrofágok által felvenni őket, és hozzájárulhatnak a habsejtek és a lepedékképződéshez (31, 32). A nagy LDL-részecskék ezzel szemben nem mutatnak összefüggést a kardiovaszkuláris kockázattal, és valójában kardioprotektívek lehetnek (13, 33). Az alany LDL-P változásának áttekintése (1 143-ról 2 259-re) és a méretalapú LDL-szétfrakcionálás feltárja, hogy az LDL-növekedését kizárólag a nagy LDL növekedése vezérli. Kis és közepes LDL-je még 8, illetve 11% -os csökkenést is mutatott (1A. Ábra).
Mivel az LDL biológiai funkciója - legalábbis részben - a trigliceridek májból a perifériás szövetekbe történő szállítása üzemanyagforrásként, egyáltalán nem meglepő, hogy az alany a magas zsírtartalmú étrendjét figyelembe véve megnövekedett a nagy LDL-ben. Ezenkívül az a tény, hogy csak a nagy LDL-szintje nőtt, azt sugallja, hogy az alany nagy LDL-részecskéi nem voltak hajlamosak idővel közepes és kicsi LDL-re bomlani. Közvetlenebbül fogalmazva: az alany specifikus növekedése a nagy LDL-ben összhangban áll az LDL-forgalom és a májfelvétel növekedésével.
Ez pozitív és adaptív választ jelent az alany szénhidrátalapú anyagcsere-üzemanyagokról zsíralapú anyagcsere-üzemanyagokra való áttérésére. Ez az elemzés és az LDL-anyagcsere megbeszélése azt is megmagyarázza, hogy az LDL-P és az Apo (B) növekedése, mindkettő, a nagy LDL-P növekedése miatt, szintén egészséges és pozitív alkalmazkodást jelenthet.
Harmadrészt egy kevésbé ismert és vizsgált lipoprotein részecskét, az Lp (a) -ot tekinthetünk meg. Szerkezetileg az Lp (a) nagyon hasonlít az LDL-hez, azzal a különbséggel, hogy az Apo-B100-hoz csatolva glikoprotein farokkal, apolipoproteinnel (a) rendelkezik. Az apolipoprotein (a) szekvenciájában és alakjában figyelemre méltóan hasonlít a plazminogénhez, az enzimhez, amely aktiválódva kötődik a fibrinhez és lebontja a vérrögök felbomlása érdekében. Az (a) apolipoprotein azonban nem rendelkezik ugyanolyan proteáz aktivitással, mint a plazminogén. Az Lp (a) így versenyezhet a plazminogénnel a fibrinkötésért (gátolva a fibrinolízist), és hozzájárulhat az endoteliális vérrögök, azaz az aterogén plakkok kialakulásához (34). Ezért van értelme, hogy az Lp (a) szint pozitívan korrelál a kardiovaszkuláris kockázattal (35).
Az Lp (a) másik szerepét szintén feltételezték, miután megfigyelték, hogy az ApoB-tartalmú lipoproteinekhez kötött oxidált lipoproteinek (oxLP-k) 90% -a valóban kötődik az Lp (a) -hoz, és hogy az LP-PLA2, egy enzim, amely lebontja az atherogén Az oxLP-k Lp (a) -val társulnak. Felvetődött, hogy az Lp (a) -LP-PLA2 az oxLP-k megkötőjeként működik (36). Ezért az alany Lp (a) és LP-PLA2 aktivitásának növekedése adaptív válasz lehet oxidatív státusának növekedésére, amelyet az oxLDL-értékének növekedése jelez (2. ábra).
Standard lipidpanel és lipid szubfrakcionálás. A bal oszlop azokat a változásokat jelöli, amelyeket az alany étrendje váltott ki, és amelyeket a szokásos lipidpanelen észleltek volna, a klinikai hatás valószínű lefolyásával együtt. A jobb középső oszlop azokat a változásokat jelöli, amelyeket szubfrakcionálás útján észleltek, és alatta az ajánlott klinikai cselekvési irányt. A piros a negatívnak vélt változásokat jelzi; zöld jelzi a feltételezett pozitív változásokat. Az Apo (B) zárójelbe kerül, a nagy LDL alatt, mert az alany Apo (B) tömegének növekedését a nagy LDL növekedése okozta. A jobb szélső oszlop diagramja azt a hipotézist szemlélteti, hogy az alany megnövekedett Lp (a) és LP-PLA2 aktivitása adaptív, védő válaszokat jelenthet az oxLDL-értékének növekedésére.
Egy további árnyalat közbevetése érdekében, mielőtt visszatérnénk az alany oxLDL témájához, lehetséges, hogy megemelkedett LP-PLA2 aktivitása egyáltalán nem jelent kockázatot, mert (i) Apo-B tartalmú részecskéknél az LP-PLA2 a legaktívabb kis LDL-re (37, 38) és (ii) a HDL-asszociált LP-PLA2 aktivitás antiaterogén lehet (36, 39, 40). Ezért ennek az alanynak az alacsony kis-LDL/HDL-részecske aránya kardioprotektív tényezőt rejthet egy atherogén leple mögött.
Az alany oxLDL-értékének növekedése az egyetlen változás, amely véleményünk szerint valószínűleg negatív. Tekintettel arra, hogy az alany étrendjének változása magában foglalta az oxidációra hajlamos többszörösen telítetlen zsírok (diófélék, magvak és zsíros halak formájában történő) bevitelének növekedését és az antioxidáns tartalmú termékek (beleértve a C-vitamint tartalmazó) bevitelének csökkenését citrusfélék) nem teljesen meglepő, hogy oxLDL-je megnőtt. Külön megjegyezzük a C-vitamint, mint antioxidánst, mert az Lp (a) másik javasolt funkciója a C-vitamin helyettesítője (34). Ez a hipotézis abból a megfigyelésből fakad, hogy (i) a C-vitamint endogén módon termelő állatok általában nem rendelkeznek Lp (a) -val vagy nem mutatnak szívbetegséget, (ii) fordított összefüggés van a C-vitamin státus és az Lp (a) szint között, és ( iii) a C-vitamin elengedhetetlen a kollagén szintézisének és az endothel helyreállításának folyamatában. Így az elégtelen C-vitamin evolúciósan adaptív válasza az antifibrinolitikus faktor, az Lp (a) szintjének növelése lenne, hogy alvadékképződést indukáljon és megakadályozza a túlzott vérzést (34).
Ezért feltételezzük, hogy ez a téma növeli-e az alacsony szénhidráttartalmú C-vitamint tartalmazó ételek (például eper, kaliforniai paprika, brokkoli és karfiol) és/vagy C-vitaminnal való kiegészítését, és csökkenti a többszörösen telítetlen zsírok fogyasztását is, Ha oxidációval szemben ellenállóbb egyszeresen telítetlen zsírokra és esetleg néhány telített zsírra cserélik őket, amelyek kevésbé valószínű, hogy befolyásolják az LDL-t (ideértve a szűz/nyers kókusztermékeket és a sztearinsavban gazdag kakaót), akkor az oxLDL csökkenését és ennek következtében az Lp csökkenését jelzi ( a) és az LP-PLA2 aktivitás (2. ábra). Ezeket a klinikai ajánlásokat megtették, de a tanulmány tárgya átköltözött, és jelenleg nem áll rendelkezésre nyomon követésre.
Jelentésünknek számos korlátja van. Először ebben a páciensben nem követtek szérum citokineket (például TNF-α és IL-1β) vagy szérum endotoxint. Informatív lett volna dokumentálni, hogy ketogén étrendje javította-e ezeket a markereket az állandóan alacsony hsCRP ellenére, amint arról más ketogén étrendet alkalmazó betegek beszámoltak (3). Ezenkívül sajnálatos, hogy ez a téma jelenleg nem áll rendelkezésre nyomon követésként annak dokumentálásához, hogy az étrendjének ajánlott kiigazítása megváltoztatta-e az Lp (a), az LP-PLA2 aktivitást és az oxLDL szintet, ahogy feltételeztük. Mindazonáltal az alany szubfrakciójának elemzése, annak funkcionális megfigyelésével együtt, hogy a koszorúér kalcium pontszáma 0, ami nem jelzi az ateroszklerotikus plakk képződését, azt állítja, hogy a lipidjeiben bekövetkező változások nem lehetnek negatívak, hanem pozitívak.
Összegzés és jelentőség
Itt beszámoltunk egy olyan alanyról, aki ketogén étrendet alkalmazott fekélyes vastagbélgyulladás ellen, amely sikeresen remisszióba hozta állapotát, de a szérum lipidprofiljának látszólag káros változásával is társult. Ezeknek a lipidprofil-változásoknak a mélyebb elemzése feltárta, hogy sok paraméter valójában pozitív lehet. Ezért ahelyett, hogy azt ajánlanánk az alanynak, hogy hagyja abba a diétát, amely sikeresnek bizonyult betegségének kezelésében, enyhe táplálkozási alkalmazkodást javasoltunk, hogy lássuk, ez optimalizálja-e lipidprofilját és egészségét.
E jelentés jelentősége háromszoros: (i) Bár a klinikai anekdoták azt mutatják, hogy a ketogén étrend javíthatja a gyulladásos bélbetegségekkel küzdő betegek tüneteit, kevés publikált adat található a témában (valószínűleg az emberi mikrobiómák nagy változékonysága miatt, és így a beteg reagálóképessége). Ez a jelentés egy olyan esetet dokumentál, amikor a ketogén étrend egyértelműen javította a beteg vastagbélgyulladás tüneteit és a laboratóriumi gyulladásos markereit. (ii) Itt olyan adatokat szolgáltatunk, amelyek határozottan arra utalnak, hogy legalább a ketogén étrendet folytató alanyok esetében a szokásos lipidpanelek nem elegendőek, és hogy az optimális klinikai ajánlások tájékoztatása érdekében szükség lehet lipid-szubfrakcionálódások elemzésére. Zárásként (iii) ez az eset példát mutat az orvostudomány pozitív tendenciájára a tápszeres ellátás helyett a holisztikus, személyre szabott és integratív ellátás felé.
Adatelérhetőségi nyilatkozat
A tanulmányhoz készült összes adatkészlet a cikkben/kiegészítő anyagban található.
Etikai nyilatkozat
A helyi jogszabályokkal és az intézményi követelményekkel összhangban az emberi résztvevőkről szóló vizsgálat etikai felülvizsgálata és jóváhagyása nem volt szükséges. Ehhez a tanulmányhoz a nemzeti jogszabályokkal és az intézményi követelményekkel összhangban nem volt szükség a részvételhez szükséges írásos beleegyező beleegyezésre. Az e cikkben szereplő potenciálisan azonosítható képek vagy adatok közzétételéhez írásos tájékoztatáson alapuló beleegyezést kaptunk az egyéntől.
Szerző közreműködései
Minden felsorolt szerző jelentős, közvetlen és szellemi hozzájárulást adott a műhöz, és jóváhagyta közzététel céljából.
Összeférhetetlenség
A szerzők kijelentik, hogy a kutatást bármilyen kereskedelmi vagy pénzügyi kapcsolat hiányában végezték, amely potenciális összeférhetetlenségként értelmezhető.
Köszönetnyilvánítás
Quest Diagnostics - A Cleveland HeartLab Kardiometabolikus Kiválósági Központ gondoskodott a jelentés teszteléséről. A tanulmányalany emellett elismeri családja és közeli barátja, Thomas DeLauer támogatását.
Szójegyzék
Rövidítések
| Apo (B) | apolipoprotein B |
| HDL-C | HDL-részecskék HDL-tartalma |
| HDL-P | HDL részecskeszám |
| hsCRP | nagy érzékenységű C-reaktív fehérje |
| LDL-C | Az LDL-részecskék LDL-tartalma |
| LDL-P | LDL részecskeszám |
| Lp (a) | lipoprotein (a) |
| LP-PLA2 | lipoprotein asszociált foszfolipáz A2 |
| oxLDL | oxidált LDL. |
Lábjegyzetek
Finanszírozás. NN hálásan köszönetet mond a Keasbey Emlékalapítványnak az oxfordi kutatásainak finanszírozásáért.
- Mesterséges édesítőszerek okozhatnak súlygyarapodást SCNM betegellátás
- Futó Térdfájdalommal Betegellátással Online
- Vérvizsgálat lipidpanel
- Ágyhoz kötött betegellátás otthon HealthCare atHOME
- Kiegészített, magas zsírtartalmú, alacsony szénhidráttartalmú étrend a glioblastoma klinikai rák kezelésére