A tamoxifen csökkenti a zsírtömeget azáltal, hogy fellendíti a reaktív oxigéneket
L Liu
1 Emberi táplálkozás, ételek és testmozgás tanszék, Fralin Élettudományi Intézet, Mezőgazdasági és Élettudományi Főiskola, Virginia Tech, Blacksburg, VA, USA
P Zou
1 Emberi táplálkozás, ételek és testmozgás tanszék, Fralin Élettudományi Intézet, Mezőgazdasági és Élettudományi Főiskola, Virginia Tech, Blacksburg, VA, USA
L Zheng
1 Emberi táplálkozás, ételek és testmozgás tanszék, Fralin Élettudományi Intézet, Mezőgazdasági és Élettudományi Főiskola, Virginia Tech, Blacksburg, VA, USA
L E Linarelli
1 Emberi táplálkozás, ételek és testmozgás tanszék, Fralin Élettudományi Intézet, Mezőgazdasági és Élettudományi Főiskola, Virginia Tech, Blacksburg, VA, USA
S Amarell
1 Emberi táplálkozás, ételek és testmozgás tanszék, Fralin Élettudományi Intézet, Mezőgazdasági és Élettudományi Főiskola, Virginia Tech, Blacksburg, VA, USA
Egy Passaro
1 Emberi táplálkozás, ételek és testmozgás tanszék, Fralin Élettudományi Intézet, Mezőgazdasági és Élettudományi Főiskola, Virginia Tech, Blacksburg, VA, USA
D Liu
1 Emberi táplálkozás, ételek és testmozgás tanszék, Fralin Élettudományi Intézet, Mezőgazdasági és Élettudományi Főiskola, Virginia Tech, Blacksburg, VA, USA
Z Cheng
1 Emberi táplálkozás, ételek és testmozgás tanszék, Fralin Élettudományi Intézet, Mezőgazdasági és Élettudományi Főiskola, Virginia Tech, Blacksburg, VA, USA
Társított adatok
Absztrakt
Az elhízás kialakulásának molekuláris mechanizmusának megértése érdekében különféle rágcsáló-modelleket hoztak létre a különböző gének funkcióinak növekedésének vagy elvesztésének tanulmányozására. 6, 7 Ebből a célból a Cre/lox helyspecifikus rekombinációs rendszer sokoldalú volt feltételes egérmutánsok előállításához, szabályozva a génexpressziót és az aktivitást a célszövetekben. Különösen a tamoxifent (Tam) alkalmazzák a Cre rekombinázok in vivo spatiotemporálisan történő aktiválására intraperitoneális (I.P.) vagy szubkután alkalmazással. 10, 11, 12 Tam injekciója 1–8 mg/testtömeg-kg dózisban 5 egymást követő napon át törli a célgéneket, ezáltal létrehozva egy sokoldalú rendszert a funkcionális gének elhízásban történő tanulmányozására. 8, 9, 10, 11, 12
Eredmények
Tam indukálta az egerek zsírtömegének csökkenését
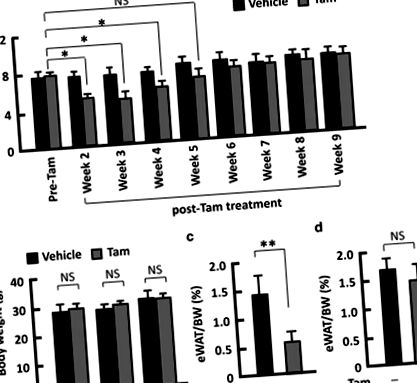
A Tam zsírtömegre gyakorolt hatásának tesztelésére 5 napos I.P. Tam (1 mg/20 g testtömeg) beadása a villás doboz O1 (FoxO1) floxált egereken, amelyek Cre, rekombinázt (f-FoxO1), 15, 16, 17 nem tartalmaznak, a korábban kialakított szabványos protokoll betartásával. Két héttel a Tam beadása után a testzsír 34% -kal csökkent (P 1a ábra). A megállapítások igazolásához hasonló módon kezeltük az inzulinreceptor 1-es szubsztrátot (Irs1) és az Irs2 kettős floxos egeret Cre rekombináz (df-Irs) nélkül, 15, 16, és megállapítottuk, hogy a zsírtömeg is jelentősen csökkent (26%, P ábra 1b; S1B kiegészítő ábra). A zsírtömeg-változás kinetikájának monitorozása azt sugallta, hogy a csökkenés az 5. hétig (df-Irs egereknél a 4. hétig) tartós volt, ezt követően a zsír százalékos aránya összehasonlítható volt az előkezelésekkel (1a. Ábra; S1A kiegészítő ábra). Ennek a megállapításnak megfelelően az epididymális fehér zsírszövet (eWAT) súlya a Tam-kezelt f-FoxO1 egerekben szignifikánsan csökkent a 2. héten, míg a 6. héten nem volt szignifikáns különbség (1c. És d. Ábra). Ezzel szemben a vivőanyag injektálása a testzsír tömegében észrevehetetlen változást okozott (1a. Ábra; S1A. Kiegészítő ábra). Ezért az egerek zsírtömegének csökkenése elsősorban a Tam kezelés miatt következett be. Tekintettel arra, hogy mindkét egérmodell megosztotta ezt a fenotípust, az alábbi mechanisztikus vizsgálathoz f-FoxO1 egereket használtunk.
Az a mechanizmus, amellyel a Tam csökkenti a zsírtömeget, több sejtes eseményt tartalmaz. A Tam-kezelés fokozta az apoptózist és az autofágia folyamatokat, amelyek csökkentik az adipocita számot, és amelyek szerepet játszanak a zsírszabályozásban. 2, 18, 19, 20, 21, 22, 23 Valóban, az érett adipociták sejtsűrűsége és populációja csökkent Tam kezelés után. A Tam szintén elősegítette az adipocita dedifferenciálódást és a ROS termelést, míg a ROS szint normalizálása jelentősen enyhítette a Tam által kiváltott adipocita dedifferenciálódást, apoptózist és autofágia, egyidejűleg az érett adipocita populáció és a zsírtömeg helyreállításával. Adataink együttesen erőteljesen azt sugallják, hogy a rövid távú (5 napos) Tam-kezelés csökkenti a zsírtömeget a ROS-termelés fokozása révén.
Kimutatták, hogy a Tam indukálja az ROS-t és az oxidatív stresszt az emlőrákos sejtekben, a hepatoblastoma sejtekben, a retina sejtjeiben és a vérlemezkékben a NAD (P) H-oxidáz, az enzim, amely a makrofágok ROS-termelését is elősegíti. 32, 42, 43, 44, 45, 46 A Tam ROS-fokozó hatását kiterjesztették és tovább igazolták adipocytákban és zsírszövetekben végzett vizsgálatunk. Fontos, hogy azt tapasztaltuk, hogy a ROS-emelkedés a PPARγ downregulációt és az adipocita dedifferenciálódást eredményezte, ami alátámasztja azt az elképzelést, hogy az érett adipocyták stressz körülmények között dedifferenciálódnak. 34, 35 Kimutatták, hogy a proinflammatorikus adipocitokinek (például TNFa) elősegíthetik az adipocita dedifferenciálódását a PPARγ downregulációján keresztül. 34, 35 Tekintettel arra, hogy az ROS-emelkedés vagy az oxidatív stressz növeli a TNFα termelést, a 47 Tam elősegítheti az adipocita dedifferenciálódását az ROS – TNFα – PPARγ tengely aktiválásával. Ennek érdekében szerepet játszhat a zsírszövet makrofág infiltrációja, mivel ezekről a fagocitákról kimutatták, hogy ösztönzik az ROS és TNFα termelést, és érzékenyen reagálnak a ROS és TNFα által közvetített jelátviteli kaszkádokra is. 46, 48
A Tam hatása az emberek, például az emlőrákos betegek zsírtömegére továbbra sem meggyőző. Bár a Tamról azt állították, hogy antiösztrogén hatása révén növeli a zsírtömeget, 13 legújabb tanulmány lazította a következtetést azzal, hogy kimutatta, hogy a Tam nem befolyásolja az emlőrákos betegek zsírtömegét. Meg kell jegyezni, hogy az egerek Tam dózisa és kezelési időtartama ebben a vizsgálatban jelentősen eltér az emlőrákos betegek hosszú távú Tam kezelésének időtartamától. A Cre rekombináz aktiválásához a célgének kiiktatásához az állatmodelleket általában 5 egymást követő napon keresztül kezeljük (1-8 mg/20 g testtömeg vagy 50-400 mg/testtömeg kg adagolása naponta egyszer). 8, 9, 10, 11, 12 Azonban az Egyesült Államokban az emlőrákos betegek Tam-terápiája általában 5 évig tart, 20 mg-os dózissal (akár egy 20 mg-os tabletta, akár két 10 mg-os tabletta) havonta naponta egyszer. . 49, 50, 51 Ha feltételezzük, hogy az emlőrákos betegek testtömege 50 kg és 80 kg között van, a Tam átlagos napi használata 0,25–0,4 mg/kg lenne, az adag 0,06–0,8% lenne az állatmodelleknél . Különböző dózisok és a kezelés időtartama miatt a Tam egereknek ebben a vizsgálatban megfigyelt hatása az egér zsírtömegére nem biztos, hogy fenokopíros Tam-terápiás emlőrákos betegeknél.
Anyagok és metódusok
Anyagok
A Dulbecco által módosított Eagle (DMEM) táptalaj a Corning Inc.-től (Manassas, VA, USA) volt. A szarvasmarha magzati széruma (FBS) a GeneMate-től (Kaysville, UT, USA) származott. A dexametazont, a 3-izobutil-1-metil-xantint (IBMX), a roziglitazont és a Tam-ot a Cayman Chemical-tól (Ann Arbor, MI, USA) szereztük be. A penicillin/sztreptomicin (P/S) a GE Healthcare Life Sciences HyClone Laboratories cégtől (Logan, UT, USA) származott. Az inzulin és a NAC Sigma-Aldrich-től (St. Louis, MO, USA) származott. A foszfáttal pufferolt sóoldatot (PBS) a Caisson Laboratories, Inc. (North Logan, UT, USA) kapta.
A FoxO1 floxolt egereket (f-FoxO1) és az Irs1/Irs2 kettős floxos egereket (df-Irs) tenyésztettük és elhelyeztük a korábban leírtak szerint. 15, 16, 52 Röviden: az egereket műanyag ketrecekben helyeztük el egy 12 órás világos-sötét fotocikluson, szabad hozzáféréssel a vízhez és rendszeres chow-étrendhez. A Tam kezelési kísérletek előtt hím egereket (14-16 hetesek) lemértünk, és a zsírtömeget Bruker Minispec LF90 NMR analizátorral (Bruker Optics, Billerica, MA, USA) mértük. Ezután az egereket egy 2. biológiai biztonságú (BSL2) szobába helyeztük, és Tam-nal (1 mg/20 g testtömeg) vagy a hordozóval (napraforgóolaj) adtuk be I.P. injekció (naponta egyszer, 5 egymást követő napon). A Tam beadása után a ketreceket 2 naponta cserélték a 2. hétig, amikor az egereket a BSL1 szobába vitték, és folytatták a testzsír-tömeg mérését. A kísérleti tervtől függően az egereket lemértük és leöltük, hogy a szöveteket betakarítsuk folyékony nitrogénben történő gyorsfagyasztás céljából, a Tam kezelés után a 2. vagy a 6. héten. Az összes eljárás az NIH irányelvét követte, és a Virginia Tech Intézményi Állattenyésztési és Felhasználási Bizottság jóváhagyta.
Sejtkultúra és kezelés
ROS mérés
Az adipocitákban és a zsírszövetekben a ROS-t a korábban leírtak szerint mértük, 54, 55, sejtáteresztő festékkel, 5,6-karboxi-2 ', 7'-diklór-fluoreszcein-diacetáttal (Carboxy-DCFDA, Molecular Probes, Grand Island, NY, USA). . A gyorsfagyasztott zsírszöveteket lemértük, és pufferolt tápközegbe (5 mmol/l HEPES PBS-ben) helyeztük át a gyors felolvasztás érdekében a szonda diffúziójának javítása érdekében. Gyors felolvasztás után a táptalajt eldobtuk. A mintákat friss táptalajban 8 μM karboxi-DCFDA-nak tettük ki, és keverés közben 45 percig 37 ° C-on inkubáltuk. A táptalajt ezután eltávolítottuk, és a mintákat további lízispufferben (0,1% SDS, Tris-HCl, pH 7,4) inkubáltuk 15 percig 4 ° C-on. Homogenizálás után a mintákat 16 000 x g-vel 20 percig 4 ° C-on centrifugáltuk. A felülúszókat összegyűjtöttük, és fluoreszcencia-analízisnek vetettük alá 530 nm-en 485 nm-es gerjesztés alatt, Synergy H4 hibrid többmódú mikrolemezolvasóval (BioTek Instruments, Winooski, VT, USA).
A ROS mérésére 3T3L1 adipocitákban 1–5 × 106 sejtet gyűjtöttünk ki tipissel, és háromszor mossuk hideg PBS-sel, majd inkubáljuk 8 μM karboxi-DCFDA-val friss táptalajban (5 mmol/l HEPES PBS-ben), és inkubáljuk. 37 ° C-on 45 percig keverés közben. A táptalajt ezután eltávolítottuk, és a mintákat tovább inkubáltuk PLC lízispufferben: 15, 52 (30 mM Hepes, pH 7,5, 150 mM NaCl, 10% glicerin, 1% Triton X-100, 1,5 mM MgCl2, 1 mM EGTA, 10 mM NaPPi, 100 mM NaF, 1 mM Na3VO4) proteáz inhibitor koktéllal (Roche, Branchburg, NJ, USA) és 1 mM PMSF-el kiegészítve 15 percig 4 ° C-on. Homogenizálás után a mintákat 16 000 x g-vel 20 percig 4 ° C-on centrifugáltuk. A felülúszókat összegyűjtöttük, és fluoreszcencia-analízisnek vetettük alá 530 nm-en 485 nm-es gerjesztés mellett, és az összfehérjét DC protein assay-vel (Bio-Rad, Hercules, CA, USA) határoztuk meg egy Synergy H4 hibrid többmódú mikrolemez-olvasón (BioTek). Instruments, Inc.). A ROS-szinteket normalizáltuk az egyes sejtek teljes fehérjéjéhez.
Western blottolás
A szöveti lizátumok előállításához a pillanatszerűen fagyasztott zsírszöveteket lemértük és egy Bullet Blenderrel (Next Advance, Averill Park, NY, USA) homogenizáltuk proteáz inhibitor koktéllal (Roche), 1 mM PMSF, 10 μM TSA-val kiegészített PLC lízispufferben. Trichostatin A, Selleckchem, Houston, TX, USA) és 5 mM nikotinamid (Alfa Aesar, Ward Hill, MA, USA). 15, 52 Sejtlizátumok esetében a 3T3L1 adipocitákat jéghideg PBS-sel mostuk és Bullet Blenderrel homogenizáltuk. A lizátum összes fehérjekoncentrációját DC fehérje assay (Bio-Rad) alkalmazásával határoztuk meg. A Western blot-ot és a képelemzést a korábban leírtak szerint végeztük. Az antitest katalógusszámok és gyártók a következők: hasított kaszpáz-3 nyúl mAb (9664) és LC3B antitest (2775. sz.) A Cell Signaling Technology-tól (Beverly, MA, USA); PPAR-gamma antitest (MA5-14889) és GAPDH antitest (MA5-15738) Pierce-től (Rockford, IL, USA) vagy a Thermo Fisher Scientific-tól (Waltham, MA, USA); és HO1 antitest (3391-100) a Biovision cégtől (Milpitas, CA, USA).
- A napszél a fúzióval szemben Hogyan veszíti el a Nap a tömegét
- A hörcsögöm nagyon sovány, fajának fele normál súlyú (2540-50)
- Oxigén és fogyás
- Inaktív lítium és szilárd elektrolit interfázisú fajok mennyiségi meghatározása grafit elektródákon
- Minta menü a reaktív hipoglikémia HealthLink BC