A táplálékfelvétel csökkentése a fenofibráttal összefüggésben áll a kolecisztokinin felszabadulásával Long-Evans Tokushima patkányokban
Mi-Kyoung park
1 Belgyógyászati Klinika, Orvostudományi Kutatóközpont, Mitochondria Hub Szabályozási Központ, Dong-A Egyetemi Orvostudományi Főiskola, Busan 602-714, Korea.
Ying Han
1 Belgyógyászati Klinika, Orvostudományi Kutatóközpont, Mitochondria Hub Szabályozási Központ, Dong-A Egyetemi Orvostudományi Főiskola, Busan 602-714, Korea.
2 Farmakológiai Tanszék, Orvostudományi Kutatóközpont, Mitochondria Hub Szabályozási Központ, Dong-A Egyetemi Orvostudományi Főiskola, Busan 602-714, Korea.
Mi Sun Kim
1 Belgyógyászati Klinika, Orvostudományi Kutatóközpont, Mitochondria Hub Szabályozási Központ, Dong-A Egyetemi Orvostudományi Főiskola, Busan 602-714, Korea.
2 Farmakológiai Tanszék, Orvostudományi Kutatóközpont, Mitochondria Hub Szabályozási Központ, Dong-A Egyetemi Orvostudományi Főiskola, Busan 602-714, Korea.
Eunhui Seo
2 Farmakológiai Tanszék, Orvostudományi Kutatóközpont, Mitochondria Hub Szabályozási Központ, Dong-A Egyetemi Orvostudományi Főiskola, Busan 602-714, Korea.
Soojeong Kang
2 Farmakológiai Tanszék, Orvostudományi Kutatóközpont, Mitochondria Hub Szabályozási Központ, Dong-A Egyetemi Orvostudományi Főiskola, Busan 602-714, Korea.
So-Young Park
2 Farmakológiai Tanszék, Orvostudományi Kutatóközpont, Mitochondria Hub Szabályozási Központ, Dong-A Egyetemi Orvostudományi Főiskola, Busan 602-714, Korea.
Hyeongjong Koh
2 Farmakológiai Tanszék, Orvostudományi Kutatóközpont, Mitochondria Hub Szabályozási Központ, Dong-A Egyetemi Orvostudományi Főiskola, Busan 602-714, Korea.
Duk Kyu Kim
1 Belgyógyászati Klinika, Orvostudományi Kutatóközpont, Mitochondria Hub Szabályozási Központ, Dong-A Egyetemi Orvostudományi Főiskola, Busan 602-714, Korea.
Hye-Jeong Lee
2 Farmakológiai Tanszék, Orvostudományi Kutatóközpont, Mitochondria Hub Szabályozási Központ, Dong-A Egyetemi Orvostudományi Főiskola, Busan 602-714, Korea.
Absztrakt
A fenofibrát egy szelektív peroxiszóma-proliferátor-aktivált receptor α (PPARα) aktivátor, amelyet hiperlipidémia kezelésére írnak fel. Az a mechanizmus, amely révén a PPARα agonisták csökkentik a táplálékfelvételt, a testsúlyt és az adipozitást, továbbra sem tisztázott. Az ételbevitel csökkentésének egyik magyarázata, hogy a fenofibrát elősegíti a zsírsav oxidációt és növeli a keton testek termelését a gyógyszer szokásos kísérleti adagjánál (100
BEVEZETÉS
A fenofibrátot jelenleg a lipid rendellenességek szabályozására használják diszlipidémiás emberekben [1], és peroxiszóma proliferátor által aktivált receptor α (PPARα) ligandumként működik, amely számos gén expresszióját szabályozza, amelyek fontosak a lipid és a glükóz metabolizmusában. A közelmúltban számos tanulmány megvizsgálta a PPARα agonisták energiafogyasztásra, testtömegre és testzsírra gyakorolt hatását az elhízás rágcsáló modelljeiben. Szelektíven tenyésztett, elhízásra hajlamos patkányokban a fenofibrát (100 mg/kg naponta) csökkentette a testtömeg-növekedést, az adipozitást, az ételt és a takarmány hatékonyságát [2]. Az étkezési fenofibrát (napi 100 mg/kg) szintén csökkentette az elhízott Otsuka Long-Evans Tokushima Fatty (OLETF) zsíros patkányok táplálékfelvételét, testtömegét és zsírosságát [3]. Db/db egerekben a fenofibrát (0,2%, w/w) kezelés csökkent táplálékfelvételhez kapcsolódott [4]. Annak ellenére, hogy a fenofibrát csökkent táplálékfelvételének mechanizmusát nem sikerült megállapítani, számos jelentés azt mutatja, hogy a PPARα agonisták elősegítik a zsírsav oxidációt és növelik a keton testtermelést [5-7]. Amikor a ketontestet, a béta-hidroxi-butirátot perifériásán [8,9] vagy központosan [10] adták be, az csökkentette az élelmiszer-fogyasztást. Ezek az eredmények arra utalnak, hogy a fenofibrát csökkentheti a táplálékfelvételt a ketogenezis miatt a fokozott zsírsav-oxidáció révén.
Megfigyeltük azonban, hogy a fenofibrát alacsony dózisú kezelése (30 mg/kg/nap), amely nem növeli a keton testtermelést, csökkentette a táplálékfelvétel mennyiségét a fiziológiailag normális Long-Evans Tokushima (LETO) patkányokban. az OLETF patkányok megfelelői. Ezzel szemben az OLETF patkányok, amelyekben hiányosak a kolecisztokinin (CCK) -A receptorok, a fenofibrát alacsony dózisú kezelésével nem mutattak semmiféle változást az élelmiszer-bevitelben. Ez a megfigyelés azt jelezheti, hogy a CCK szerepet játszik az élelmiszer-bevitel csökkentésében, ha a fenofibrátot, amely nem növeli a keton testek plazmaszintjét, alacsony dózisban adják be.
A CCK egy olyan hormon, amely a nyombél és a jejunális nyálkahártya sejtjeiből választódik ki zsírra és fehérjére reagálva [11]. A CCK-nak számos élettani hatása van, például lassítja a gyomor kiürülését, modulálja a gyomor-bél motilitását és elnyomja az energiafogyasztást [12]. Az étkezés utáni jóllakottság elsősorban a bélben felszabaduló CCK-nek tulajdonítható, és inkább a vago-vagális reflexen keresztül hat, mintsem közvetlenül a központi idegrendszeri jóllakottság központjára [13]. A CCK-nak két receptora van, a CCK-A (CCK1r) és a CCK-B (CCK2r). Az OLETF patkányok genetikailag hiányzik a CCK-A receptorokból egy mutáció következtében [14]. A CCK-B receptor expressziójával csökkent tuberkus egeret progresszív retina és cochleáris degeneráció és későn megjelenő elhízás jellemzi [15]. Az OLETF patkányok sokkal nagyobb ételt fogyasztanak, és teljes mértékben ellenállnak az exogén CCK gátló hatásainak, valamint a gyomor vagy a bél tápanyag infúziójának az energia bevitelével [16]. A fenofibrát és a CCK kapcsolatának vizsgálatához az OLETF patkányok használhatók kísérleti modellként a CCK receptorhiányos patkányok helyett.
Jelen tanulmányunkban feltételeztük, hogy a fenofibrát anorexigén mechanizmusa összefüggésbe hozható a CCK indukciójával. Megállapítottuk, hogy a fenofibrát fokozza a CCK szintézisét, és hogy a fenofibrát által indukált CCK indukció nem befolyásolja a CCK receptorhiányos OLETF patkányok étvágyát. Ezek az eredmények arra utalnak, hogy a CCK indukció összefüggésbe hozható a fenofibrát által okozott anorexigén mechanizmusok egyikével.
MÓD
Állatok és kezelés
Tíz hetes hím LETO (n = 10) és OLETF (n = 10) patkányokat a Otsuka Pharmaceutical (Tokushima, Japán) adományozott. A patkányokat egyedi ketrecekben tartottuk a Dong-A Egyetem Állattenyésztő Központjának környezetvédelmi szempontból ellenőrzött helyiségében, a kísérleti időszak alatt szabadon hozzáférhettünk a vízhez és a szokásos patkánytojáshoz. Amikor a patkányok 17 hetesek voltak, a LETO patkányokat két csoportra osztották. A LETO-fenofibrát csoportot (n = 5) standard patkány-chow-val és fenofibráttal (Laboratoires Fournier, Green Cross, Dél-Korea) (30 mg/kg/nap) etettük 11 héten keresztül. A LETO-kontrollcsoportot (n = 5) ugyanabban az időszakban csak standard patkánytojással etették. Az OLETF patkányokat szintén OLETF-fenofibrát csoportra (30 mg/kg/nap) (n = 5) és OLETF-kontroll csoportra (n = 5) osztották fel. A kísérlet teljes időtartama alatt az összes patkányt a Koreai Orvostudományi Akadémia által javasolt állatkísérleti irányelvek szerint gondozták. Megmértük az összes patkány napi táplálékfelvételét és testtömegét a speciális tápláléktartályok és a patkányok ketreceinek rendszeres időközönként történő lemérésével. 18 órás éhgyomorra vért vettek a farokérből az éhomi vércukor (FBS), valamint a leptin és a β-keton plazmaszintjének mérésére. 28 hetes korukban az összes patkányt altattuk, és további elemzés céljából feláldoztuk.
Az éhomi vércukor-, keton- és leptinszint mérése
Az FBS-szinteket GlucoDr-rel (Allmedicus, Szöul, Dél-Korea) mértük. A vér β-ketonszintjét MediSense Optium-mal (Abbott Laboratories, Abbott Park, IL) mértük. A plazma leptinszinteket egy patkány leptin ELISA kit segítségével elemeztük (Linco Research, St. Charles, MO).
Valós idejű PCR elemzés
A teljes RNS-t Trizol reagenssel (Invitrogen, Carlsbad, CA) izoláltuk, és az egyszálú cDNS-t szintetizáltuk 2 ug teljes RNS-ből Oligo (dT) 15 Primer, M-MLV reverz transzkriptáz, M-MLV 5X reakciópuffer, dNTP és ribonukleáz inhibitor (Promega, Madison, WI). A valós idejű PCR elemzéseket egy ABI PRISM 7000 szekvencia detektáló rendszer (Applied Biosystems, Foster város, Kalifornia) segítségével végeztük. Mindegyik reakciót 12,5 µl 2X SYBR master keverékkel, 1 µl cDNS-sel, 2,5 µl 3 µM előre- és reverz primerekkel és 6,5 µl vízzel hajtottuk végre. A kísérleteket három példányban hajtottuk végre, és 18S RNS-t használtunk invariáns kontrollként minden vizsgálatban.
A Caco-2 sejtek PPARa agonisták kezelése
Az emberi bélhám sejtvonalát, a Caco-2-t [17] a Korean Cell Line Bank-tól (Szöul, Dél-Korea) vásároltuk meg, és Minimum Essential Medium-ban (Invitrogen) tartottuk 10% szarvasmarha-magzati szérumban (ThermoFisher Scientific, Waltham, MA) és 1% penicillin/sztreptomicin (Invitrogen) 37 ° C-on 5% CO2-ot tartalmazó párásított inkubátorban. A Caco-2 sejteket 24 órán át tenyésztettük fenofibrát, bezafibrát vagy klofibrát jelenlétében (Sigma-Aldrich, St. Louis, MO).
PPARα és CCK expresszió mérése
A fehérjéket a Caco-2 sejtekből és a patkányok vékonybéléből izoláltuk, proteázgátló koktélt és foszfatázinhibitor koktélt (Sigma-Aldrich) tartalmazó radioimmunprecipitációs vizsgálati pufferrel. A fehérjekoncentrációt három példányban határoztuk meg a réz-szulfát-oldattal (Sigma-Aldrich) végzett bicinkrón-sav-oldattal. A fehérjemintákat összekevertük Laemmli mintapufferrel, és forrásban lévő vízfürdőbe helyeztük 5 percre. A fehérjéket egy 8-ban oldottuk fel
12% -os SDS-poliakrilamid-gélelektroforézis (SDS-PAGE; azonos mennyiségű összes fehérjét töltöttünk fel minden sávba) és nitrocellulóz membránokra vittük át. A blotokat PPARa, CCK és β-aktin elleni antitestekkel vizsgáltuk (Santa Cruz Biotechnology, Santa Cruz, Kalifornia). A blotokat torma-peroxidázzal konjugált másodlagos antitestek alkalmazásával fejlesztettük ki, majd inkubáltuk ECL Plus Western Blotting Detection Reagens-kel (Amersham, Egyesült Királyság), és a jeleket Fuji LAS 4000 Imaging állomáson (Tokió, Japán) detektáltuk.
Statisztikai analízis
Az összes eredményt átlag ± SE értékben fejezzük ki. A csoportok közötti különbségek jelentőségét Student t-tesztjével és egyirányú ANOVA-val elemeztük. Statisztikai programokat használtunk az SPSS 9.0 for Windows rendszerhez. A különbségeket akkor tekintettük szignifikánsnak, ha a p értéke 0,05 alatt volt.
EREDMÉNYEK
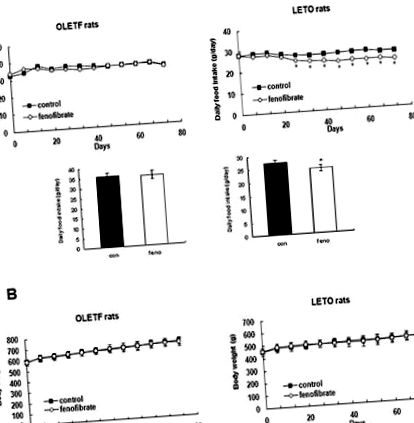
Az alacsony dózisú fenofibrát hatása a napi táplálékfelvételre és a testsúlyra
Az alacsony dózisú fenofibrát hatása az anyagcsere paraméterekre
A fenofibrát hatása a PPARα és CCK expressziójára a LETO és OLETF patkányok vékonybélében. (A) A PPARα és a CCK mRNS relatív mennyiségét RT-PCR-rel elemeztük LETO patkányok vékonybélében. A bemutatott értékeket (átlag ± SEM) normalizáljuk a GAPDH mRNS-sel szemben. n = 5. * p 3A. ábra). Ezenkívül a PPARα expresszióját fokozta a fenofibrát kezelés Caco-2 bélsejtekben. Annak megvizsgálására, hogy a CCK expresszió indukciója a fenofibrát egyedülálló hatása volt-e, más típusú PPARα agonistákat teszteltünk, például bezafibrátot és klofibrátot. A CCK expresszióját a Caco-2 sejtekben bezafibrát és klofibrát is indukálta (3B. Ábra). Mindhárom PPARα agonista növelte a CCK és a PPARα fehérje szintjét a Caco-2 sejtekben.
A fenofibrát hatása a PPARα és CCK expressziójára Caco-2 sejtekben. (A) A CCK expressziója dózisfüggően nőtt a fenofibrát alacsony dózisú kezelésével (3, 10 és 30 µM) 24 órán át. (B) A CCK expresszióját a Caco-2 sejtekben többféle PPARa agonista indukálta; fenofibrát 100 µM (feno), bezafibrát 100 µM (beza) és klofibrát 250 µM (clo). A bemutatott kísérleteket háromszor megismételtük a reprodukálhatóság megerősítése érdekében.
VITA
A szokásos kísérleti dózis (nagy dózis, 100 mg)
300 mg/kg) a fenofibrát kezelése növeli a β-keton vérszintjét [2,5,6], és csökkenti a táplálékfelvételt [3,4,18]. Ebben a kis dózisú vizsgálatban a vér β-ketonszintje a LETO patkányok fenofibrát csoportjában nem különbözött szignifikánsan a kontroll csoportétól. Úgy tűnik, hogy az OLETF patkányok szintje kissé alacsonyabb a LETO patkányokhoz képest, de a vér β-ketonszintjének normális tartománya 1,0 mmol/l alatt van. Az OLETF patkányok plazma leptinszintje magasabb, mint a LETO patkányoké, mivel az OLETF patkányok testtömege magasabb. 11 hetes fenofibrát kezelés után a LETO patkányok fenofibrát csoportjának plazma leptinszintje általában alacsonyabb volt, mint a kontroll csoporté. A LETO patkányok fenofibrát csoportja csökkent táplálékmennyiséget kapott, annak ellenére, hogy leptin szintjük alacsonyabbnak tűnt a kontroll csoporthoz képest. A fenofibrát kezelés hepatomegáliát okozott [19]. A máj súlyának növekedését a fenofibrát hatásának jelölésére használják.
Ezenkívül megvizsgáltuk a CCK indukcióját fenofibráttal sejtszinten, Caco-2 sejtek felhasználásával, egy emberi bélhám sejtvonalával. A Caco-2 sejtek a CCK és a PPARα dózistól függő expresszióit mutatták a fenofibrát kezelés után. A Caco-2 sejtek a CCK fokozott expresszióját mutatták nemcsak fenofibráttal végzett kezelés után, hanem más PPARa agonistákkal, bezafibráttal és klofibráttal történő kezelés után is. Nemrégiben arról számoltak be, hogy a PPARα fontos transzkripciós szabályozó a vékonybélben [20]. Ez a megállapítás arra utal, hogy a PPARα szabályozhatja a CCK expresszióját. További vizsgálatokra van szükség a CCK transzkripciós szabályozó mechanizmusának meghatározásához a PPARα-n keresztül.
Ez a tanulmány az első jelentés arról, hogy a fenofibrát fokozza a CCK expresszióját. Szerencsére ez a megállapítás azért volt lehetséges, mert a fiziológiailag normális LETO patkányokkal kísérleteztünk. Néhány jelentés fiziológiailag normális patkányokról, például Wistar és Sprague Dawley patkányokról szól, amelyek nem mutatják a fenofibrát táplálékfelvételének csökkenését [21,22]. Épp ellenkezőleg, az elhízott hajlamú egerek, például a db/db [4] és az ob/ob egerek [18], anorexiás hatást mutattak a fenofibrát kezeléssel. Ezek a jelentések azt sugallják, hogy a fiziológiailag normális körülmények ellenállhatnak a fenofibrát hatásainak a törzskülönbség miatt, míg a fenofibrát elhízásra hajlamos állapotban hatékony lehet.
Ennek a vizsgálatnak a klinikai vonzata a fenofibrát lehetséges alkalmazása az elhízás kezelésére. Számos nagyszabású, randomizált, kontrollált vizsgálat volt fenofibrát alkalmazásával. Azonban a táplálékbevitel változása nem szerepelt e vizsgálatok paramétereiben. A fenofibrát kezelés táplálékfelvételre gyakorolt hatását nem vizsgálták. Szükség lehet tehát egy kísérleti vizsgálatra a fenofibrát azon képességének értékelésére, hogy csökkenthető-ea táplálékfelvétel az elhízásban. Enyhe vagy közepesen elhízott, hipertrigliceridémiás betegek jó jelöltek lennének egy ilyen vizsgálatban.
Összegzésképpen elmondható, hogy a fenofibrát viszonylag alacsony dózisú terápiája csökkentette a LETO patkányok táplálékfelvételét azáltal, hogy növelte a CCK expresszióját a duodenumban. A CCK fokozott expressziója a fenofibrát anorexigén hatásainak egyik tényezője lehet.
KÖSZÖNETNYILVÁNÍTÁS
Ezt a munkát a Koreai Kormány (MEST) (2010-0001943) által finanszírozott Koreai Nemzeti Kutatási Alapítvány (NRF) és a Dong-A Egyetemi Kutatási Alap támogatta 2010-ben.
- Az alkoholmentes zsírmájbetegség a túlzott kalóriabevitelhez kapcsolódik, nem pedig a
- Az alkoholmentes zsírmájbetegség a túlzott kalóriabevitelhez kapcsolódik, nem pedig a
- A The Japan Times évek óta tartó csökkentő kezdeményezései ellenére a sóbevitel továbbra is magas
- Lassan felszabaduló halétel Miért érdemes kerülni!
- Hét karcsúsító SuperFoods Clean Food Crush