A telomerázt expresszáló elosztott hepatociták a májat újratelepítik homeosztázisban és sérülésben
Shengda Lin
1 Orvostudományi Tanszék, Stanford Egyetem Orvostudományi Kar, Stanford, Kalifornia 94305
Elisabete M. Nascimento
1 Orvostudományi Tanszék, Stanford Egyetem Orvostudományi Kar, Stanford, Kalifornia 94305
Chandresh Gajera
1 Orvostudományi Tanszék, Stanford Egyetem Orvostudományi Kar, Stanford, Kalifornia 94305
Lu Chen
1 Orvostudományi Tanszék, Stanford Egyetem Orvostudományi Kar, Stanford, Kalifornia 94305
Patrick Neuhoefer
1 Orvostudományi Tanszék, Stanford Egyetem Orvostudományi Kar, Stanford, Kalifornia 94305
Alina Garbuzov
1 Orvostudományi Tanszék, Stanford Egyetem Orvostudományi Kar, Stanford, Kalifornia 94305
Sui Wang
2 Szemészeti Tanszék, Stanford University School of Medicine, Stanford, California 94305
Steven E. Artandi
1 Orvostudományi Tanszék, Stanford Egyetem Orvostudományi Kar, Stanford, Kalifornia 94305
3 Rákbiológiai program, Stanford Egyetem Orvostudományi Kar, Stanford, Kalifornia 94305
4 Biokémiai Tanszék, Stanford Egyetem Orvostudományi Kar, Stanford Kalifornia 94305
Társított adatok
Az RNS-seq vizsgálat forrásadatai a GEO adattárban érhetők el> GSE104415 szám alatt.
Absztrakt
A patociták a máj metabolikus aktivitását hajtják végre, és funkcionális heterogenitást mutatnak a tengely mentén a portális vénától a központi vénáig meghatározott lobulában 12. Ennek a tengelynek a szélső végein a pericentralis Axin2 + hepatocyták újratelepítették a májat a normál homeosztázis során 13, míg a Sox9 expresszióval fémjelzett periportális hepatocyták a homeosztázis során inaktívak voltak, de krónikus kémiai károsodásokkal bővültek 14. Azok a megfigyelések, amelyek azt mutatják, hogy a proliferáló hepatociták az egész 15, 16 lobulában találhatók, további forrásokat kínálnak a hepatociták újratelepítéséhez. A telomeráz szintetizálja a telomer ismétléseket, és összefüggésbe hozható az őssejtek és a rákos megbetegedések hosszú távú megújulásával 17. A telomeráz génekben a csíkvonal inaktiváló mutációi hajlamosítanak a cirrózisra a 9,10 és a 11 egerekben, míg a TERT promoter aktiváló mutációi képviselik a hepatocelluláris carcinoma 18 leggyakoribb mutációit. Tekintettel a telomeráz májbetegségben betöltött fontos szerepére, valamint arra, hogy a telomeráz az őssejt rekeszekben található több felnőtt 19–22.
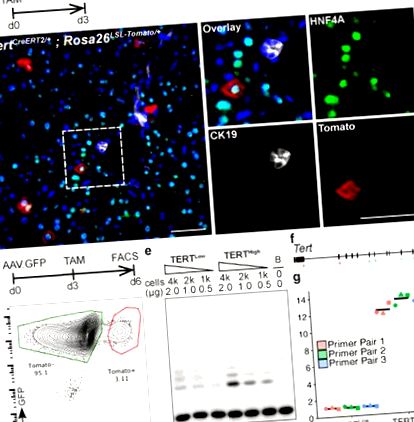
a-b, Immunfluoreszcencia (IF) elemzés Tert CreERT2/+ -on; A Rosa26 LSL-Tomato/+ májat egyetlen dózisú tamoxifennel kezelték, és az injekció után 3 nappal elemezték. Paradicsom (piros), HNF4A (zöld), CK19 (fehér) és DAPI (kék) látható. c-g, Telomeráz expresszió elemzése FACS-szortírozott hepatocitákban. Reprezentatív FACS-cselekmény (d), TRAP assay (e, B: Csak puffer) és kvantitatív reverz transzkripciós PCR (f, primerpárok helyzete) (g, hajtásváltozások.n = 3 egér, mindegyiket egyedi pont alakzatok jelzik; keresztléc: átlag) látható. A kísérleteket háromszor megismételték b, több mint ötször d, és kétszer is e és g. Mérlegsorok, 50 μm.
a-i, Vonalvezetés a Tert CreERT2/+ rendszerben; Rosa26 LSL-Tomato/+ egyszeri dózisú tamoxifennel (b-g) vagy olajos jármű (én) és az IF-t a paradicsomra vonatkozóan a jelzett nyomkövetési időszakokban elemezték. A paradicsom + hepatocita terület mennyiségi meghatározása (h, n = 4, 5, 4, 4, 7, 5 egér minden egyes időponthoz; kereszt-oszlop: átlag). j-m, Co-IF paradicsom és GS inTert CreERT2/+ esetében; A Rosa26 LSL-Tomato/+ mikrovezérlés 3 napig, 6 hónapig vagy egy évig. A Tomato + GS + a GS + hepatociták frakciójának meghatározása (m, n = 4, 5, 5 egér minden időpontban; keresztlécek, átlag). nem, Az RNS-seq eredmények FACS-tisztított TERT High (Tomato +) vagy TERT Low (Tomato -) hepatocytákon (n = 3 egér minden csoportnál). Dúsított gének és GO kifejezések vulkán-cselekménye (n,határértékek: q 0,8). GSEA elemzés dúsított génkészletekhez (o, az egyes génkészletekhez feltüntetett gének száma). A kísérleteket kétszer megismételték a b,f,g,j-l. Mérlegsorok, 100 μm.
Annak megértése érdekében, hogy a TERT High sejtek miben különböznek a tömeges hepatocitáktól, RNS-szekvenciát végeztünk a TERT High és TERT Low hepatocitákon, amelyeket FACS izolált három Tert CreERT2/+ -tól; Rosa26 LSL-Tomato/+ egerek a tamoxifen-kezelés után három nappal. Az RNS-seq 3172 gént mutatott ki, amelyek eltérően expresszálódtak a két populáció között (q 2n. Ábra) (Kiterjesztett adatok 3j. Ábra). A gén ontológia (GO) elemzés (2n. Ábra) és az Annotáció, Vizualizáció és Integrált Felfedezés Adatbázisa (DAVID, Extended Data 3j. Ábra) azt mutatta, hogy a sejtciklus génjeit a TERT magas populációban, míg a riboszomális géneket és a mitokondriális géneket felfelé szabályozták. a TERT-ben Alacsony népesség. A génkészlet-gazdagítási elemzés (GSEA) feltárta a sejtosztódáshoz és a receptor tirozin-kináz aktivitáshoz kapcsolódó génkészletek megnövekedett reprezentációját a TERT magas populációjában (2o. Ábra, piros), valamint a riboszómakomponensekkel, mitokondriális fehérjékkel, elektronokkal társított génkészletek reprezentációjának csökkenését mutatta ki transzportlánc gének és hepatocita metabolikus aktivitások (2o. ábra, szürke). Proliferáció az INTERT-ben A magas hepatociták emelkedtek az 5-etinil-2′-dezoxiuridin (EdU) beépítésével (7 napos ivóvíz, kibővített adatok, 6. ábra) a TERT Alacsony májsejtekhez (6,4 ± 1,0% vs. 0,9 ± 0,1%) képest. Ezek az adatok együttesen azt sugallják, hogy a TERT magas hepatociták kevésbé fektetnek be az ömlesztett hepatociták metabolikus és szintetikus funkcióiba, és inkább a proliferációra és a homeosztatikus megújulásra irányulnak.
a-h, Ritkán jelölt hepatocita klónok 3D elemzése a Tert CreERT2/+ alkalmazásban; Alacsony dózisú tamoxifennel kezelt Rosa26 LSL-Tomato/+ egerek 3 napig, 3 hónapig vagy 6 hónapig nyomon követhetők. Klónméretek (időszámításunk előtt) és kötetenként klónszám (d) (n = 5, 3, illetve 4 egér; mindegyik egér egyedi pöttyös színnel jelenik meg c; keresztléc: átlag). Co-IF a Paradicsom és a GS számára a klón elhelyezkedésének értékelésére 6 hónapos nyommintákban (e-h). A klón méretének és helyzetének számszerűsítése a GS + sejtekhez képest (h).i-r, Egymolekulás RNS FISH a FACS-tisztított TERT magas eredetű (l-n) és a TERT Low származtatott (o-q) hepatociták. A gócok számának meghatározása (r, n = 3 egér idõpontonként, mindegyik egeret egyedi pontalakok jelzik. A sávok és a hibasávok átlag + SEM. A> 5 gócot tartalmazó sejteknél p1hónap-3days = 0,56, p1év-3days = 2,7e-5, p1év-1hónap = 4,3e-5). A kísérleteket kétszer megismételték. Mérlegsorok, 50 μm.
A TERT magas hepatociták akár önmegújító mechanizmus révén generálhatnak klónokat, amelyeknél a kezdeti sejt TERT magas marad, az utódok pedig TERT alacsonyak (3j ábra), vagy egy egyszerű duplikációs mechanizmussal, amelyben az összes leánysejt TERT magas marad (ábra . 3k). E mechanizmusok megkülönböztetéséhez megvizsgáltuk a Tert mRNS-t egymolekulás RNS FISH-sel, válogatott Tomato + és Tomato - hepatocitákon, különböző nyomkövetési periódusokról (3i. Ábra, l-r), valamint vad típusú hepatocitákat (kiterjesztett adatok 7. ábra). Megállapítottuk, hogy a magas Tert mRNS-sel (> 5 mRNS-góc) rendelkező Tomato + sejtek aránya összehasonlítható volt három napon és egy hónapon belül (80,3 ± 2,0% vs. 75,3 ± 4,8%), de egy év után 18,0 ± 2,2% -ra csökkent . A paradicsomsejtek TERT-alacsonyak maradtak, függetlenül a nyomkövetési periódusoktól. Ritka sejtek jelenléte ebben a frakcióban magas Tert mRNS-sel valószínűleg a CreER T2-vel való hiányos rekombinációt jelzi. Ezek a tanulmányok azt mutatják, hogy a TERT High szubpopuláció egyaránt megújul a TERT High sejtek feltöltése érdekében, és differenciálódik, hogy TERT Low lánysejteket hozzon létre.
Annak megértése érdekében, hogy a TERT magas hepatociták képesek-e pótolni a pericentralis zónában sérült sejteket, elimináltuk a pericentralis hepatocytákat egyszeri dózisú szén-tetraklorid (CCl4) injekcióval 25 (Bővített adatok 8c-f. Ábra). Bár a TERT Magas hepatociták ritkák a GS + pericentralis zónán belül, a sérülés után hét nappal a GS + Tomato + sejtek száma jelentősen megnőtt (4a-f. Ábra). Ezek az adatok azt mutatják, hogy a pericentralis hepatocyták sérülése aktiválja a közeli TERT High hepatocytákat, és hogy utódaik új zónás identitást vesznek fel a pericentralis sebek gyógyításában. Annak megértése érdekében, hogy a TERT magas hepatociták hozzájárulnak-e a májsejtek regenerációjához a globális sérülés után, 0,1% 3,5-dietoxi-karbonil-1,4-dihidrokollidin (DDC) diétával vetettük fel a májat (4g. Ábra és kibővített adatok 8g, h ábra). Egy hónapos DDC-diéta után a Tomato + hepatocyták jelentős növekedését tapasztaltuk (38,0 ± 3,2% vs. 5,6 ± 0,3% a kontroll májban) (4g-j. Ábra). A TERT magas sejtjeinek egyes utódai duktális sorsot fogadtak el (kiterjesztett adatok 9. ábra), összhangban a DDC sérülés esetén ismert hepatocita plaszticitással 26. Ezek az eredmények azt mutatják, hogy a TERT magas hepatociták a kémiai sérülések esetén gyorsítottan újratelepítik a hepatocitákat.
a-f, Egyadagos CCl4 májkárosodás. Tert CreERT2/+; Olaj hordozóval kezelt Rosa26 LSL-Tomato/+ egerek (b,c) vagy CCl4 (d,e) IF elemezte a paradicsomot és a GS-t a kezelés utáni 7. napon. IF számszerűsítés (f); fehér vonalak, GS + pericentrális zóna (n = 5 egér). g-j, DDC diéta által kiváltott sérülés Tert CreERT2/+; Rosa26 LSL-Tomato/+ egerek. A máj paradicsom esetén 30 napos normál étrend-kezelés után (h) vagy a DDC diéta (én). IF számszerűsítés (j) (n = 4 egér). k-m, A TERT magas hepatociták ablációja AAV.lsl.dtA injekcióval a Tert CreERT2/+ -hoz; Rosa26 LSL-Tomato/+ egerek (n = 4 egér), a Tomato + sejtek mennyiségi meghatározása (m). n-v, Genetikai abláció, majd DDC sérülés Tert CreERT2/+ -on; Rosa26 LSL-Tomato/+ egerek. A Sirius Red által kollagénre elemzett máj (o-q), SMA az aktivált csillagképes sejtekhez (r-t) és a CK19 + sejtek (u-w) (n = 4 egér). AAV.GFP injekcióval beadott kontroll állatok (o, r, t) és az AAV.lsl. DTA-val beadott állatok (o, s, uKeresztvonalak: átlag. Legalább kétszer megismételt kísérletek. Mérlegsorok, 100 μm.
a, A TERT High hepatocyták táguló klónokat generálnak, amelyek mind a TERT High, mind a TERT Low hepatocitákból állnak. b, Ritka TERT A lobulában eloszló magas hepatociták a homeosztázis során megnagyobbodó klónokat képeznek a helyi hepatocita veszteségre reagálva. c, A sérült máj újratelepítése a TRT klonális terjeszkedésével A sérülés során felgyorsul a magas májsejtek száma. Kék erek, portál és központi erek; rózsaszínű edény, máj artéria; kis zöld sejtek, kolangiociták; nagy zöld sejtek, pericentrális hepatociták; vörösvértestek, TERT Magas hepatociták; fekete sejtek, károsodott hepatociták.
Mód
A Tert CreERT2 bekapcsolósor létrehozása
A célzó vektort soros rekombinációval és gate-way klónozással állítottuk elő. Homológiai karokat (mm10 chr13: 73 621 344 - 73 631 102) klónoztunk a BAC-ból (RP24-342O18) rekombinációval. Egy kodonra optimalizált intron-CreERT2-NeoR 27 kazettát rekombinációval illesztettünk be a Tert endogén transzlációs kezdőhelyébe (mm10 chr13: 73 627 032 - 73 627 033). A végső célvektort a pWS-TK2 vektorba történő kapu-klónozással hoztuk létre timidin-kináz kazettákkal a homológiai karok mindkét végén, amint azt korábban leírtuk 28. A célvektort linearizáltuk és elektroporáltuk JM8/F6 egér ES sejtekbe. A helyesen megcélzott ES-klónokat Southern-blotokkal és kariotípusokkal szelektáltuk, majd BALB/c blastocystákba injektáltuk a bekapcsolási vonal létrehozása érdekében. A Tert CreERT2/+ egerek normál mendeli frekvencián születtek. A CreERT2 hatékonyságának igazolására az ES-ben a Tert CreERT2/+ klónt módosított „Rosa26-mTmG” 29 célvektorral céloztuk meg, HygroR-t használva szelekciós génként. A kettős beütésű sejteket 500 nM 4-hidroxi-tamoxifennel (4-OHT) kezeltük a rekombinációs hatékonyság értékelése érdekében.
AAV gyártás
Az ebben a vizsgálatban felhasznált összes AAV-t olyan cisz-plazmidokkal állítottuk elő, amely a teljes TBG promótert tartalmazta [az α-1-mikroglobulin/bikunin prekurzor (AMBP) erősítő elemek két példánya, majd a SERPINA7 gén promotere és egy mini-intron], egy AAV8 szerotípus csomagoló plazmidot és egy adenovírus segítő plazmidot. Megvásárolták az AAV.GFP-t (AAV8.TBG.PI.eGFP.WPRE.bGH, katalógusszám: AV-8-PV0146) és az AAV.Cre-t (AAV8.TBG.PI.Cre.rBG, AV-8-PV1091 katalógus). a Pennsylvaniai Egyetem Vector Core-tól. Az AAV.lsl.dtA tartalmaz egy erős SV40 stop elemet, amelyet a Lox-Stop-Lox TOPO 30. plazmidból klónoztak (addigén plazmid # 11584). Az AAV.flex.dtA-t a pAAV-mCherry-flex-dtA 31-ből (addgene Plasmid # 58536) módosítottuk a következő változtatásokkal: az EF-1a promotert felcseréltük a TBG promóterrel, az mCherry-t pedig EGFP-vel. A HEK293T sejteket transzfektáltuk és Corning többrétegű lombikokban növesztettük a vírusok előállítása céljából. A vírusokat jodixanol (Sigma-Aldrich) gradiens ultracentrifugálással 32 tisztítottuk, majd qPCR 33 és SYPRO Ruby (ThermoFisher) fehérjegél festéssel standardokkal standardizáltuk.
Állatok
A Tert CreERT2/+ egereket a Rosa26 riporterrel (Gt (ROSA) 26Sortm14 (CAG-tdTomato) Hze/J) 34 tenyésztettük Tert CreERT2/+ előállítására; Rosa26 LSL-Tomato/+ egerek elemzésre. A két hónapos egereknek intraperitoneálisan 100 μl szezámolajban (Sigma-Aldrich) oldott tamoxifent (Caymon, 1 mg/10 g tömeg) injektáltunk. Ritkán jelölték meg a tamoxifen 0,08 mg/10 g tömegű injekcióját. Az EdU-t (Carbosynth) ivóvízzel (1 mg/ml) adtuk be naponta hét napig. Az AAV-t 4e11 genom részecskékre hígítottuk 100 μl normál sóoldattal (egérenként), és intravénásán injektáltuk. DDC sérülés esetén az egerek TD.07571 (Harlan) étrendet kaptak, amely 0,1% DDC-t (Sigma-Aldrich) tartalmaz ad libitum. CCl4 sérülés esetén az egereknek folyékony CCl4-et (Sigma-Aldrich, 10 μl/10 g tömeg) injektáltunk szezámolajban oldva (Sigma-Aldrich).
Statisztika
Két csoport összehasonlításakor a p értékeket a kétoldalas párosítatlan t-próbával határoztuk meg. Kétnél több csoport összehasonlításakor a p értékeket egyirányú ANOVA-val határoztuk meg Tukey HSD-tesztjével, amelyet post hoc elemzésként hajtottunk végre. Az adatok szignifikanciáját nem-parametrikus statisztikákkal is teszteltük kétoldalas párosítatlan Wilcoxon – Mann – Whitney teszt alkalmazásával kétcsoportos összehasonlítás céljából, és Kruskal – Wallis egyirányú ANOVA-t a Conover – Iman teszttel végzett rangsorban post hoc elemzésként további mint két csoport. Kolmogorov-Smirnov tesztet végeztünk a folyamatos változók eloszlási mintáinak összehasonlítására. Az állatokat véletlenszerűen soroltuk be minden kísérleti/kontroll csoportba. A kísérleteket és az eredményértékelést a kutatók nem vakították el az allokációtól. Az adatok „átlag ± SEM” -ként vannak feltüntetve a szövegben. A grafikonokat a ggplot2 35 csomag készítette R-ben.
FACS kísérletek
A sejteket standard kétlépéses kollagenáz perfúzióval izoláltuk. A máj perfúziós táptalajt (Life Technologies) és a szűrt (0,22 μm) máj emésztő táptalajt (Life Technologies) a portális vénán keresztül egymás után perfundáltuk, a gyártó utasításainak megfelelően. A disszociált májat 100 μm-es sejtszűrőn átengedtük, és a májsejteket alacsony sebességű centrifugálással (50xg 3 percig) háromszor hepatocita mosóközegben (Life Technologies) dúsítottuk. A sejteket BD Aria II áramlási citométerrel elemeztük és/vagy válogattuk 100 μm-es fúvóka segítségével. Az elhalt sejteket Topro3 (1 μM) vagy DAPI (1 μM) (Life Technologies) beépítés alapján kizártuk. A ploidia-analízishez a májsejteket az elemzés előtt 30 percig inkubáltuk Hoechst33342-ben (15 μg/ml) és Reserpin-ben (5 μM) 37 fokon.
Immunfluoreszcencia (IF), Imunohistokémia (IHC), EdU detektálás, egymolekulás RNS FISH és SiriusRed festés
qPCR és RNSekv
Képalkotó elemzés
A fluoreszkáló képeket a Leica LAS AF, az ImageJ, az Adobe Photoshop és a Fluorender elemezte. A területindexet a Tomato + sejtek által lefedett májterület határozta meg az összterület százalékában, és az ImageJ számszerűsítette. A 3D rekonstrukció Fluorender alkalmazásával történt. A többsejtű klónokat 258 × 258 × 100 μm 3 térfogatban készítettük Leica SP8 konfokális mikroszkóppal vagy Prairie Ultima IV kétfoton mikroszkóppal. A több mint nyolc sejtből álló klónok gyakran meghosszabbították a képalkotó térfogatot, ezért nyolc sejtnek számítottak. A felületi sík nézetet az első 12 μm-es térfogat maximális vetítésével hoztuk létre, közel a felülethez közelítő vékony metszetekből származó festési eredményekhez. GS-sel történő együttes festéshez 580 × 580 × 100 μm 3 térfogatot ábrázoltunk. A varrott egysíkú képeket az Adobe Photoshop különálló lapokból dolgozta fel. Az EdU +, Ki67 +, GS +, CK19 + hepatocyták számát manuálisan számláltuk.
TRAP vizsgálatok
A Telomere Repeat Amplification Protocol (TRAP) protokollt egy korábban létrehozott 40 protokoll segítségével hajtották végre. A FACS-válogatott sejteket vagy a homogenizált szöveteket lizáltuk NP40 pufferben (25 mM HEPES-KOH, 400 mM NaCl, 1,5 mM MgCl2, 10% glicerin, 0,5% NP40 és 1 mM DTT [pH 7,5] proteázinhibitorokkal kiegészítve).
Etikai megfelelés
Az összes állati protokollt jóváhagyta a Stanfordi Egyetem Intézményi Állatgondozási és Felhasználási Bizottsága. Minden kísérlet megfelelt a Stanford Egyetem vonatkozó etikai szabályainak.
Kód rendelkezésre állása
Kódok kérésre a megfelelő szerzőtől kaphatók.
Az adatok elérhetősége
Az RNS-seq vizsgálat forrásadatai a GEO adattárban érhetők el> GSE104415 szám alatt.
- A zsírmáj központi szerepe az elhízott serdülők cukorbetegségének inzulinrezisztenciájának patogenezisében
- Étrendi változások a zsírmájbetegség és az alkoholmentes steatohepatitis dLife kezelésére
- Zsírmájbetegség központja - NYC ColumbiaDoctors Children s Health
- Békák; varangyok sérülése vagy betegsége
- A gyorsétterem-étrend okozta alkoholmentes zsírmájbetegség korai védőhatást fejt ki