Travatan
TRAVATAN Z ®
(travoprost) Szemészeti oldat 0,004%, helyi szemészeti alkalmazásra
LEÍRÁS
A travoprost egy szintetikus prosztaglandin F analóg. Kémiai neve: [1R- [1α (Z), 2β (1E, 3R *), 3α, 5α]] - 7- [3,5-dihidroxi-2- [3-hidroxi-4- [3- (trifluor-metil) -fenoxi] ] -1-butenil] ciklopentil] -5-hepténsav, 1-metiletil-észter. Molekulaképlete C26H35F3O6, molekulatömege 500,55. A travoprost kémiai szerkezete:
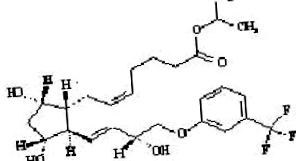 |
A travoproszt tiszta, színtelen vagy enyhén sárga olaj, amely nagyon jól oldódik acetonitrilben, metanolban, oktanolban és kloroformban. Gyakorlatilag vízben nem oldódik.
A 0,004% -os TRAVATAN Z ® (travoproszt szemészeti oldat) travoprost steril, pufferolt vizes oldataként kerül forgalomba, pH-ja kb. 5,7 és ozmolalitása körülbelül 290 mOsmol/kg.
A TRAVATAN Z ® tartalmaz Aktív: travoproszt 0,04 mg/ml; Inaktívak: polioxil 40 hidrogénezett ricinusolaj, sofZia ® (bórsav, propilén-glikol, szorbit, cink-klorid), nátrium-hidroxid és/vagy sósav (a pH beállításához) és tisztított víz, USP. A palackban ionos pufferolt rendszerrel, sofZia ® tartósítva .
JELZÉSEK
A TRAVATAN Z ® (travoproszt szemészeti oldat) 0,004% javallt az emelkedett intraokuláris nyomás csökkentésére nyitott szögű glaukómában vagy okuláris hipertóniában szenvedő betegeknél.
ADAGOLÁS ÉS ADMINISZTRÁCIÓ
Az ajánlott adag naponta egyszer egy csepp az érintett szem (ek) be. A TRAVATAN Z ® (travoprost szemészeti oldat) nem adható naponta többször, mivel bebizonyosodott, hogy a prosztaglandin analógok gyakoribb beadása csökkentheti az intraokuláris nyomáscsökkentő hatást.
Az intraokuláris nyomás csökkentése körülbelül 2 órával az első beadás után kezdődik, a maximális hatás 12 óra után érhető el.
A TRAVATAN Z ® együtt alkalmazható más topikális szemészeti gyógyszerekkel az intraokuláris nyomás (IOP) csökkentése érdekében. Ha egynél több helyi szemészeti gyógyszert alkalmaznak, akkor a gyógyszereket legalább 5 perces különbséggel kell beadni.
HOGYAN KÍNÁLHATÓ
Adagolási formák és erősségek
0,04 mg/ml travoprosztot tartalmazó szemészeti oldat.
Tárolás és kezelés
A TRAVATAN Z ® (travoproszt szemészeti oldat) 0,004% egy steril, izotóniás, pufferolt, tartósított, vizes travoproszt (0,04 mg/ml) oldat, amelyet Alcon ovális DROP-TAINER ® csomagolási rendszerében szállítanak.
TRAVATAN Z A ® 2,5 ml-es oldatként 4 ml-es és 5 ml-es oldatként 7,5 ml-es natúr polipropilén adagoló palackban kerül forgalomba, természetes polipropilén csepegtetőheggyel és türkiz polipropilén vagy nagy sűrűségű polietilén túlfedéllel. A szabotázsbiztonsági bizonyítékokat zsugorodó szalaggal látják el a csomagolás záródása és nyaka körül.
2,5 ml töltet -- NDC 0065-0260-25
5 ml töltet ---- NDC 0065-0260-05
Tárolás
Tárolás: 2 ° C - 25 ° C (36 ° F - 77 ° F).
Forgalmazza: Alcon Laboratories, Inc. Fort Worth, Texas 76134. Felülvizsgálva: 2017. szeptember
KÉRDÉS
MELLÉKHATÁSOK
Klinikai vizsgálatok tapasztalatai
Mivel a klinikai vizsgálatokat nagyon eltérő körülmények között végzik, a gyógyszer klinikai vizsgálatai során megfigyelt mellékhatások aránya nem hasonlítható össze közvetlenül egy másik gyógyszer klinikai vizsgálatainak arányával, és nem feltétlenül tükrözi a gyakorlatban megfigyelt arányokat.
A TRAVATAN® (travoproszt szemészeti oldat) 0,004% és a TRAVATAN Z ® (travoproszt szemészeti oldat) 0,004% -a kontrollált klinikai vizsgálatokban megfigyelt leggyakoribb mellékhatás a szem hiperémia volt, amelyet a betegek 30-50% -ánál jelentettek. A betegek legfeljebb 3% -a hagyta abba a terápiát kötőhártya-hiperémia miatt. A klinikai vizsgálatokban 5-10% -os gyakorisággal jelentett szemészeti mellékhatások közé tartoztak a csökkent látásélesség, a szem kellemetlensége, az idegen test érzése, a fájdalom és a viszketés.
A TRAVATAN® vagy a TRAVATAN Z ® klinikai vizsgálata során 1–4% -os gyakorisággal jelentett szemészeti mellékhatások közé tartoztak a rendellenes látás, blepharitis, homályos látás, szürkehályog, kötőhártya-gyulladás, szaruhártyafestés, száraz szem, írisz elszíneződése, keratitis, fedélszél kéreg, szemgyulladás, fotofóbia, subconjunctivalis vérzés és könnyezés.
Postmarketing tapasztalat
További mellékhatásokat azonosítottak a TRAVATAN ® vagy a TRAVATAN Z ® jóváhagyása utáni klinikai gyakorlatban történő alkalmazása során. Mivel önként jelentik őket ismeretlen méretű populációból, a gyakoriság becslése nem végezhető. Azok a reakciók, amelyeket a súlyosságuk, a jelentések gyakorisága, a TRAVATAN® vagy a TRAVATAN Z ® lehetséges ok-okozati összefüggése, vagy ezen tényezők kombinációja miatt választottak felvételre: aritmia, hányás, orrvérzés, tachycardia és álmatlanság.
A prosztaglandin analógokkal történő forgalomba hozatalt követően periorbitális és fedélváltozásokat figyeltek meg, beleértve a szemhéj sulcus elmélyülését.
GYÓGYSZERKÖLCSÖNHATÁSOK
Nincs információ
FIGYELMEZTETÉSEK
A program része "ÓVINTÉZKEDÉSEK" Szakasz
ÓVINTÉZKEDÉSEK
Pigmentáció
Beszámoltak arról, hogy a travoprost szemészeti oldat megváltoztatja a pigmentált szöveteket. A leggyakrabban jelentett változások az írisz, a periorbitális szövet (szemhéj) és a szempillák fokozott pigmentációja voltak. A pigmentáció várhatóan fokozódik mindaddig, amíg travoprostot adnak be. A pigmentáció változása nem a melanociták számának, hanem a melanociták megnövekedett melanin tartalmának köszönhető. A travoprost abbahagyása után az írisz pigmentációja valószínűleg állandó marad, míg a periorbitális szövet pigmentációja és a szempilla változásai reverzibilisnek mondhatók egyes betegeknél. A kezelésben részesülő betegeket tájékoztatni kell a fokozott pigmentáció lehetőségéről. A fokozott pigmentáció hosszú távú hatásai nem ismertek.
Az írisz színének változása több hónaptól évig nem feltétlenül észrevehető. Jellemzően a pupilla körüli barna pigmentáció koncentrikusan terjed az írisz perifériája felé, és az egész írisz vagy az írisz részei barnábbá válnak. Úgy tűnik, hogy a kezelés nem befolyásolja sem az írisz nevét, sem az szeplőit. Míg a TRAVATAN Z ® (travoproszt szemészeti oldat) 0,004% -os kezelése folytatható azoknál a betegeknél, akiknél észrevehetően megnő az írisz pigmentáció, ezeket a betegeket rendszeresen meg kell vizsgálni [lásd: BETEGEK TÁJÉKOZTATÁSA].
Szempillaváltások
A TRAVATAN Z ® fokozatosan megváltoztathatja a szempillákat és a hajszálakat a kezelt szemekben. Ezek a változások magukban foglalják a szempillák megnövekedett hosszúságát, vastagságát és számát. A szempillaváltások általában visszafordíthatók a kezelés abbahagyása után.
Intraokuláris gyulladás
A TRAVATAN Z ® elővigyázatossággal alkalmazható aktív intraokuláris gyulladásban (pl. Uveitis) szenvedő betegeknél, mert a gyulladás súlyosbodhat.
Makula ödéma
A travoprost szemészeti oldattal történő kezelés során makulaödémáról, beleértve a cystoid makulaödémát is beszámoltak. A TRAVATAN Z ® elővigyázatossággal alkalmazható aphakikus betegeknél, pseudophakicás betegeknél, akiknek hátsó lencsekapszulája szakadt, vagy olyan betegeknél, akiknek ismert maculaödéma kockázati tényezői vannak.
Szögzárás, gyulladásos vagy neovaszkuláris glaukóma
A TRAVATAN Z ® szögzárásos, gyulladásos vagy neovaszkuláris glaukóma kezelését nem értékelték.
Bakteriális keratitis
Beszámoltak bakteriális keratitisről, amely helyi dózisú szemészeti termékek több dózisú tartályainak használatával társult. Ezeket a tartályokat véletlenül megfertőzték azok a betegek, akiknél a legtöbb esetben egyidejű szaruhártya-betegség vagy a szem hámfelületének megzavarása volt [lásd: BETEGEK TÁJÉKOZTATÁSA].
Használjon kontaktlencsékkel
A kontaktlencséket a TRAVATAN Z ® beadása előtt el kell távolítani, és beadása után 15 perccel újra behelyezhetők.
Nem klinikai toxikológia
Karcinogenezis, mutagenezis, a termékenység károsodása
Kétéves karcinogenitási vizsgálatok egereken és patkányokon 10, 30 vagy 100 mcg/kg/nap szubkután dózisban nem mutattak semmilyen karcinogén potenciált. Azonban 100 mcg/kg/nap dózisban a hím patkányokat csak 82 hétig kezelték, és az egérvizsgálat során a maximális tolerált dózist (MTD) nem érték el. A magas dózis (100 mcg/kg) megfelel az emberi expozíció 400-szorosát meghaladó expozíciós szinteknek, a maximális ajánlott emberi szemdózisnál (MRHOD) 0,04 mcg/kg, a plazma aktív gyógyszerszintje alapján.
A travoprost nem volt mutagén az Ames-tesztben, az egér mikronukleus tesztben vagy a patkány kromoszóma-aberrációs vizsgálatban. A mutáns gyakoriság enyhe növekedését figyelték meg két egér limfóma vizsgálat egyikében patkány S-9 aktivációs enzimek jelenlétében.
A travoproszt nem befolyásolta hím vagy nőstény patkányok párzási vagy termékenységi mutatóit 10 mcg/kg/nap szubkután dózisokban (a 0,04 mcg/kg/nap MRHOD 250-szerese mcg/kg alapon). 10 mcg/kg/nap dózisban a sárgatestek átlagos száma csökkent, és az implantáció utáni veszteségek növekedtek. Ezeket a hatásokat 3 mcg/kg/nap dózisnál nem figyelték meg (az MRHOD 75-szerese).
Használat meghatározott populációkban
Terhesség
C terhességi kategória
Teratogén hatások
A travoproszt patkányokban teratogén volt, intravénás dózisban legfeljebb 10 mcg/kg/nap [a maximális ajánlott emberi szemdózis (MRHOD) 250-szerese], amit a csontváz, valamint külső és zsigeri rendellenességek előfordulásának növekedése bizonyít, mint például az egyesült szegycsontok, a kupolás fej és a hidrocefália. A travoprost nem volt teratogén patkányokban intravénás dózisban, legfeljebb 3 mcg/kg/nap (az MRHOD 75-szerese), vagy egerekben, szubkután dózisban, legfeljebb 1 mcg/kg/nap (az MRHOD 25-szöröse). A travoproszt az implantáció utáni veszteségek növekedését és a magzati életképesség csökkenését eredményezte patkányokban 3 mcg/kg/napnál nagyobb intravénás dózisban (az MRHOD 75-szerese) és egerekben 0,3 mcg/kg/napnál nagyobb dózisban (7,5). az MRHOD-szorosa).
Olyan nőstény patkányok utódainál, akik travoprostot kaptak szubkután a vemhesség 7. napjától a laktáció 21. napjáig = 0,12 mcg/kg/nap dózisban (az MRHOD háromszorosa), nőtt a postnatalis mortalitás előfordulása, és az újszülöttek testtömeg-növekedése csökkent. Az újszülöttek fejlődését szintén befolyásolta a késleltetett szemnyitás, a pinna leválása és a preputialis elválasztás, valamint a csökkent motoros aktivitás.
A TRAVATAN Z ® (travoproszt szemészeti oldat) 0,004% -os alkalmazásának terhes nőkön történő elvégzésére nincs megfelelő és jól kontrollált vizsgálat. Mivel az állatszaporítási vizsgálatok nem mindig jelzik előre az emberi reakciót, a TRAVATAN Z ® terhesség alatt csak akkor adható, ha a potenciális előny igazolja a magzatra gyakorolt lehetséges kockázatot.
Szoptató anyák
Szoptató patkányokkal végzett vizsgálat kimutatta, hogy a radioaktívan jelölt travoprost és/vagy metabolitjai kiválasztódtak a tejbe. Nem ismert, hogy ez a gyógyszer vagy metabolitjai kiválasztódnak-e az anyatejbe. Mivel sok gyógyszer kiválasztódik az anyatejbe, körültekintően kell eljárni, ha a TRAVATAN Z ® -et szoptató nőnek adják be.
Gyermekgyógyászati felhasználás
16 évesnél fiatalabb gyermekgyógyászati betegeknél nem javasolt a hosszú távú krónikus alkalmazást követő fokozott pigmentációval kapcsolatos biztonsági aggályok miatt.
Geriatriás használat
Nem figyeltek meg általános biztonságossági és hatékonysági különbségeket idős és más felnőtt betegek között.
Máj- és vesekárosodás
A travoproszt szemészeti oldatát 0,004% -kal vizsgálták májkárosodásban szenvedő betegeknél és vesekárosodásban szenvedő betegeknél is. A hematológiai, a vérkémiai vagy a vizeletvizsgálati laboratóriumi adatok klinikailag releváns változását nem figyelték meg ezeknél a betegeknél.
Túladagolás
Nincs információ
ELLENJAVALLATOK
KLINIKAI FARMAKOLÓGIA
A cselekvés mechanizmusa
A travoproszt szabad sav, egy prosztaglandin analóg egy szelektív FP prosztanoid receptor agonista, amelyről úgy gondolják, hogy az uveosclerális kiáramlás növelésével csökkenti az intraokuláris nyomást. A pontos hatásmechanizmus egyelőre nem ismert.
Farmakokinetika
A travoproszt a szaruhártyán keresztül felszívódik, és aktív szabad savvá hidrolizálódik. 4 többszörös dózisú farmakokinetikai vizsgálat adatai (összesen 107 alany) azt mutatták, hogy a szabad sav plazmakoncentrációja az alanyok kétharmadánál 0,01 ng/ml (a vizsgálat kvantitatív határa) alatt van. Azokban az egyénekben, akiknek számszerűsíthető plazmakoncentrációja volt (N = 38), az átlagos plazma Cmax 0,018 ± 0,007 ng/ml volt (0,01-0,052 ng/ml tartományban volt), és 30 percen belül elért. Ezekből a vizsgálatokból a travoproszt felezési ideje a plazmában 45 perc. Az 1. és a 7. nap között nem volt különbség a plazmakoncentrációban, ami azt jelzi, hogy az egyensúlyi állapot korán volt elérve, és hogy nem volt szignifikáns akkumuláció.
A travoprostot, egy izopropil-észter prodrugot a szaruhártyában lévő észterázok biológiailag aktív szabad savjává hidrolizálják. A travoprost szabad sav szisztémásan inaktív metabolitokká metabolizálódik az α (karbonsav) lánc béta-oxidációjával, így a 15-hidroxil-csoport oxidációja révén 1,2-dinoros és 1,2,3,4-tetranoros analógokat kap., valamint a 13, 14 kettős kötés redukciójával.
A travoprost szabad sav eltávolítása a plazmából gyors volt, és az adagolás után egy órán belül a szint általában a mennyiségi határ alatt volt. A travoprost szabad sav terminális eliminációs felezési idejét tizennégy alany becsülte meg, és 17 perc és 86 perc között mozgott, az átlagos felezési idő 45 perc volt. A travoprost helyi dózisának kevesebb, mint 2% -a ürült a vizelettel 4 órán belül, mint travoprost szabad sav.
Klinikai vizsgálatok
Klinikai vizsgálatokban nyitott szögű glaukómában vagy okuláris magas vérnyomásban és 25-27 Hgmm alapnyomásban szenvedő betegek, akiket TRAVATAN ® (travoproszt szemészeti oldat) 0,004% vagy TRAVATAN Z ® (travoproszt szemészeti oldat) 0,004% -kal kezeltek, naponta egyszer az este 7-8 Hgmm-es csökkenést mutatott az intraokuláris nyomásban. Ezeknek a vizsgálatoknak az alcsoport elemzésében az átlagos szemnyomáscsökkenés a fekete betegeknél 1,8 mmHg-val volt nagyobb, mint a nem fekete betegeknél. Egyelőre nem tudni, hogy ezt a különbséget a fajnak vagy az erősen pigmentált íriszeknek tulajdonítják-e.
Többközpontú, randomizált, kontrollos vizsgálatban a betegek 24-26 Hgmm-es átlagos intraokuláris nyomással rendelkeztek a TIMOPTIC * 0,5% -ánál naponta kétszer, akiket TRAVATAN®-val (travoprost szemészeti oldat) kezeltek, 0,004% -ot adagolva napi TIMOPTIC * 0,5% -kal. naponta kétszer 6-7 Hgmm-es csökkenést mutatott az intraokuláris nyomás.
BETEGEK TÁJÉKOZTATÁSA
A pigmentáció lehetősége
Tájékoztassa a beteget az írisz fokozott barna pigmentációjának lehetőségéről, amely állandó lehet. Tájékoztassa a beteget a szemhéj bőrének elsötétedésének lehetőségéről, amely visszafordítható lehet a TRAVATAN Z ® (travoproszt szemészeti oldat) 0,004% abbahagyása után.
A szempilla változásának lehetősége
Tájékoztassa a beteget arról, hogy a TRAVATAN Z ® kezelés során a szempillák és a hajszálak megváltozhatnak a kezelt szemben. Ezek a változások a szem hosszúságában, vastagságában, pigmentációjában, a szempillák vagy a hajszálak számában és/vagy a szempilla növekedési irányában eltérést okozhatnak. A szempillaváltások általában visszafordíthatók a kezelés abbahagyása után.
A konténer kezelése
Utasítsa a beteget, hogy kerülje az adagolótartály csúcsát a szemmel, a környező szerkezetekkel, az ujjakkal vagy bármely más felülettel, hogy elkerülje az oldat olyan közönséges baktériumok általi szennyezését, amelyekről ismert, hogy okuláris fertőzéseket okoznak. A szennyezett oldatok használata súlyos szemkárosodást és későbbi látásvesztést okozhat.
Mikor kell orvoshoz fordulni
Tájékoztassa a beteget, hogy ha interakciós szembetegség (pl. Trauma vagy fertőzés) alakul ki, szemműtétet végeznek, vagy bármilyen szemészeti reakció alakul ki, különösen kötőhártya-gyulladás és szemhéj-reakció, haladéktalanul forduljon orvosához tanácsért a TRAVATAN Z ® további használatával kapcsolatban .
Használjon kontaktlencsékkel
A kontaktlencséket a TRAVATAN Z ® beadása előtt el kell távolítani, és beadása után 15 perccel újra behelyezhetők.
Használja más szemészeti gyógyszerekkel
Ha egynél több helyi szemészeti gyógyszert alkalmaznak, akkor a gyógyszereket az alkalmazások között legalább 5 percig kell beadni.
- Ultra fogyás szájon át történő alkalmazás, mellékhatások, kölcsönhatások, képek, figyelmeztetések; Adagolás - WebMD
- Tirozin felhasználás, mellékhatások, kölcsönhatások, adagolás és figyelmeztetés
- Xenical (Orlistat 120 mg) - Adagolás, felhasználás, kölcsönhatások, figyelmeztetések; Mellékhatások
- Tiamin Hcl (B1-vitamin) injekciós felhasználás, mellékhatások, kölcsönhatások, képek, figyelmeztetések; Adagolás -
- Ventolin szájon át történő alkalmazás, mellékhatások, kölcsönhatások, képek, figyelmeztetések; Adagolás - WebMD