A zsírsavfehérjék zsírsav- és glükóz-anyagcserével társuló súlycsökkenés okozta változásai korrelálnak az energiafelhasználás adaptációival
Absztrakt
Háttér
Az energiakorlátozás az energiaköltségek kiigazítását okozza (teljes, TEE; pihenő, REE; aktivitás indukálta, AEE).
Célkitűzés
Annak meghatározása, hogy az adipocita glükózban és a zsírsav anyagcserében, mint energiahiány mutatóiban szerepet játszó fehérje szintjének változásai összefüggenek-e a fogyás során bekövetkező energiafelhasználás adaptációival.
Mód
48 egészséges alany (18 férfi, 30 nő), átlag ± SD életkor 42 ± 8 év és BMI 31,4 ± 2,8 kg/m 2, nagyon alacsony energiájú étrendet követett 8 hétig. A zsírsavat kötő 4-es fehérje (FABP4), a fruktóz-biszfoszfát-aldoláz C (AldoC) és a rövid láncú 3-hidroxi-acil-CoA dehidrogenáz (HADHsc) (zsírszöveti biopszia, western blot), TEE (kettősen jelölt víz), REE ( szellőztetett motorháztető) és az AEE-t értékelték a 8 hetes diéta előtt és után.
Eredmények
Pozitív összefüggés volt az AldoC csökkenése és a TEE csökkenése között (R = 0,438, P
Bevezetés
Az elhízás és társbetegségei növekvő gyakorisága az egyik legnagyobb egészségügyi probléma modern világunkban [1]. Bár a súlycsökkentési stratégiák az energiamérleg, a bevitel és a ráfordítás mindkét oldalára irányulnak, a hosszú távú fogyás fenntartásának sikere alacsony [2, 3]. A zsírszövet fontos energiatároló és felszabadító szövet, és ennek a szerepnek az ellátásához az adipocitáknak gyorsan reagálniuk kell a kereslet változásaira. Számos tanulmány összekapcsolta az elhízást az egész anyagcsere folyamataival, például a csökkent zsíroxidációval, valamint az adipocita belsejében, mint a hosszú szénláncú zsírsavak csökkent metabolizmusa [4–7]. A fogyásról szóló tanulmányok azt mutatják, hogy az energia korlátozása megváltoztatja a zsírszövetben a lipid-, szénhidrát- és energia-anyagcserében részt vevő gének expresszióját [8–13]. Az energiakorlátozás során a korlátozó glükóz rendelkezésre állást megnövekedett mitokondriális zsírsav-oxidációval kell kompenzálni a vércukorszint megőrzése és a glükózfüggő szövetek elegendő energiával való ellátása érdekében, például az agy vagy a vörösvérsejtek számára [14].
A súlycsökkenésre adott biológiai válasz a súlyosságra való hajlam visszaszerzését idézi elő MacLean és mtsai. [15]. Mariman ezt a választ az adaptációk hálózataként foglalta össze, amelyben az energiahiány elősegíti a súly visszanyerését és az élettani változásokat, amelyek ellenállást jelentenek a további fogyáshoz [16]. Ezen adaptációk közül kettő az energiafogyasztás csökkenése az energiakorlátozás hatására, ami korlátozhatja a fogyást, és fontos tényezők lehetnek, amelyek veszélyeztetik a csökkent testsúly fenntartását. Először is, a sovány és elhízott alanyoknál végzett vizsgálatok a fogyás alatt és röviddel azután jelentősen csökkentették a nyugalmi energiafelhasználást (REE), a súlycsökkenés és a testösszetétel változásán alapuló előrejelzések alatti értékekre [17–22]. A REE csökkenését azon túl, ami a zsírmentes tömeg (FFM) és a zsír tömeg (FM) csökkenésével előre megjósolható, adaptív termogenezisként definiálják. Másodszor, számos tanulmány kimutatta a fizikai aktivitás és az aktivitás okozta energiafelhasználás (AEE) csökkenését a fogyás eredményeként [23–28].
Tantárgyak és módszerek
Tárgyak
Negyvennyolc egészséges személyt (30 nő és 18 férfi), átlag + SD életkor 42 ± 8 év és átlag ± SD testtömeg-index (BMI) 31,4 ± 2,8 kg/m 2, a helyi újságokban és a hirdetőtáblák az egyetemen. Első szűrésen estek át, amely magában foglalta a testtömeg és a testmagasság mérését, valamint egy kérdőív kitöltését az általános egészségi állapotról. Mindannyian jó egészségnek örvendtek, nem használtak gyógyszert (kivéve a fogamzásgátlást), nemdohányzók és legfeljebb mérsékelt alkoholfogyasztók voltak. Súlystabilak voltak, a súlyváltozás szerint 2).
Pihentető energiafelhasználás
Reggel 0800 órakor, az egyetemen töltött éjszakai tartózkodás után az alanyok lassan elindultak egy külön szobába, ahol 30 percig egy ágyon pihentek, majd 30 percig mérték REE-jüket fekvő helyzetben, nyitott áramkörű, szellőztetett rendszerrel. motorháztető rendszer [34]. A gázelemzéseket paramágneses oxigénelemzővel (Servomex, típusú 1158, Crowborough, Kelet-Sussex, Egyesült Királyság) és infravörös szén-dioxid-analizátorral (Servomex, típus: 1520, Crowborough, Kelet-Sussex, Egyesült Királyság) végeztük, miközben az áramlást állandó sebességgel tartottuk. 80 l/perc, és mértük Schoffelen és mtsai. [35]. Ennek a rendszernek az egyéni variációs együtthatója 3,3% ± 2,1 [34]. A REE kiszámítása a mért oxigénfogyasztás és a szén-dioxid-termelés alapján Brouwer képlete alapján történt [36].
A REE szellőztetett motorháztető-rendszerrel (REEm) történő mérése mellett a REE-t megjósolták (REEp) az alábbi egyenlettel: REEp (MJ/d) = 0,024 x zsírtömeg (kg) + 0,102 x zsírmentes tömeg x (kg) + 0,85 [37]. Mivel a zsírtömeget (FM) és a zsírmentes tömeget (FFM) használják a REEp kiszámításához, az egyenlet függetlenül használható a nemek szerint. Az adaptív termogenezist a REEm és REEp elosztva számoltuk [22].
A teljes tevékenység indukálta az energiafelhasználást
A jelzett módszer az AEE becslésére a kettősen jelölt vízmódszer a TEE mérésére a REE mérésével kombinálva [41]. A kiinduláskor az AEE-t (0,9 X TEE) - REE-ként számoltuk, feltételezve, hogy a diéta indukálta termogenezis (DIT) a TEE 10% -a, amely normál vegyes étrenden alapszik [42], és a különálló makrotápanyagok DIT értékei 10 % szénhidrát, 3% zsír és 25% fehérje esetén. A diéta végén a Modifast étrend bevitele és a normál vegyes összetételű kiegészítő táplálékbevitel alapján számították ki a DIT százalékos arányát, amely a várható fogyás és a valós fogyás különbségét jelentette. A DIT a diéta végén a TEE 8% -a volt; ezért az AEE-t (0,92 X TEE) - REE-nek számítottuk.
Western blot elemzés
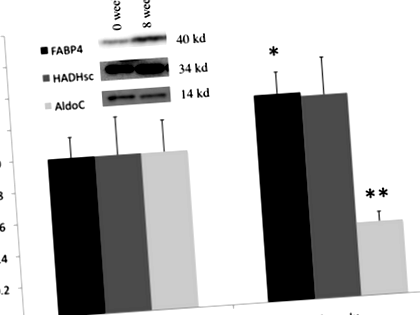
A glükóz és a zsírsav metabolizmusában szerepet játszó három fehérjét kiválasztottuk és Western-blot segítségével mértük a zsírszövetben. Fruktóz-biszfoszfát-aldoláz C (AldoC), zsírsavat kötő 4-es fehérje (FABP4) és rövid láncú 3-hidroxi-acil-CoA dehidrogenáz (HADHsc).
A hasi szubkután zsírszövet biopsziát (kb. 1,5 g) tűzsírleszívással állítottuk elő helyi érzéstelenítésben (2% lidokain, Fresenius Kabi BV, Hollandia) egy éjszakai böjt után, a diéta előtt és után. A mintákat steril hideg sóoldatban öblítettük, folyékony nitrogénben lefagyasztottuk és –80 ° C-on tároltuk a fehérje izolálásáig.
A fagyasztott zsírszövetet mozsárban ledaráltuk, és a port 200 μl 8 M karbamidban, 2% CHAPS-ban, 65 mM DTT-ben oldottuk 100 mg porban. A homogenizátumot 5 percig vortexeltük, és 30 percig centrifugáltuk 14000 fordulat/perc sebességgel és 10 ° C-on. A zsírszöveti proteomot tartalmazó felülúszót gondosan összegyűjtöttük, és az alikvot részeket -80 ° C-on tároltuk. A fehérjekoncentrációkat Biorad Bradfort-alapú fehérje-esszével határoztuk meg [43].
Biokémiai elemzés
A vért EDTA-tartalmú csövekbe gyűjtöttük és centrifugáltuk (1000xg, 10 perc, 4 ° C), és a plazmát azonnal folyékony nitrogénben lefagyasztottuk, és az elemzésig -80 ° C-on tároltuk. A plazma glükózkoncentrációt enzimatikusan analizáltuk Cobas Mira automatizált spektrofotométerrel (Roche Diagnostica). A plazma inzulint kettős antitestes radioimmun vizsgálattal (Insulin RIA 100, Kabi-Pharmacia, Uppsala, Svédország) mértük.
Számítások és statisztikai elemzés
Párosított t-próbát (kétfarkú eloszlás) végeztek az átlagértékek közötti lehetséges különbségek meghatározására. Regresszióanalízist és Spearman Rho korrelációs együtthatóit számoltuk a paraméterek közötti asszociációkra. Egyirányú megismételt ANOVA-méréseket alkalmaztunk a 0 és 8 hét közötti eredmények összehasonlítására, a nem kovariátora. A jelentőséget úgy definiálták P
Eredmények
Test felépítés
A 8 hetes VLED után a fogyás átlagosan 9,9 ± 4,1 kg volt (P 1. táblázat Az alany jellemzői (átlag ± SD) a kiindulási helyzetben és 8 hét után nagyon alacsony energiájú étrenden
Energia kiadások
A TEE szignifikánsan csökkent, a kiindulási érték 12,65 ± 2,08 MJ/d-ról 10,38 ± 1,95 MJ/d-re (P 1. ábra
8 hét után az FABP4 változása szignifikánsan negatívan korrelált az FM változásával (R = −0,35, P 2. táblázat Spearman Rho fehérjeszint-változásának korrelációs együtthatói a testösszetétel és az energiafelhasználási paraméterek változásával. A megnövelt (+) és a csökkent (-) paramétereket az első oszlop jelzi
A fogyás után szignifikáns pozitív összefüggés volt az AldoC változása és a TEE százalékos változása között (R = 0,44, P
Vita
A glükóz- és zsírsav-anyagcserében részt vevő fehérjék mérése egy 8 hetes VLED előtt és után tükrözi a zsírszövetben az energiafelhasználáshoz kapcsolódó metabolikus adaptációkat. Pontosabban: az AldoC, a glikolízis enzimének csökkenése összefüggésben van az AEE csökkenésével, és a mitokondriális béta-oxidáció szempontjából kulcsfontosságú enzim, a HADHsc nem jelentős változása negatívan korrelál a REE-ben történő adaptációval. Ezenkívül összefüggés van az FABP4 növekedése, az intracelluláris zsírsav transzporter és a zsírtömeg csökkenése között, valamint összefüggés van az AldoC csökkenése és a zsírmentes tömeg csökkenése között. A FABP4, az AldoC és a HADHsc pozitívan korrelál.
A VLED súlycsökkenés után megnövekedett FABP4 összhangban van az elhízott személyek korábbi eredményeivel [11, 12, 44]. Összhangban van a zsírsavak intracelluláris kereskedelmének emelkedésével, amely a lipolízis stimulálásakor várható negatív energiamérleg során várható, a raktározott trigliceridekből származó zsírsavak felszabadulásával, amelyek ezt követően felhasználhatók a mitokondriális béta-oxidációhoz a zsírban vagy kiválasztódnak a sejtből, hogy más szövetek energiaforrásaként szolgáljanak. Az energia korlátozása körülményei között a lipolízis növekedése és a zsírsavak intracelluláris kereskedelme a zsírtömeg csökkenését eredményezi. Ez összhangban lenne az FABP4 növekedése és a zsírtömeg csökkenése közötti megfigyelt összefüggéssel.
Az energiakorlátozás során az AldoC csökkenése összhangban van a korlátozott energiájú étrendben elhízott alanyok korábbi eredményeivel [11, 12]. Ezzel egyidejűleg a vércukorszint nem változik az energia korlátozása után. Az energia-korlátozás során az AldoC következetesen megfigyelt csökkenése [13] arra utal, hogy ez a zsírszövet glikolitikus fluxusának markere lehet. Ezenkívül egyrészt a zsírszövet glikolitikus fluxusának csökkenése, másrészt az aktivitás és az izomhasználat csökkenése közötti párhuzam alapozhatja meg az AldoC csökkenése és az AEE csökkenése közötti megfigyelt összefüggést. Az AEE csökkenése összhangban van a korábbi tanulmányokkal, amelyek az energiakorlátozás következtében a fizikai aktivitás csökkenését mutatják [23–28]. Hipotetikusan eredményeink azt jelezhetik, hogy szubsztrátként csökkent glükóz hozzáférhetőség esetén csökken a glikolitikus fluxus a zsírszövetben és csökken az aktivitás annak érdekében, hogy a vércukorszint mint glükózfüggő szövetek, például az agy vagy a vörösvértestek ellátása megőrizhető legyen 45]. Ezenkívül a szubsztrát csökkent hozzáférhetősége növelheti az aminosavak iránti igényt más szövetek energiaforrásaként [46]. Ez összhangban lenne az AldoC csökkenése és a zsírmentes tömeg csökkenése közötti megfigyelt összefüggéssel.
A HADHsc nem emelkedik szignifikánsan a 8 hetes VLED végén, amelyet korábban leírtak [11, 12]. Korábban Bouwman és mtsai. pozitív korrelációt mutatott a béta-oxidáció három enzime (HADHsc, Acetyl-CoA acetiltranszferáz és Acyl-CoA dehidrogenáz) és a plazma szabad zsírsavak (FFA) között a fogyás fenntartása során [13]. Nyilvánvaló, hogy a HADHsc zsírszöveti szintje párhuzamos a plazma FFA szintjével. Az energia-korlátozás során megnövekedett FFA-szint támogatná az egyéb perifériás szövetekbe áramló energiaáramlást, ami alacsonyabb adaptív termogenezist tehet lehetővé a REE-ben. Úgy tűnik, hogy ez összhangban áll a HADHsc változása és az adaptív termogenezis közötti megfigyelt összefüggéssel a 8 hetes VLED után. A HADHsc kulcsfontosságú a béta-oxidáció szempontjából [29, 30]. Ezért lehetséges, hogy a HADHsc változásai a mitokondriális béta-oxidációs útvonalon keresztül a zsírsavak áramlásának változását tükrözik. Hipotetikus szempontból a mitokondriális béta-oxidációs fluxus felfelé történő szabályozása az aktivált lipolízis következménye lehet, ami megnövekedett plazma FFA-hoz és kisebb adaptív termogenezishez vezet a REE-ben.
A FABP4 és a HADHsc közötti korreláció szintén összhangban áll a lipolitikus aktivitást tükröző HADHsc szinttel, mert ez párhuzamos lenne a zsírsavak intracelluláris kereskedelmének követelményével. Ezenkívül a zsírszövetekben a zsírsavak fokozott kereskedelme és béta-oxidációja egybeeshet a glikolitikus úton átmenő csökkent fluxussal. Ebben a tekintetben az AldoC, az FABP4 és a HADHsc pozitív korrelációja azt jelentené, hogy a magasabb zsírsav fluxus jobb a glikolitikus fluxus fenntartásához.
Ennek a vizsgálatnak korlátja az összes zsírszöveti biopsziás anyag felhasználása a Western-blotoláshoz, mivel ez más sejttípusokat is tartalmazhatott a stromalis vaszkuláris frakcióban. Korábbi vizsgálataink eredményei azonban azt mutatják, hogy az izolált fehérje nagy része adipocitákból származik [13]. Ezenkívül a béta-aktin nem mutatott szignifikáns változásokat, és háztartási kontrollként választották, hogy összehasonlíthassa a jelen eredményeket más vizsgálatok eredményeivel. Bár a kiválasztott fehérjék részt vesznek a glükóz- és zsírsav-anyagcsere fő lépéseiben, és tükrözhetik a metabolikus utak kapacitását, meg kell jegyezni, hogy a fehérjeszintek nem képviselik az útvonalakon keresztüli tényleges fluxust. Továbbá a zsírszövetek megfigyelt összefüggései nem alakíthatók át szabályozási mechanizmusokká, és nem alkalmasak az okozati összefüggések bizonyítására. Bár a megfigyelt eredmények összhangban vannak az intuitív elvárásokkal, és a feltételezett mechanizmusok későbbi kutatások tárgyát képezhetik.
Összefoglalva: az energiakorlátozás során a zsírszövetben a molekuláris anyagcsere összekapcsolódik az energiafelhasználással. Pontosabban, az AldoC csökkenése korrelál az AEE csökkenésével, ami a glükóz megőrzésével magyarázható, és a HADHsc változása korrelál az adaptív termogenezissel a REE-ben, ami a béta-oxidáció változásával magyarázható és lipolízis. Összességében megállapításaink összefüggést tárnak fel az élettani szintű változások és a zsírsejtek molekuláris anyagcseréjének változásai között. Ez megmutatja a zsírszövet fontos szerepét az elhízott embereknél. A zsírszövetben bekövetkező negatív energiaegyensúly következtében bekövetkező molekuláris változások akár a testösszetétel és az energiafelhasználás adaptációinak mögöttes hajtóereje is lehet (2. ábra).
A zsírszöveten belüli változások hálózatának áttekintése a negatív energiaegyensúly következtében, valamint a testösszetétel és az energiafelhasználás adaptációival kapcsolatos hipotetikus összefüggések eredményeként. FABP4, zsírsavkötő fehérje 4, HADHsc, rövid láncú 3-hidroxi-acil-CoA dehidrogenáz, AldoC, fruktóz-biszfoszfát-aldoláz C, FM, zsírtömeg, FFM, zsírmentes tömeg, FFA, szabad zsírsavak, REE, nyugalmi energiafelhasználás, AEE, tevékenység indukált energiaköltség, TEE, teljes energiaköltség
- Súlycsökkentés és ursodeoxikolsav alkoholmentes zsírmájbetegségben szenvedőknél
- Súlycsökkentés és ursodeoxikolsav alkoholmentes zsírmájbetegségben szenvedőknél
- A súlyváltozások hatása az alkoholmentes zsírmáj betegségre normál testsúlyú felnőtt férfiaknál
- A változások nyilvánvalóak; Polna Éva a fogyás eredményével büszkélkedhetett; Hírességek Hírek
- A Wellbutrin fogyás okozhat súlyváltozásokat