A zsírszöveti mitokondriális fehérjék magas zsírtartalmú étrend által kiváltott csökkenésének időbeli lefolyása: lehetséges mechanizmusok és kapcsolat a glükóz intoleranciával
Absztrakt
a zsírszövetet klasszikusan inert tároló raktárként tekintik a felesleges kalóriákra. Azonban ma már széles körben elismert tény, hogy a zsír egy aktív endokrin szerv, és hogy a zsírszövet működésében és morfológiájában fellépő rendellenességek szorosan összefüggenek a glükóz homeosztázis károsodásával (24). Például a növekvő bizonyítékok azt sugallják, hogy a zsírszövet mitokondriális tartalmának csökkenése szerepet játszik a 2-es típusú cukorbetegség patogenezisében. Ennek a hipotézisnek az alátámasztására bebizonyosodott, hogy a mitokondriális légzési lánc enzimek, például az ubiquinone: citochrom fehérjetartalma c oxidoreduktáz mag I alegység (CORE I), citokróm c oxidáz IV alegység (COX IV) és citokróm c génmódosított, inzulinrezisztens rágcsálók epididymális zsírszövetében és adipocitáiban csökken (4, 13, 29, 30). A csökkent mitokondriális tartalom hasonló mintájáról beszámoltak a 2-es típusú cukorbetegségben szenvedő egyénekből származó szubkután zsírszövet-mintákban is (1). Érdekes módon a tiazolendionok (TZD) inzulin-szenzibilizáló hatása szorosan párosul a zsírszövet mitokondriális biogenezisének erőteljes növekedésével (1, 4, 30).
A zsírszövet mitokondriális tartalmának csökkenése inzulinrezisztens állapotokban valószínűleg a peroxiszóma proliferátor által aktivált receptor-γ (PPARγ) koaktivátor-1α (PGC-1α) expressziójának csökkenésének eredménye, amely transzkripciós koaktivátor, amelyről kimutatták, hogy kontrollálódik a mitokondriális gének expressziója fehér zsírsejtekben (27). Például a PGC-1α expresszió csökkent az inzulinrezisztens rágcsálók hasi zsírszövetében (29), valamint inzulinrezisztens alanyok (12) és 2-es típusú cukorbetegségben szenvedő egyének szubkután zsírszövet-mintáiban (1).
Valószínűnek tűnik, hogy a PGC-1α expresszió csökkenése a PGC-1α expressziót indukáló jelátviteli utak csökkenésének és a transzkripciós koaktivátort alacsonyan szabályozó folyamatok aktivációjának kölcsönös növekedésének eredménye lehet. Például az endotheliális nitrogén-oxid szintetázt (eNOS) (18, 29) és az 5′-AMP-aktivált protein kinázt (AMPK) (20, 22) összekapcsolják a fehér zsírszövetben a PGC-1α expresszió indukciójával és annak tartalmával. és/vagy ezen fehérjék aktivitása csökken a súlyosan inzulinrezisztens rágcsálók zsírszövetében (21, 29). Másrészt a közelmúltban azzal érveltek, hogy a hiperglikémia, a szabad zsírsavak emelkedése és/vagy az oxidatív stressz indukciója mind a PGC-1α expressziójának csökkenéséhez, mind a mitokondriális tartalom csökkenéséhez vezethet (2, 7).
Anyagok.
Patkányok kezelése.
Valamennyi protokoll követte a Kanadai Állatgondozási Irányelveket, és az Alberta Egyetem Állathasználati és Jóléti Bizottsága hagyta jóvá. ~ 200 g tömegű hím Wistar patkányokat (Charles River, Wilmington, MA) ketrecenként kettőt helyeztünk el 12: 12-órás világos-sötét ciklusban, és vízzel és standard patkány chow-vel láttuk el ad libitum. Az étrend manipuláció megkezdése előtt 1 hétig patkányokat adaptáltak az állattartó létesítménybe. A patkányok továbbra is kaptak standard patkány chow-t, vagy 2, 4 vagy 6 hétig ad libitum adtak magas zsírtartalmú étrendet. A szokásos chow étrend 28,5% fehérjét, 13,5% zsírt és 58,0% szénhidrátot tartalmazott, a teljes energia százalékában kifejezve. A magas zsírtartalmú étrend 21% fehérjét (kazeint), 59% zsírt (21,07% kukoricaolajat, 37,92% zsírzsírt) és 20% szénhidrátot tartalmazott, az összes energia százalékában kifejezve. Az étrendeket hasonlóan gazdagították fehérjével, vitaminokkal, rostokkal és ásványi anyagokkal.
Intraperitoneális glükóz tolerancia tesztek.
12 órás éjszakai böjt után az állatok intraperitoneális glükózinjekciót kaptak (2 g/testtömeg-kg) 8 és 10 óra között. A vért a farokvénákból heparinizált csövekbe (Fisher Scientific, Edmonton, AB, Kanada) gyűjtöttük 0 perccel (az injekció beadása előtt) és 15, 30, 45, 60, 90 és 120 perccel az injekció beadása után. A teljes vért jégre helyeztük, és a plazma elválasztása céljából centrifugáltuk, és a plazmát további elemzésig -20 ° C-on tároltuk. Ábrázoltuk a glükóz és az inzulin időbeli változását, és mindegyikre kiszámoltuk a görbe alatti területet (AUC). Kiszámítottuk a glükóz és az inzulin AUC-k szorzatát, mivel ez a szisztémás inzulinhatás jelzőjeként használható (6, 26).
A plazma glükóz, inzulin, leptin, adiponektin és NEFA meghatározása.
A plazma glükózt glükóz-oxidáz módszerrel elemeztük. A mintákat három példányban elemeztük mikrolemez-olvasón. E vizsgálat laboratóriumunkban az átlagos variációs együttható (CV) (ciklusküszöb) módszer (15). A béta-aktinra és az érdeklődésre számot tartó génekre standard görbe vizsgálatokat végeztünk. A szóban forgó gén és a β-aktin amplifikációs hatékonysága ekvivalens volt, ahogyan azt a 10 (-1/meredekség) - 1 egyenlet segítségével meghatároztuk. Hasonlóképpen, amikor a log cDNS hígítását ábrázoljuk ΔCT-vel (érdekes CT gén - CT β-aktin), ennek a kapcsolatnak a meredeksége Nicklas et al. (17) Röviden: a β-aktin CT-jét levontuk a mitokondriális D-hurok CT-jéből, hogy létrehozzuk a ΔCT-t. Chow-vel táplált patkányok működtek kontroll standardként, és a ΔΔCT-t ΔCT-ként határoztuk meg magas zsírtartalmú táplálékból - ΔCT-t chow-takarmányból. A mitokondriális D-hurkot és a β-aktint azonos hatékonysággal amplifikáltuk (a DNS-hígítás meredeksége vs. ΔCT
Asztal 1. A zsírtartalmú étrend által kiváltott testsúly, az epididymális zsírpárna tömegének, valamint a plazma hormonok és metabolitok időbeli lefolyása
Az értékek csoportonként 8–14 patkány átlagai ± SE. NEFA, nem észterezett zsírsav; Észak-DD, jelenleg nem áll rendelkezésre adat. Az inzulint, a glükózt, a leptint és az adiponektint egy éjszakai böjt után mértük, míg a NEFA-t táplált állapotban.
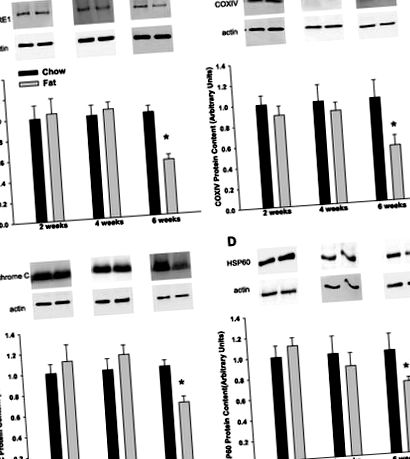
1. ábra.A magas zsírtartalmú táplálás a mitokondriális marker fehérjék tartalmának csökkenését eredményezi: ubiquinone: citokróm c oxidoreduktáz mag I alegység (CORE I; A), citokróm c oxidáz IV alegység (COX IV; B), citokróm c (C) és hősokk-fehérje (HSP) 60 (D) az epididymális zsírszövetben. Az adatokat átlagként + SE-ként mutatjuk be csoportonként 8–13 mintára. A magas zsírtartalmú értékeket a chow-táplált kontrollértékekhez viszonyítva fejezzük ki ugyanabban az időpontban. Reprezentatív blotokat mutatunk be minden érdeklődésre számot tartó fehérje és a b-aktin esetében, amelyet belső terhelésként használtunk. *P
2. ábra.Hat hetes magas zsírtartalmú táplálás a relatív mitokondriális (mt) DNS-kópiaszám és a PGC-1α mRNS-expresszió csökkenését eredményezi. Az adatokat átlagként + SE-ként adjuk meg, csoportonként 6–8 mintára, a chow-feed értékekhez viszonyítva, ugyanabban az időpontban. *P
A magas zsírtartalmú étrend okozta változások az AMPK jelátvitelben, az eNOS fehérjetartalmában és az oxidatív stresszben.
Miután meghatároztuk a zsírszöveti mitokondriális tartalom csökkenésének legkorábbi időpontját magas zsírtartalmú táplálkozással, meg akartuk állapítani, hogy ezek a változások összefüggenek-e az AMPK és az eNOS párhuzamos csökkenésével, a mitokondriális biogenezis híres közvetítői a fehér zsírszövetben. Hat hetes magas zsírtartalmú táplálás nem eredményezte az AMPK foszforilációjának vagy az összes fehérjetartalom csökkenését. Hasonlóképpen, az eNOS fehérje az epididymális zsírszövetben sem csökkent. A magas zsírtartalmú táplálás 6 hétig nem vezetett a fehérje karbonil képződésének vagy az MDA növekedéséhez, ami az oxidatív stressz markerei (3. ábra).
3. ábra.A magas zsírtartalmú táplálás nem eredményezi az AMPK foszforilációjának csökkenését (A), AMPKα fehérjetartalom (B), az endotheliális NO-szintáz (eNOS) fehérjetartalma (C), vagy a tiobarbitursav-reaktív anyagok (TBARS; D) és lipid-peroxidok (E) patkány epididymális zsírszövetben. Az adatokat átlagként + SE-ként mutatjuk be csoportonként 6–11 mintára. A Western blot adatok esetében a magas zsírtartalmú értékeket a chow fed-kontroll értékekhez viszonyítva fejezzük ki ugyanabban az időpontban. Reprezentatív blotokat mutatunk be minden érdeklődésre számot tartó fehérje és a belső terhelés kontrollként használt p-aktin esetében.
A palmitát csökkenti a PGC-1α expresszióját a zsírszövetben.
Az epididymális zsírszövet-aprítókat 24 órán át inkubáltuk M-199-ben 500 μM palmitáttal vagy anélkül kiegészítve. Ez a kezelés a PGC-1α expressziójának ~ 50% -os csökkenését eredményezte. A hiperinsulinémia (24 órás inkubálás 2 mU/ml inzulinnal) nem volt hatással a PGC-1α expressziójára (az adatokat nem mutatjuk be). A palmitát okozta PGC-1α expresszió csökkenése a COX IV és a CORE I fehérjetartalom csökkenésével járt (4. ábra).
4. ábra.A palmitát csökkenti a PPARγ koaktivátor-1α (PGC-1α; A) és mitokondriális fehérjék (B) az epididymális zsírszövetben ex vivo. Az adatokat csoportonként 4–6 minta átlagként + SE-ként mutatjuk be. A Western blot adatokhoz reprezentatív blotokat mutatunk be minden érdeklődésre számot tartó fehérje és a belső terhelésként használt β-aktin esetében. *P
A magas zsírtartalmú étrend okozta változások időbeli lefolyása a glükóz homeosztázisban.
A magas zsírtartalmú táplálkozás a glükóz-clearance károsodásához és az intraperitoneális glükóz-kihíváshoz adott túlzott inzulin-válaszhoz vezetett 4 és 6 hétig magas zsírtartalmú táplálékkal táplált patkányokban (5. ábra). A glükóz-inzulin AUC index (integrált AUC) felhasználható az egész test inzulinhatásának helyettesítőjeként (6, 26), ennek az értéknek a növekedésével a szisztémás inzulinhatás romlása látható. Amint az az 5. ábrán láthatóC, a magas zsírtartalmú táplálás a glükóz-inzulin AUC index jelentős emelkedéséhez vezetett.
5. ábra.A magas zsírtartalmú táplálás károsítja a glükóz toleranciát és csökkenti az egész test inzulin hatását. A görbe alatti terület (AUC) számításait csoportonként 3–8 állat esetében mutatjuk be az intraperitoneális glükóztolerancia-tesztre adott glükóz- és inzulinválaszokra 2, 4 vagy 6 hét magas zsírtartalmú takarmányozás után. A glükóz-inzulin AUC indexet a teljes test inzulinhatásának markerként használták, és ez a glükóz és az inzulin AUC-k terméke. *P
A zsírszövetet egyre inkább felismerik az egész test glükóz-anyagcseréjének szabályozásában. A 2-es típusú cukorbetegség tanulmányozása szempontjából érdekes összefüggést jelentettek a zsírszövet mitokondriális tartalmának csökkenése és a szisztémás inzulinrezisztencia között. Ezeknek a vizsgálatoknak az adatait elsősorban zsírszövet vagy genetikailag módosított rágcsálók adipocitáinak felhasználásával állították elő db/db egerek és fa/fa patkányok (4, 13, 29, 30). Sajnos az ezekben az állatokban jelenlévő markáns inzulinrezisztencia és hiperglikémia miatt nehéz meghatározni azokat a specifikus mechanizmusokat, amelyek a zsírszövet mitokondriális tartalmának csökkenését váltják ki, és hogy a zsírszövet mitokondriumának csökkenése potenciális iniciáló esemény-e a szisztémás inzulinrezisztencia patogenezisében és a glükóz intolerancia. Ezeket a szempontokat szem előtt tartva arra kerestük a választ, hogy a zsírszövet mitokondriális tartalmának csökkenése milyen gyorsan következik be a magas zsírtartalmú táplálkozás során. Ez a közös megközelítés a hasi elhízás és az inzulinrezisztencia kiváltására rágcsálóknál.
A chow-táplált kontrollokkal összehasonlítva 6 hetes zsírtartalmú táplálás a CORE I, a COX IV és a citokróm mitokondriális légzési láncfehérjék tartalmának ~ 30-50% -os csökkenését eredményezte. c. Hasonlóképpen, hasonló csökkenést találtunk az mtHSP60-ban, a chaperone fehérjében, amely részt vesz a mitokondriális fehérje hajtogatásában, és amelyről korábban kimutatták, hogy csökken az epididymális zsírszövetben ob/ob (30) és db/db egerek (19). Megerősítve Western blot adatainkat, a relatív mtDNS kópiaszám csökkenését találtuk, amely jelzi a sejtenkénti mitokondriumok számát. Fontos, hogy adataink azt mutatják, hogy 6 hét zsírtartalmú táplálás a legkorábbi időpont, amikor a zsírszövet mitokondriális fehérjetartalmának csökkenése nyilvánvaló. Ennek a csökkenésnek a mértéke hasonló ahhoz, mint amiről beszámoltak db/db egerek és fa/fa patkányok (4, 13, 29, 30), de hosszan tartó hiperglikémia és hiperinsulinémia hiányában fejlődik ki.
A PGC1-α a mitokondriális biogenezis transzkripciós koaktivátora és fő szabályozója (8). Beszámoltak a PGC-1α expresszió csökkenéséről inzulinrezisztens rágcsálóknál (23, 29), valamint elhízott és 2-es típusú cukorbetegeknél (1, 25). Hasonlóképpen, a tiazolidienedionok mitokondriális biogenezisének indukciója a zsírszövetben a PGC-1α expresszió növekedésével jár (1, 30). Ezekkel a megállapításokkal összhangban a PGC-1α expresszió csökkenését tapasztaltuk a zsírszövet mitokondriális marker fehérjék csökkenésével párhuzamosan. Ezek az eredmények időbeli összhangban állnak azzal a felfogással, hogy a PGC-1α expresszió csökkenése szerepet játszhat a zsírszöveti mitokondriális fehérjék magas zsírtartalmú étrend okozta csökkenésének közvetítésében.
A PGC-1α expresszió és a mitokondriális biogenezis szabályozása a zsírszövetben egy összetett folyamat, amely több tényezőt is magában foglal. A súlyos inzulinrezisztencia modelljeiben a mitokondriális biogenezis olyan pozitív hatásai csökkentek a zsírszövetben, mint az AMPK (21) és az eNOS (29). Másrészt a mitokondriális tartalom (2) negatív modulátorai, mint például az oxidatív stressz, fokozódnak a cukorbeteg egerek zsírszövetében (11). A jelenlegi vizsgálat során felmértük, hogy ezekben a változókban változások történtek-e a mitokondriális tartalom markereinek magas zsírtartalmú táplálkozás okozta kezdeti csökkenésével párhuzamosan. 6 hét magas zsírtartalmú táplálkozás után egy olyan időpontban, amikor a mitokondriális tartalom markerei csökkentek, az AMPK foszforilációja és az eNOS tartalma nem változott. Összhangban a magas zsírtartalmú egerekkel kapcsolatos közelmúltbeli jelentéssel (16), a zsírtartalmú patkányok zsírszövetében nem találtunk különbséget a fehérje karbonil- vagy MDA-tartalmában. Eredményeink együttesen azt sugallják, hogy az AMPK, az eNOS és az oxidatív stressz változásai nem indítanak eseményeket a zsírszövet mitokondriális fehérjetartalmának csökkenését közvetítő folyamatban.
Ezen eredmények alapján arra törekedtünk, hogy meghatározzuk azokat a potenciális mechanizmusokat, amelyek segíthetnek a zsírszövet mitokondriális tartalmának magas zsírtartalmú étrend által kiváltott csökkenésében. A magas zsírtartalmú takarmányozási modellünkben a patkányok normális glükózszintet tartanak fenn, de mind hiperinsulinémiásak, mind hiperlipidémiásak. Tekintettel arra a tényre, hogy a palmitátról korábban kimutatták, hogy csökkenti a PGC-1α expresszióját a vázizomsejtekben (5, 7), azt akartuk megállapítani, hogy a patkány zsírszövetének palmitáttal végzett ex vivo kezelése képes-e reprodukálni a magas zsírtartalmú hatásokat táplálkozás zsírszövet PGC-1α expresszióval és a mitokondriális tartalom markereivel. Megállapítottuk, hogy a palmitát, de nem a magas inzulinszint, a PGC-1α expresszió, valamint a COX IV és a CORE I fehérjetartalom csökkenéséhez vezetett. Ezek az eredmények a magas zsírtartalmú táplálkozást követően a NEFA szintjének megfigyelt növekedésével együtt a zsírsavak lehetséges ok-okozati szerepére utalnak a zsírszövet PGC-1α expressziójának és mitokondriális tartalmának csökkentésében.
Ez a vizsgálat elsőként jellemzi az időbeli összefüggéseket a zsírszövet mitokondriális tartalmának csökkenése, ennek a folyamatnak a lehetséges közvetítői és az egész test glükóz homeosztázisában bekövetkező változások között az étrend okozta elhízás modelljében. Megállapítottuk, hogy a zsírszövet mitokondriális tartalmának csökkenése összefügg a PGC-1α expresszió csökkenésével, és hogy ezek a hatások ex vivo reprodukálhatók a zsírszöveti kultúrák palmitáttal történő kezelésével. A tanulmány legfontosabb megállapítása az, hogy a PGC-1α és a mitokondriális markerekben a károsodott glükóz homeosztázis megjelenése után változások következtek be. Noha a patkány epididymális zsírpárnák jelenlegi eredményei nem feltétlenül extrapolálhatók az emberi zsigeri zsírraktárakra, eredményeink azzal érvelnek, hogy a zsírszövet mitokondriális tartalmának csökkenése a károsodott glükóz homeosztázis kialakulásának kezdő eseménye.
D. C. Wright az Alberta Heritage Foundation for Medical Research Scholar, a kanadai egészségügyi kutatóintézetek (CIHR) új nyomozója és a kanadai Diabetes Association Association tudós. Ezt a kutatást támogatta a Kanadai Természettudományi és Mérnöki Kutatási Tanács felfedezési támogatása R. C. Bell számára, valamint működési támogatás D. C. Wright számára a CIHR-től.
LÁBJEGYZETEK
A cikk megjelenésének költségeit részben az oldaldíjak megfizetése fedezte. A cikket ezért ezennel fel kell tüntetni:hirdetés”Szerint a 18 U.S.C. Az 1734. § kizárólag ennek a ténynek a feltüntetésére.
Köszönjük Donna Taylornak és Abha Hoedelnek a glükóz tolerancia tesztek terén nyújtott kiemelkedő technikai segítséget.
- A lipoprotein lipáz szerepe a zsírszövet fejlődésében és az anyagcserében International Journal
- Visceralis adipozitási index A zsírszövet diszfunkciójának mutatója
- Miért ideje elkezdeni napi szódájának cseréjét; Egészségügyi alapok a Clevelandi Klinikától
- Amit a divatos étrendről mondanak a szakemberek - Idő és pénz - The Times-News - Burlington, NC
- Miért éppen most a legjobb alkalom diétára, vagy az ünnepek utáni fogyás tudományára?