Alacsony szénhidráttartalmú és magas fehérjetartalmú étrend által kiváltott apoptózis patkánymájban
Levelezés: Maria Emília L Monteiro, MSc, egyetemi tanár, a Fluminense Szövetségi Egyetem Orvostudományi Főiskola Belgyógyászati Tanszékének professzora, Rua Mario Sardinha, 46, São Francisco, Niterói, RJ 24360-007, Brasil. rb.moc.arret@sedeugortsachl
Absztrakt
CÉL: Annak meghatározása, hogy a magas fehérjetartalmú, magas zsírtartalmú és alacsony szénhidráttartalmú étrend okozhat-e elváltozásokat a patkánymájban.
MÓDSZEREK: 20 nőstény Wistar patkányt véletlenszerűen felosztottunk egy kontroll étrend csoportba és egy kísérleti étrend csoportba. A kontroll csoportba tartozó állatok AIN-93M étrendben részesültek, a kísérleti csoportba tartozó állatok pedig Atkins-alapú étrendben részesültek (59,46% fehérje, 31,77% zsír és 8,77% szénhidrát). 8 hét múlva a patkányokat altattuk és examináltuk transzaminázok elemzéséhez, és a májukat eltávolítottuk áramlási citometriára, immunhisztokémiai és fénymikroszkópos vizsgálatokra. Az adatokat átlag ± szórásként (SD) fejeztük ki, párosítatlan és paraméteres adatokat feltételezve; elemeztük a különbségeket a Student t-tesztjének felhasználásával. Statisztikai szignifikanciát P-nél állítottuk be. Apoptózis, májkárosodás, magas fehérjetartalmú étrend, magas zsírtartalmú étrend, alacsony szénhidráttartalmú étrend
Alap tipp: Az elhízás súlyos és egyre növekvő egészségügyi probléma. Az Atkins-étrendként ismert fehérjetartalmú, magas zsírtartalmú és alacsony szénhidráttartalmú étrendet az 1970-es évek óta alkalmazzák. Sokan betartják ezt a diétát, hogy megpróbálják lefogyni, és a közelmúltban vezették be a nehezen kezelhető rohamokban szenvedő gyermekek, valamint az Alzheimer- és a Parkinson-kórban szenvedő idősek számára. Az Atkins-diéta előnyei és hatásai továbbra sem tisztázottak, különösen a máj metabolizmusában. Mivel a makrotápanyagokat érintő elsődleges metabolikus reakciók a májban fordulnak elő, elengedhetetlen megérteni az étrend módosulásából eredő lehetséges májelváltozásokat.
BEVEZETÉS
Az elhízás gyakorisága világszerte növekszik a felnőttek, a fiatalok és a gyermekek körében; ez a súlyos egészségügyi probléma széles körű nyilvános mozgósítást igényel a megoldások keresése során. Rendkívül nagyszámú ember tartja be a speciális étrendet, hogy megpróbálja lefogyni [1]. Magas fehérjetartalmú, magas zsírtartalmú és alacsony szénhidráttartalmú étrendet Robert C. Atkins amerikai kardiológus az 1970-es évek közepén jelentette be a karcsúvá válás legjobb és legegészségesebb módjának [2]. Ezt az úgynevezett „Atkins-diétát” vagy „fehérje-étrendet” továbbra is „szeretet vagy gyűlölet kérdésének” tekintik [3]. Ezt a diétát nemrég vezették be a nehezen kontrollálható rohamokban szenvedő gyermekek, valamint az Alzheimer- és a Parkinson-kórban szenvedő idősek számára [4]. Az Atkins-étrenddel kapcsolatos számos orvosi publikáció ellenére az ilyen vizsgálatok többségének eredményei nem meggyőzőek, és nem bizonyították az előnyöket és hatásokat, különösen a máj metabolizmusában [5].
Számos tanulmány összefüggést jelentett a magas fehérjetartalmú étrend és a máj [6], a bélnyálkahártya [7], a vese [8,9], a hasnyálmirigy [10], a zsírszövet [11] és a csontok [9,12] változásai között. ]. Mivel a makrotápanyagokat érintő elsődleges metabolikus reakciók a májban fordulnak elő, elengedhetetlen megérteni az étrendi módosításokból eredő lehetséges májelváltozásokat. Bebizonyosodott, hogy a magas zsírtartalmú vagy alacsony szénhidráttartalmú étrend májsteatózist okozhat, mivel a glükoneogenezis következménye az étrendből és a zsírszövetekből származó zsírsavak iránti túlzott kereslet [5]. Egy nemrégiben publikált tanulmány szerint a magas fehérjetartalmú étrend (a zsír vagy szénhidrát mennyiségétől és típusától függetlenül) nem vezetett steatosishoz, és valóban megfordíthatja azt [13].
A májsejtek az elváltozások fontos célpontjai túlzott táplálék-összetevők jelenlétében, mivel a bélnyálkahártyán keresztül felszívódnak, és a portális vénán keresztül gyorsan eljutnak a májba [6]. A makrotápanyagok közül a szénhidrátok és a zsír nagyrészt felelősek a megfigyelt változásokért, mivel elősegítik a génátíródás, valamint a glikolitikus és lipogén enzimek [szterin-reagálóképes fehérje 1/2 (SREBP) és a rapamicin emlősök célpontja - mTOR], inzulin és adipokinek változását ] [14].
Alacsony szénhidráttartalmú és magas fehérjetartalmú étrenddel etetett állatok májának további szövettani vizsgálata szükséges, mivel az eddigi eredmények ellentmondásosak [19,20].
Itt feltételeztük, hogy a magas fehérjetartalmú (59,46%), a magas zsírtartalmú (31,77%) és a nagyon alacsony szénhidráttartalmú (8,77%) étrend hepatocita elváltozásokat okozhat, amint azt az áramlási citometria és az immunhisztokémia (IHC) azonosítja. Célul tűztük ki, hogy a citometriás eredményeket korreláljuk a fénymikroszkópos változásokkal és a plazma transzamináz szintjével.
ANYAGOK ÉS METÓDUSOK
Állatok
A kísérleti vizsgálatot 2015. március-május között hajtották végre a Táplálkozási Főiskola kísérleti táplálkozási laboratóriumában, a Fluminense Szövetségi Egyetemen, Niterói, RJ, Brazília. Az állatprotokoll minimalizálta a patkányok fájdalmát és kellemetlenségét. A kísérletben 20 nőstény Wistar patkányt (Rattus norvegicus) használtak, amelyek életkora 11-13 hét volt. Az állatok súlya 211–249 g volt, és az Oswaldo Cruz Alapítvány laboratóriumi állattartó létesítményében nevelték, Egészségügyi Minisztérium, Rio de Janeiro, Brazília. Az állatokat csoportos ketrecekben tartottuk, négy-négy állattal adaptáció céljából, 5 nap alatt, ad libitum vízzel és laboratóriumi étrenddel. Ezen időtartam után a patkányokat véletlenszerűen két, egyenként 10 állatból álló csoportba különítettük el (a kontroll étrend-csoport (CDG) és a kísérleti étrend-csoport (EDG)), és egyedileg szabályozott hőmérsékletű (24 ± 2 ° C) polipropilén ketrecekben helyeztük el őket. páratartalom (60% ± 10%) és váltakozó fény-sötét ciklus, amely 12 órás világosságból és sötétségből áll.
Fogyókúrák
Az AIN 93M étrendből álló CDG étrendet [21] felnőtt patkányok fenntartására fogalmazta meg az American Institute of Nutrition 1993-ban; a kidolgozott EDG-étrendet az Atkins-diétára alapoztuk. Mindkét csoport vizet és ad libitum diétát kapott 8 hétig. A diétákat a Pragsoluções Biociências Comércio e Serviços, LTD, Jaú, São Paulo, Brazília készítette. A kontroll étrend összetétele a következő volt: szénhidrát (76,98%), fehérje (13,56%) és zsír (9,46%). A kísérleti étrend szénhidrátból (8,77%), fehérjéből (59,46%) és zsírból (31,77%) állt. A vitaminok, ásványi anyagok, az L-cisztein, a kolin és a rostok mennyisége megegyezett a két csoportban, és a terc-butil-hidrokinont 0,002 mg/gramm zsírra számították, mindezt az AIN 93M meghatározása alapján (táblázatok (1. és 1. táblázat). És2 2).
Asztal 1
A kontroll étrend összetétele (AIN-93M)
| Hozzávalók | g/100 g | CH (g) | PTN (g) | LIP (g) | Ábra) |
| Kukoricakeményítő | 46.5 | 39.52 | |||
| L-cisztein | 0,18 | 0,18 | |||
| Kolin bitartarát | 0,25 | 0,25 | |||
| Ásványi keverék | 3.50 | 0,77 | |||
| Vitamin keverék | 1 | 0,97 | |||
| Terc-butil-hidrokinon | 0,008 | ||||
| Rost | 5. | 5. | |||
| Szójabab olaj | 4 | 4 | |||
| Kazein (> 85% fehérje) | 14 | 11.06 | |||
| Szacharóz | 10. | 10.00 | |||
| Dextrinizált kukoricakeményítő | 15.5 | 13.95 | |||
| Kcal (%) | 338,8 | 260,84 | 45,96 | 32 | |
| Makrotápanyagok (%) | 100 | 76,98 | 13.56 | 9.46 |
A kontroll étrendet 8 hétig táplálták ezzel az étrenddel, amelyet az Amerikai Táplálkozástudományi Intézet dolgozott ki 1993-ban laboratóriumi rágcsálók számára, makroelem-tartalmú szénhidrát (CH), fehérje (PTN) és lipidek (LIP), vitaminok, ásványi anyagok és rostok megfelelő arányával. (FI).
2. táblázat
A kísérleti étrend összetétele (az Atkins-diéta alapján)
| Hozzávaló | (g/100 g) | CH (g) | PTN (g) | LIP (g) | Ábra) |
| Agar | 2 | 2 | |||
| L-cisztein | 0,18 | 0,18 | |||
| Kolin bitartarát | 0,25 | 0,25 | |||
| Ásványi keverék | 3.5 | 0,77 | |||
| Vitamin keverék | 1 | 0,97 | |||
| Terc-butil-hidrokinon | 0,028 | ||||
| Rost | 5. | 5. | |||
| Szacharóz | 6. | 6. | |||
| Kazein (> 85% fehérje) | 20 | 16. | |||
| Porított csirkemell | 60 | 36 | 12. | ||
| Szójabab olaj | 2 | 2 | |||
| Kcal (%) | 352,68 | 30.96 | 209,72 | 112 | |
| Makrotápanyagok (%) | 100 | 8.77 | 59.46 | 31.77 |
A kísérleti étrendcsoportot 8 hétig táplálták ezzel a diétával, amelyet a szerzők az Atkins-étrend alapján készítettek. A makrotápanyagok aránya 2: 1 szénhidrát (CH) + fehérje (PTN)/lipidek (LIP) és rost (FI) volt. A többi összetevő mennyisége megegyezett az AIN-93M-hez ajánlott mennyiséggel.
Kísérleti eljárások és mintagyűjtés
Az áldozat napjának reggelén minden állat hüvelyi keneten esett át az ösztrikus ciklus fázisának meghatározása érdekében. Az ivarzású állatokat elválasztották, és nem kaptak többé hozzáférést az élelemhez. 8 óra koplalás után az állatokat intraperitoneális injekcióval 11,50 mg/100 g testtömeg ketamint és 0,10 mg/100 g testtömeg xilazint tartalmazó oldat injekciójával érzéstelenítettük, és szívszúrással exangetizáltuk [22]. Ezután egyenként feláldozták őket, felváltva a kísérleti és a kontroll csoportot. A vért heparinizált csőbe helyeztük, és 20 percig centrifugáltuk 314 rad/s sebességgel, majd a plazmát elválasztottuk és -80 ° C-on tároltuk az elemzésig. A vért kivéve a májat eltávolítottuk, és hat, egyenként 3 cm-es májdarabot finoman mossunk 0,9% -os NaCl-oldattal, ugyanazzal az oldattal a befogadóba merítettük és a fagyasztóban 2 órán át -4 ° C-on tároltuk. áramlási citometria.
analitikai módszerek
Statisztikai analízis
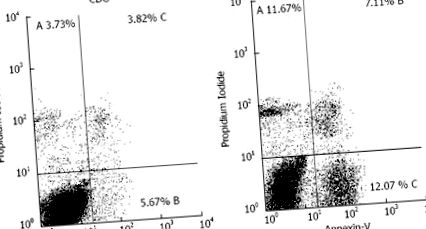
Áramlási citometria hepatocitákban a kísérleti étrendcsoportból és a kontroll étrendcsoportból 8 hét után. Az Annexin-V-t használták a késői apoptózis és a nem apoptotikus halál, valamint a korai apoptózis szempontjából propidium-jodid azonosítására. A-% korai apoptózis; B-% nem apoptotikus halál; C-% késői apoptózis; D-% életképes sejt. EDG: Kísérleti étrendcsoport; CDG: Kontroll diéta csoport.
A két csoport életképtelen sejtjeinek összehasonlításakor csak a korai apoptózis átlagos százaléka volt statisztikailag szignifikáns (táblázat (3. táblázat).
3. táblázat
Életképtelen sejtek a kísérleti étrendcsoportban és a kontroll étrendcsoportban
Májtöredékek festése 8 héten belül: kísérleti étrendcsoport és kontroll étrendcsoport. V: Normális központi véna, funkcionális szinuszos dilatáció és kicsi hepatociták az EDG-ben (HE, eredeti nagyítás 400 ×); B: Normál központi véna, szinuszos sejtek és hepatociták a CDG-ben (HE, eredeti nagyítás 400 ×); C: Glikogén nélküli zónák az EDG-ben (HE, eredeti nagyítás 400 ×); D: A glikogén homogén eloszlása a CDG-ben (HE, eredeti nagyítás 400 ×). EDG: Kísérleti étrendcsoport; CDG: Kontroll étrendcsoport; HE: Hematoxilin és eozin.
VITA
A várakozásoknak megfelelően azt tapasztaltuk, hogy a magas fehérjetartalmú, magas zsírtartalmú és alacsony szénhidráttartalmú étrend sejtes és hisztopatológiai elváltozásokat okozott a kísérleti rágcsálók májában. Az EDT-ben az ALT és az AST növekedett a CDG-vel összehasonlítva. Mivel ezeket a teszteket precíz májfunkciós teszteknek tekintik, eredményeink megerősítették a májkárosodás jelenlétét, amely hepatocita pusztulással jár, plazma membrán megszakadással, késői fázisú apoptózissal és nem apoptotikus halálozással az EDG-ben [23,24].
Jean és mtsai [25] tanulmányában egy olyan állatcsoport, amely 50% fehérje-tartalmú étrendet kapott, magas ALAT- és normális AST-értéket mutatott, összehasonlítva a módosított AIN-93M étrendet kapott kontrollokkal. Az eredményeket májelváltozásokként értelmeztük, mivel az ATL egy specifikus májenzim, amely a hepatocita citoplazmában található; Az AST izmokkal és vesékkel is kifejezhető [23,25]. Oarada és mtsai [6] kimutatták, hogy amikor a patkányokat egyre nagyobb mennyiségű fehérjével etették (35%, 40%, 45% és 50%), az ALT és az AST ugyanolyan mértékben növekedett. Ezek a szerzők ennek megfelelően arra a következtetésre jutottak, hogy a fehérjétől független egyéb makrotápanyagok és az energiafogyasztás a májkárosodás kockázati tényezője. Egy nemrégiben készült tanulmányban Kostogrys és munkatársai [26] 50,0% fehérje, 37,7% zsír és 12,3% szénhidráttartalmú étrend mellett nem találtak változást a plazma transzamináz szintjén, bár a máj megnagyobbodott az AIN93-M étrendet kapó állatokhoz képest. Eredményeink összehasonlítása az irodalomban leírtakkal nehéz lehet, mivel a patkányokhoz táplált makrotápanyagok százalékos aránya egyik vizsgálatonként változik.
Az áramlási citometria megerősítette a májkárosodást, amit a plazma transzamináz szintjének emelkedése is bizonyított; A hepatociták 30,85% -a nem volt életképes az EDG-ben, szemben a kontroll állatok 13,22% -ával. A CDG életképtelen sejtjei 3,73% korai apoptózist, 5,67% késői apoptózist és 3,82% nem apoptotikus halált tartalmaztak. A kontrollcsoportban ezek a megállapítások fiziológiásnak tekinthetők, mivel az apoptózis és a nem apoptotikus halál folyamatos folyamatot jelent, amely felelős a proliferáció és a sejthalál egyensúlyának fenntartásáért. A nem apoptotikus halál ugyanannak a folyamatnak a része, mivel az apoptózison áteső sejtek végső sorsa [24].
Az apoptózis jelentősen megnőtt az EDG-ben, 11,67% korai apoptózis, 12,07% késői apoptózis és 7,11% nem apoptotikus sejt nem fiziológiai állapotot mutat. Az apoptózis bármilyen szabályozatlansága káros és szövetkárosodást eredményez [15]. Hasonló eredményeket találtak Chiang és munkatársai [27], akik kimutatták, hogy a 8 hetes étrendet kapó egerek 60% fehérjével változtak a testtömegben, a máj szövettanában, valamint az apoptózis és a fibrózis expressziójában.
A jelen tanulmány másik fontos megállapítása az volt, hogy a korai apoptózis, az mRNS degenerációja százalékban szignifikánsan magasabb volt az EDG-ben (37,34%), mint a CDG-ben (28,43%) (P Huang TT, Cawley JH, Ashe M, Costa SA, Frerichs LM, Zwicker L, Rivera JA, Levy D, Hammond RA, Lambert EV és mtsai. Az elhízás megelőzésére irányuló politikai intézkedések állami támogatásának mobilizálása. Lancet. 2015; 385: 2422–2431. Doi: 10.1016/S0140 -6736 (14) 61743-8. [PubMed] [CrossRef] [Google Tudós]
- Az AMPK aktiválása megvédi a diéta által kiváltott elhízástól az Ucp1-független termogenezis révén
- A szakaszos böjtölés, a magas fehérjetartalmú étrend segített a fogyásban 105 kg
- A kakaó, a kávé, a zöld tea és a garcinia komplex kiegészítő jótékony hatása az étrendre
- A magas fehérjetartalmú étrend székrekedést okozhat
- Az alacsony szénhidráttartalmú étrend segíthet-e a migrénben szenvedőknek