Anyagcsere-változások a zsigeri zsír eltávolítását és tágulását követően
Absztrakt
A megnövekedett zsigeri zsírbetegség az anyagcsere-rendellenességek, például a diszlipidémia, a magas vérnyomás, az inzulinrezisztencia és a 2-es típusú cukorbetegség kockázati tényezője, míg a perifériás (szubkután) elhízás nem. Jóllehet az ilyen zsírraktár-különbségekhez hozzájáruló specifikus mechanizmusok nem ismertek, a zsigeri zsír felhalmozódása a metabolikus diszregulációt eredményezi a májban a májkapu vénáján keresztül a megnövekedett szennyvíz, például zsírsavak és/vagy adipokinek/citokinek miatt. A zsigeri zsír felhalmozódásának kóros jelentőségét a zsírraktár/adipocita-specifikus jellemzőknek is tulajdonítják, nevezetesen a strukturális, fiziológiai és metabolikus jellemzők közötti különbségeknek a szubkután zsírhoz képest. A metabolikus diszregulációban szerepet játszó, helyfüggő vagy független tényezők azonosítására zsírkezeléseket, például eltávolítást vagy transzplantációt alkalmaztak. Úgy tűnik, hogy az elhízás által kiváltott zsírszöveti funkciók/belső jellemzők, de nem a tömeg, felelősek az elhízás által kiváltott metabolikus diszregulációért, ezért a „minőség” fontosabb, mint a „mennyiség”. Ez az áttekintés az elhízás által kiváltott metabolikus diszfunkció következményeit foglalja össze, mivel az összefügg az anatómiai hellyel és a benne rejlő adipocita jellemzőkkel.
Bevezetés
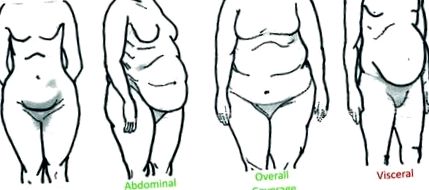
A felhalmozódó zsírszövet eloszlása az egyének között változó, de általában az alsó test, a hasi szubkután (a bőr alatt), az általános fedettség vagy a zsigeri zsír (a szervek között a hasüregben található) kategóriába sorolható (1. ábra). Az elhízással kapcsolatos káros egészségügyi következmények azonban kevésbé kapcsolódnak a testzsír teljes lerakódásához, és szorosabban kapcsolódnak a zsír pontos eloszlásához. Pontosabban, az alsó test 1 és a hasi szubkután 2 - 4 zsír felhalmozódása csökkent metabolikus zavarokkal jár, míg a felső test zsíreloszlása és a zsigeri zsír megnövekedése, 5 - 8 pedig metabolikus diszregulációval jár. A felsőtest/zsigeri elhízáshoz kapcsolódó anyagcserezavarok közé tartozik a dyslipidaemia, a 9 magas vérnyomás, a 10, 11 inzulinrezisztencia és a 2-es típusú cukorbetegség. 12, 13 Bár ennek a kapcsolatnak a mechanizmusai még nem tisztázottak, a zsigeri zsír negatív következményeit általában a zsír tömegének, helyének és/vagy az adipocita specifikus fiziológiának tulajdonítják.
1.ábra. A testzsír megoszlásának leírása az embereknél. Alsó test: zsírmegőrzés a fenék, a csípő és a comb körül. Hasi szubkután: szubkután zsírraktározás a gyomor és a mellkas körül. Általános lefedettség: zsírfelhalmozódás a karokban, az emlőben, a combokban, a fenékben, a hát alsó részén és az emlőben. Visceralis: intraabdominális zsírlerakódás olyan szervek között, mint a belek, a gyomor, a máj és a hasnyálmirigy. A zsigeriüregben elosztott zsír nagymértékben összefügg az elhízással összefüggő egészségügyi következményekkel, míg más zsíreloszlás nem.
A zsírszövet helye
Karcsú vagy elhízott embereknél a teljes zsírszövet tömegének körülbelül 85% -a szubkután, míg a fennmaradó 15% intraabdominális zsír, beleértve a zsigeri és a retroperitoneális zsírraktárakat is. 14 A zsigeri zsír, amely magában foglalja a mesenterialis és az omentális zsírraktárakat (1. ábra), csak
A teljes testzsír 10% -a, 14 esetben mégis a legmagasabb az anyagcsere-rendellenesség kockázata. A zsigeri elhízásról feltételezhető, hogy az anatómiai helye és a máj vénás elvezetése alapján hajlamosítja az egyéneket az egészségre gyakorolt káros hatásokra; azaz az inzulinérzékeny hepatociták közvetlenül ki vannak téve a zsigeri adipociták által a portális vénába engedett metabolitoknak és szekréciós termékeknek. 15 - 17 Mivel a szubsztrát bejuttatása a máj glükoneogenezisének és a nagyon kis sűrűségű lipoprotein (VLDL) szintézisének fő meghatározója, 6 megnövekedett térfogatú zsigeri zsír, majd a zsírsavak, glicerin és laktát felszabadulása, számos adipokin és pro mellett. - a gyulladásos citokinek közvetlenül a portális vénába várhatóan jelentősen befolyásolják ezeket a májfolyamatokat.
A máj krónikus emelkedett szabad zsírsav-expozíciója elősegíti a máj glükoneogenezisét, a 17, 18 csökkenti a zsírsav-oxidációban részt vevő enzimeket, és növeli a zsír 19–21-es zsírtartalmát és szintézisét, valamint az inzulinrezisztenciát. A máj megnövekedett zsírsav fluxusa szintén csökkenti a máj inzulin kötődését és lebomlását. 22 Ez szisztémás hiperinsulinémiát eredményez 23 és a máj glükóztermelésének inzulinszuppressziójának további gyengülését (vagyis a máj inzulinrezisztenciáját). 24 Ezenkívül a zsírsavak megkönnyítik a máj glükóztermelését azáltal, hogy folyamatos energiaforrást és szubsztrátot biztosítanak. Összességében a máj túlzott lipidterhelése méhen kívüli lipid felhalmozódást és inzulinrezisztencia kialakulását vagy súlyosbodását eredményezheti. 23, 25 Az ezekhez a folyamatokhoz kapcsolódó inzulinrezisztencia viszont fokozza az elhízás metabolikus hatásait a diszlipidémia fokozásával. 26.
Bár a zsigeri elhízás összefüggésben van a étkezés utáni 27 és a felszívódás utáni 28 szisztémás zsírsavkoncentráció növekedésével, és a portális véna zsírsavkoncentrációja arányosan növekszik a zsigeri zsír felhalmozódásával 29 (2. ábra), egyesek szerint a zsigeri elhízás nem a metabolikus diszfunkció fő kezdeményezője. Az alternatív megfigyelések szerint a máj elhízás okozta patofiziológiája annak tudható be, hogy a szubkután zsírszövet korlátozottan képes felesleges energiát tárolni. Elhízott embereknél a becslések szerint a szubkután zsírraktár biztosítja a szabad zsírsavak túlnyomó részét a 29. portálon és a szisztémás keringésben. 29, 30 Valóban, egyes becslések szerint a portális véna zsírsavkoncentrációjának csak 5–20% -a származik zsigeri zsírszövetből. 29 Bár a zsigeri zsírtól eltérő tényezők valószínűleg részt vesznek az elhízással összefüggő anyagcserezavarokban, ezek az adatok arra utalnak, hogy a zsigeri zsír és az anyagcsere-diszfunkció erős összefüggése több szekretált tényezőt is magában foglal.
2. ábra. A zsigeri és a szubkután zsírszövetraktárak közötti különbségek. Vízelvezetés helye: a zsigeri depó (bal oldalon) a portális vénába, míg a szubkután depóba (jobbra) a szisztémás keringésbe juttatja a termékeket. Elhízás esetén a májba kerülő portális vénák magasabb koncentrációban tartalmaznak szabad zsírsavakat és interleukin-6-ot, mint a szisztémás keringés. Zsírraktár: A zsigeri és a szubkután zsírt eredendő különbségek jellemzik. A bőr alatti zsírral összehasonlítva a zsigeri zsírt csökkent adiponektin és leptin, fokozott gyulladásos adipo/citokinek, fokozott lipolízis, csökkent inzulinra adott válasz, csökkent differenciálódás és angiogenezis jellemzi.
A májkapu vénájába kerülő adipokin/citokin kinevezés szintén szerepet játszik a zsigeri zsírszövet tágulásának következményeiben. A máj inzulinrezisztenciájához hozzájáruló közönséges adipocitokinek közé tartozik az adiponektin, a leptin, az rezisztin, a tumor nekrózis faktor (TNF) -α és az interleukin (IL) -6 (2. ábra). Az adiponektin számos metabolikus folyamat modulátora, például a glükózszabályozás és a zsírsav-anyagcsere. Olyan antidiabetikus, -aterogén és -gyulladásos peptidnek tekintik, amely szoros összefüggésben van a szisztémás inzulinérzékenységgel. 31 - 33 Az adipokinek többségétől eltérően az adiponektin szekréciója és a májban levő receptor expressziója fordítottan összefügg a zsírszövetek tömegének növekedésével és az alkoholmentes steatohepatitisszel. 34, 35
Úgy tűnik azonban, hogy a portális véna adiponektinjének elhízás által kiváltott változásai nem különböznek az artériás adiponektintől, mint a máj metabolikus diszregulációjának markerétől. Bár a leptin és az rezisztin is képes inzulinrezisztenciát kiváltani, ezek a hatások nem a portális véna és a szisztémás koncentráció különbségei miatt következnek be. 37, 38
A növekvő zsírszövet-tömeg további következménye az adipocitákból és/vagy a beszűrődő makrofágokból felszabaduló proinflammatorikus molekulák megnövekedett termelése. Az elhízást több proinflammatorikus citokin emelkedése jellemzi, beleértve a TNF-α-t és az IL-6-ot, és ezek a citokinek az inzulin működésének károsodásához kapcsolódnak a májban, az izomban és a zsírszövetben. 37, 40 Noha a TNF-α szisztémás vérkoncentrációja megnő az elhízásban, a portális vénák koncentrációi nem különböznek a perifériás artériában mértektől. Egyes tanulmányok azt sugallják, hogy a TNF-α az emberek vérében, ellentétben a rágcsálókkal, 41 nem választódik ki mérhető szinten. 42, 43 A változások szisztémás kiváltása helyett a TNF-a lokálisan modulálja az inzulinérzékenységet 42 az adipocitákon belül, és stimulálja más adipo/citokinek, például a leptin és az IL-6 expresszióját, és növeli a zsírsavak felszabadulását is. Bár a portális és a szisztémás TNF-α koncentráció nem tűnik különbözõnek, de kimutatható esetben a TNF-α által kiváltott lokális zsírraktár-tényezõk változásai hozzájárulhatnak a portális véna növekedéséhez más adipo/citokinekben. Alternatív megoldásként az elhízott embereknél az IL-6 az
50% -kal magasabb a portális vénában, mint a perifériás artériában, 38 tehát potenciális mechanisztikus kapcsolat a zsírraktár anatómiai helye és az elhízás által kiváltott káros egészségügyi következmények között. Összességében további kutatásokra van szükség annak tisztázása érdekében, hogy a zsigeri zsírpárna kitágulása milyen hatással van a máj és az extra-máj metabolikus szabályozására, valamint arra, hogy ezeket a hatásokat milyen mértékben közvetítik a portális vénába szekretált molekulák.
A zsírszövet eredendő jellemzői
A zsírszövetraktárak különböző szerkezeti, fiziológiai és metabolikus jellemzőkkel rendelkeznek. Tehát azt javasolták, hogy a natív adipociták különféle biológiai tulajdonságai hozzájáruljanak a viszcerális zsír és az anyagcsere diszreguláció közötti asszociációhoz. Mivel a zsírszövetet endokrin szervként ismerik el, amely számos fehérjét választ ki, amelyek módosítják az anyagcserét, a kutatások nagy része az adipo/citokin felszabadulás depó-specifikus különbségeire összpontosított. Mivel az elhízott egyének zsírszövetében a legtöbb adipo/citokin termelése megnövekszik, 45 azt javasolták, hogy a differenciál fehérje szekréciója a visceralis és a szubkután zsír divergens metabolikus következményeit okozza. Az elhízás sok adipo/citokint növel, de csak néhányról van kimutatva, hogy következetesen különböznek a zsírraktárak között (2. ábra). Például úgy tűnik, hogy a leptin és az adiponektin gén expressziója a 46–48-ban és a 49, 50-es felszabadulás magasabb a szubkután zsírszövetben, mint a visceralis. Ezzel szemben a citokin expresszió, különösen az IL-6, IL-8, PAI-1, MCP-1 és a Visfatin, úgy tűnik, hogy a zsigeri zsírban nagyobb, mint a szubkután zsírban (áttekintést lásd az 51-es hivatkozásban).
A zsírszövetraktárak közötti egyéb belső és külső különbségek szintén módosíthatják a génexpressziót és az anyagcserét az adipocitákban. Néhány javasolt belső hatás közé tartozik az átlagos adipocita méret, az adipocyta terjeszkedési képesség és a sejt heterogenitás. A megnövekedett zsigeri adipocita méret a zsírszövet diszfunkciójához, gyulladásához, az adipocita apoptózisához, a szisztémás lipotoxicitáshoz és a metabolikus paraméterek későbbi csökkenéséhez kapcsolódik, míg a szubkután zsírszövetben az adipocita méret növekedése nem. A zsigeri zsírt a differenciálódás csökkent képessége 71 és a szubkután zsírhoz viszonyítva fokozott érzékenység az apoptotikus ingerekre 69 is fokozza. A jelenleg figyelemre méltó egyéb tényezők közé tartozik a kötőszövet, a makrofágok, az immunsejtek és a sztromovaszkuláris sejtek eltérései. 72, 73 Az extrinsic faktorok, amelyek szerepet játszhatnak a megnövekedett zsigeri zsírtömeggel összefüggő metabolikus szövődményekben, magukban foglalják az angiogén képességet és az innervációt. 74, 75 Összességében a jelenlegi kutatások azt mutatják, hogy a zsigeri zsírszövet morfológiailag és funkcionálisan különbözik a szubkutántól. A zsigeri zsírbővítés káros egészségi következményeiért felelős pontos mechanizmusok azonban továbbra sem tisztázottak.
A zsigeri zsír és a káros anyagcsere eredmények közötti kapcsolat meghatározása zsírmanipulációval
Lipectomia (zsíreltávolítás) vizsgálatok
Az intraabdominális zsírszövet szelektív csökkentése javítja az anyagcsere profilját. Pontosabban, az intraabdominális lipectomia megfordítja az inzulinrezisztenciát és a glükóz intoleranciát elhízott, idős és fiatal rágcsálóknál. 76 - 81 Noha az emberekben ellentmondásos, 82, 83 az omentális zsíreltávolítás javítja az inzulin hatékonyságát, 84, 85, míg a nem zsigeri zsír eltávolításának nincs hatása. 86 Az emberi omentectomia-vizsgálatok között valószínűleg ellentmondásos eredmények merülnek fel, mivel az eredménymérések nem elég következetesek vagy érzékenyek az anyagcsere-fejlesztések kimutatására. Ezenkívül, ha az omentectomiát kombinálják a gyomor bypassjával, az bypass miatt felgyorsult fogyás elfedheti az omentális zsíreltávolítás jótékony hatásait. Míg számos tanulmány megvizsgálta az inzulinhatás, a glükóz tolerancia és még az adipokinek lipectomia által kiváltott változásait, ezek a javulási mechanizmusok továbbra sem tisztázottak. A kutatások azonban azt sugallják, hogy a szabad zsírsavak és az adipo/citokinek változásai kiemelkedő szerepet játszhatnak az inzulinjelzés és a glükóz homeosztázis zsíreltávolítás által kiváltott javulásában. 76 - 81
A rágcsálókon végzett korábbi lipectomia-vizsgálatok némileg korlátozottak, mivel nem egyértelmű, hogy a kivágott zsír valóban kapcsolódott-e a máj portális elvezetéséhez. Például az epididymális fehér zsírszövet (EWAT) intraabdominális helyen van patkányokban és egerekben, amely lehetővé teszi a gyors és egyszerű eltávolítást, ezért sok kutató az epididymális zsírt visceralis depónak tekintette. A szisztémás keringésbe való elvezetése miatt azonban az EWAT nem tekinthető zsigeri depónak. 103 Ezen túlmenően az EWAT-nak nincs humán megfelelője, ezért megfelelőbb olyan lipectomia-vizsgálatok elvégzése, amelyek a tényleges visceralis zsírszöveteket, például a mesenterialis és az omentális WAT-ot (MWAT és OWAT) manipulálják.
Transzplantációs vizsgálatok
A zsírszövet-transzplantáció felhasználásával végzett alapvető tanulmány, amely meghatározta a zsírszövet-fiziológia szerepét az inzulinrezisztenciában és a 2-es típusú cukorbetegségben, paradox megközelítést alkalmazott lipoatrofikus (alacsony zsírtartalmú) recipiensen keresztül. Ez a tanulmány kimutatta, hogy normál szubkután zsírszövet hozzáadása lipoatrophiás egerekhez megfordította a hiperfágia, az inzulinrezisztencia, a máj steatosis és a hypoleptinemia kialakulását, 108 ami arra utal, hogy a zsírszövet hiánya okozta az anyagcsere rendellenességeit. A javuláshoz vezető mechanizmusok azonban nem ismertek, de magukban foglalhatják az adipociták és az izmok fokozott szabad zsírsavfelvételét és a keringő leptin fokozódását.
- Alkoholmentes zsírmájbetegség A metabolikus szindróma előfutára - ScienceDirect
- A magzati visceralis zsírbetegséggel kapcsolatos prenatális tényezők - ScienceDirect
- Metabolikus adaptációk a terhességben - áttekintés - FullText - Annals of Nutrition and Metabolism 2017,
- Metabolikus alkalmazkodás alacsony szénhidráttartalmú fehérjetartalmú étrendhez (’hagyományos’) az ausztráliai
- Anyagcsere - táplálkozási terápia működik