Az agy 5-HT hiánya megakadályozza a magas zsírtartalmú étrend antidepresszáns-szerű hatásait és blokkolja a magas zsírtartalmú étrend okozta GSK3β foszforilációt a Hippocampusban
Társított adatok
Az ehhez a tanulmányhoz létrehozott adatkészletek kérésre rendelkezésre állnak a megfelelő szerző számára.
Absztrakt
Bevezetés
Módszer
Állatok
Az ebben a vizsgálatban használt Tph2R439H egérvonalból származó hím homozigóta WT és homozigóta KI állatokat heterozigóta tenyésztéssel hoztuk létre a Villanova Egyetemen. Ezt a vonalat 10 generáció óta visszakeresztezték a C57BL/6 vonalon, és alomtársakat használtak kontrollként. Felnőtt egereket használtunk minden kísérlethez, és a HFD-expozíció akkor kezdődött, amikor az egerek 2–4 hónaposak voltak. Az egerek átlagos életkorában egyik kezelőcsoportban sem volt különbség. Valamennyi vizsgálatot az Intézményi Állatgondozási és Felhasználási Bizottság (IACUC) által jóváhagyott protokolloknak megfelelően hajtották végre.
Diéta és Lakhatás
Valamennyi egeret az elválasztástól kezdve a HFD-expozíció kezdetéig Envigo Teklad Global Diet-jével táplálták (szokásos természetes összetevőket tartalmazó étrend: ID # 2019, 19% fehérje, 9% zsír és 3,3 kcal/g). A HFD csoportokat Envigo Teklad Custom Diet-jével (módosított zsírtartalmú étrend: ID # 95217, 18,8% fehérje, 39,7% zsír és 4,3 kcal/g) etették összesen 22 hétig, míg a standard étrend (SD) csoportok továbbra is Envigo-t kaptak # 2019 diéta a vizsgálat során. Táplálék és víz ad libitum volt elérhető, és az állatokat egy hőmérséklet és páratartalom szabályozott helyiségben helyezték el. Az egereket csoportosan helyeztük el (ketrecenként három-öt), 12 órás világos-sötét ciklusban tartottuk, és a kísérlet folyamán hetente lemértük őket. A viselkedésvizsgálat azután kezdődött, hogy az egerek 20 hétig HFD-n (vagy SD-n) voltak. A tesztek sorrendje a következő volt: nyílt terepi teszt (OFT), 20. hét, péntek; emelkedett plusz labirintus (EPM), 21. hét, hétfő; és kényszerúszó teszt (FST), 21. hét, péntek. A viselkedéstesztet a világos-sötét ciklus világos fázisában végezték, jellemzően kezdve
5 órával a sötét fázis kezdete előtt.
A WT és KI egerek külön csoportjait külön-külön helyeztük el, hogy lehetővé tegyük a táplálékbevitel mérését. Az SD és a HFD huszonnégy órás fogyasztását hetente egyszer mértük.
Nyílt terepi teszt
Az OFT esetében a feltárást és a mozgásszervi aktivitást 40 cm × 40 cm méretű plexi ANY-box aktivitás kamrákban (Stoelting, Wood Dale, IL, USA) értékeltük, 20 cm × 20 cm középnégyzet méréssel. Minden egeret a nyílt mező sarkába helyeztünk, és mozgását és helyét 20 percen keresztül rögzítettük digitális digitális kamerákkal. A teljes megtett távolságot, a központban megtett távolságot, a központba történő belépések számát és a központban töltött időt mind kiszámoltuk az ANY-labirintus szoftverrel.
Emelt Plusz Labirintus
Az EPM esetében az egerek helyét és aktivitását a készülékben ANY-labirintus állatok nyomkövető szoftverével mértük. A nyitott karokban, a zárt karokban és a teljes berendezésben töltött időt és megtett távolságot minden egér esetében meghatároztuk.
Kényszerített úszási teszt
Az FST-t lényegében úgy hajtottuk végre, ahogy arról korábban beszámoltunk (Sachs et al., 2014a). Röviden, az egereket egy 4 literes főzőpohárba tettük, amely körülbelül 2500 ml 25 ° C-os vízzel volt feltöltve, és 6 percig maradtak. Az egyes egerek viselkedését felülről rögzítettük a főzőpohár fölé függesztett kamerával. ANY-labirintus szoftvert használtak az egerek mozdulatlanságának és a mozdulatlan epizódok számának mérésére.
Gén expressziós elemzés
Az FST után egy héttel az egereket méhnyak diszlokációval és lefejezéssel leöltük, majd az agyakat eltávolítottuk és 1 mm vastag szakaszokra osztottuk agymátrix segítségével. Kétoldalas (1,5 mm átmérőjű és 1 mm vastag) szövetlyukasztókat vettünk a hippocampusból [középen kb. 1,0 mm medio-laterális (ML), -2,0 mm elülső és hátsó (AP), -1,7 mm dorso-ventrális (DV középre) ) Bregma-hoz viszonyítva] és azonnal szárazjégre fagyasztva tovább -70 ° C-os fagyasztóba helyezzük a további feldolgozásig. Az RNS-t a bal agyfélteke hippocampusából gyűjtött szövetmintákból izoláltuk az Ambion PureLink RNA Mini Kit segítségével, a gyártó utasításainak megfelelően. Az RNS-t további feldolgozásig -70 ° C-on fagyasztottuk.
A reverz transzkripciókat a Thermo Scientific Maxima First Strand cDNS szintézis készlet segítségével hajtottuk végre, a gyártó utasításainak megfelelően. A valós idejű polimeráz láncreakciót (RT-PCR) az előzőekben leírtak szerint hajtottuk végre (Sachs et al., 2018) a PowerUp Sybr Green Master Mix rt-PCR kit (Applied Biosystems, Foster City, CA, USA) segítségével. a gyártó utasításait. Az alapozó szekvenciákat a PrimerBank (Wang et al., 2012) közül választottuk ki: GAPDH előre: 5'-CATGTTCCAGTATGACTCCACTC-3 '; GAPDH hátramenet: 5′-GGCCTCACCCCATTTGATGT-3 ’; kiegészítő C4A előre: 5′-GATGACAAGAACGTGAGTGTCC-3 '; komplement C4A fordított: 5′-CCCTTTAGCCACCAATTTCAGG-3 ’; IL-1β előre: 5′-TTCAGGCAGGCAGTATCACTC-3 ’; IL-1β fordított: 5′-GAAGGTCCACGGGAAAGACAC-3 ’; IL-6 előre: 5′-TCTATACCACTTCACAAGTCGGA-3 ’; IL-6 hátramenet: 5′-GAATTGCCATTGCACAACTCTTT-3 '; ionizált kalciumkötő adapter molekula 1 (IBA1) előre: 5′-ATCAACAAGCAATTCCTCGATGA-3 ’; IBA1 hátramenet: 5′-CAGCATTCGCTTCAAGGACATA-3 ’; GSK3β előre: 5′-ACAGGCCACAGGAGGTCAGT-3 ’; GSK3β hátramenet: 5′-GATGGCAACCAGTTCTCCAG-3 ′.
Western Blotting
A jobb agyféltekéből származó hippocampus szöveti lyukasztókat a Western-blotoláshoz lényegében az előzőekben leírtak szerint dolgoztuk fel (Sachs et al., 2014b). Röviden, a mintákat jéghideg lízispufferben (1% Triton, 1 mM EDTA, 150 mM NaCl és 20 mM Tris-HCl) lizáltuk proteázzal és foszfatáz inhibitorokkal. Kis mennyiségű alikvotot használtunk a fehérje meghatározásához bicinchonininsav (BCA) vizsgálati készletekkel (Boston Bio Products, Ashland, MA, USA). Az elektroforézis céljából azonos mennyiségű fehérjét töltöttünk a TGX gélekre. A fehérjéket ezután polivinilidén-difluorid (PVDF) membránokra vittük át, és Western-blotot végeztünk a következő antitestek alkalmazásával: nyúl anti-foszforilezett GSK3β (Cell Signaling, # 9323, 1: 300 hígítás), egér anti-totális GSK3β (Cell Signaling, #). 9832, 1: 300 hígítás) és nyúl anti-GAPDH töltés kontrollként (Cell Signaling, # 5174, 1: 300 hígítás).
Statisztikai analízis
A súlygyarapodás érdekében SPSS szoftvert használtak egy háromfaktoros ANOVA elvégzésére, két alany közötti tényezővel (azaz genotípus és diéta) és egy alanyon belüli ismételt mértékű faktorral (azaz idővel). Az összes többi adatot kétirányú ANOVA-val elemeztük genotípussal és étrenddel, mint faktorokkal JMP szoftver segítségével.
Eredmények
Nagy zsírtartalmú étrend okozta súlygyarapodás
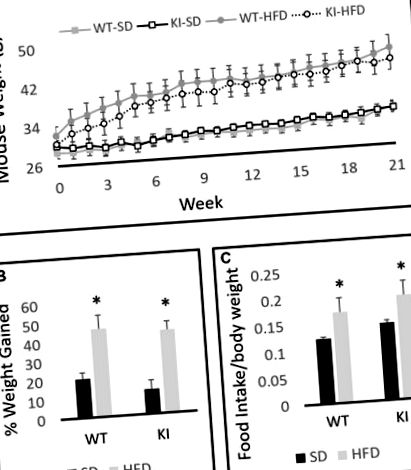
Az alanyok közötti kettő-kettő ANOVA diétával és genotípussal, mint tényezőkkel, kimutatta az étrend szignifikáns hatását a testsúlyra (F (1,30) = 19,6, p, 1A ábra), de a genotípusnak nincs hatása (F (1,30) = 0,001, p = 0,97, 1A. Ábra). A vizsgálati alanyokon belüli ismételt mérések elemzése feltárta az idő jelentős hatását a testtömegre (F (21,10) = 69,2, p 1A ábra), valamint a diéta interakció alapján jelentős időt (F (21,10) = 15,0, p ábra). 1A). A krónikus HFD-expozíció szignifikánsan nagyobb testtömeg-növekedést eredményezett mind a WT, mind a KI állatokban, mint a folyamatos SD-expozíció, de a testtömegben egyetlen időpontban sem figyeltek meg szignifikáns genotípus-különbséget (1A. Ábra). Ahogy az várható volt, a HFD-vel kezelt állatok súlya szignifikánsan nagyobb százalékkal nőtt, mint az SD-vel táplált egerek a kísérlet során (F (1,30) = 34,98, p, 1B ábra). Az SD-t vagy HFD-t fogyasztó WT és KI egerek 24 órás táplálékfogyasztásának összehasonlítása nem mutatott ki szignifikáns genotípus-különbségeket a fogyasztásban, de az egerek lényegesen több HFD-t ettek testtömegenként SD-hez képest (a diéta fő hatása kétirányú ANOVA, F 1,24) = 5,88, p = 0,023, 1C ábra).
A vad típusú (WT) és a knock-in (KI) egerek testtömege standard étrenden (SD) és magas zsírtartalmú étrenden (HFD). (A) Az egyes testcsoportok átlagos testtömegének számszerűsítése az idő múlásával. (B) A testtömeg-növekedés átlagos százalékos arányának kiszámítása a 21 hetes periódusban minden egyes csoport esetében. (C) Átlagos napi táplálékbevitel egerekben SD vagy HFD esetén. Az eredményeket átlagként fejezzük ki, és a hibasávok a standard hibát jelzik. „*” A diéta fő hatását jelzi kétirányú ANOVA segítségével, p 2A ábra) és a mező közepére tett bejegyzések számának csökkentésével (a diéta fő hatása; F (1,35) = 6,29, p = 0,019, 2B. Ábra). Az étrendnek azonban nem volt szignifikáns általános hatása a mozgásszervi aktivitásra (F (1,35) = 1,20, p = 0,28, 2C. Ábra), ami arra utal, hogy a megfigyelt hatások a középpont távolságára és a központba történő bejutások számára nemcsak a csökkent mozgásszervi aktivitás eredménye. A középpontba való bejutás és a középpontbeli távolság csökkenése ellenére a diéta nem gyakorolt jelentős hatást a nyílt mező közepén töltött idő mennyiségére (F (1,35) = 2,86, p = 0,099, 2D ábra ). A genotípus és az étrend kölcsönhatásai között nem figyeltek meg szignifikáns hatást.
Kényszerített úszási teszt
Az FST esetében az étrend vagy a genotípus jelentős fő hatásait nem figyelték meg. Az étrendi interakciók szerint azonban szignifikáns genotípus volt az immobil epizódok száma (F (1,35) = 6,91, p = 0,013, 2I ábra) és a mozdulatlanul töltött idő (F (1,35) = 6,31, p = 0,017, 2J ábra). A post hoc t-tesztek azt mutatták, hogy a HFD az immobil epizódok jelentős csökkenéséhez vezetett a WT egerekben, de a KI állatokban nem volt szignifikáns hatása (2.I ábra). SD-ben az egerekben nem volt szignifikáns genotípus-különbség az FST viselkedésében, de a HFD-vel táplált KI egereknél lényegesen több mozgás nélküli epizód és jelentősen több mozdulatlanul töltött idő volt, mint a HFD-vel táplált WT egereknél (2I, J ábra).
Hippocampal gén expresszió
A HFD szignifikánsan növelte az IL-1β gén hippocampus expresszióját (a diéta fő hatása, F (1,32) = 5,3, p = 0,028, 3A. Ábra), de a genotípusnak nem volt szignifikáns hatása, és kölcsönhatásokat nem figyeltek meg. Ezzel szemben az étrend vagy a genotípus jelentős hatásait és szignifikáns kölcsönhatásokat nem figyeltek meg az IL-6 (3B. Ábra) vagy az IBA1 (3C ábra) expresszió esetében. A génexpressziós elemzés feltárta, hogy a HFD a 4A (C4A) komplement gén hippocampus expressziójának jelentős növekedéséhez vezetett (a diéta fő hatása, F (1,32) = 6,99, p = 0,013, 3D ábra). Ezenkívül a KI egereknél szignifikánsan alacsonyabb a C4A szint, mint a WT egereknél (a genotípus fő hatása, F (1,32) = 4,33, p = 0,046, 3D ábra), de kölcsönhatásokat nem figyeltek meg.
A krónikus HFD hatása a WT és KI egerekre a gyulladással kapcsolatos gének expressziójára a hippocampusban. (A) Az interleukin-1β (IL-1β) hipokampus expressziója. (B) Az interleukin-6 (IL-6) hipokampus expressziója. (C) Az IBA1 hipokampus expressziója. (D) A C4a hipokampus expressziója. Minden adatot GAPDH-ra normalizáltunk. Az eredményeket átlagként fejezzük ki, a hibasávok pedig az átlag standard hibáját jelzik. A „Δ” a genotípus fő hatását, a „*” a diéta fő hatását jelzi kétirányú ANOVA segítségével. N = 9–11 csoportonként.
Hippocampal GSK3β jelzés
A genotípus vagy az étrend jelentős fő hatásait nem figyelték meg a GSK3β foszforilációjára a hippokampuszban. A foszforilezett GSK3β hippokampuszszintjén az étrend-interakcióval szignifikáns genotípust figyeltünk meg az összes GSK3β-hoz viszonyítva (F (1,30) = 4,74, p = 0,0375, 4A. Ábra). A post hoc elemzések azt mutatták, hogy a HFD a GSK3β foszforilációjának jelentős növekedéséhez vezetett WT egerekben, de Tph2KI állatokban nem. Nem figyeltek meg szignifikáns változást a hippocampusban a GSK3β mRNS-szintjén (4B. Ábra).
- 1,3-Dmaa felhasználás, mellékhatások, kölcsönhatások, adagolás és figyelmeztetés
- Az Agaricus gomba előnyei, mellékhatásai, adagolása, kölcsönhatásai
- Avandia (roziglitazon) alapjai, mellékhatások; Vélemények
- A kék-zöld algák felhasználása, mellékhatásai, kölcsönhatásai, adagolása és figyelmeztetés
- Az áfonya mellékhatásainak 7 egészségügyi előnye - SelfHacked