Az akut vesekárosodás előfordulása és kockázati tényezői traumás betegek körében: egy többközpontú kohorsz vizsgálat
- A cikkhez írt levél a Critical Care 2019 23: 35-ben jelent meg
Absztrakt
Háttér
A szervi elégtelenség, beleértve az akut vesekárosodást (AKI), a harmadik halálozási ok vérzés és agysérülés után traumás betegeknél. Arra törekedtünk, hogy felmérjük az AKI prevalenciáját, rizikófaktorait és hatását a trauma utáni eredményre.
Mód
Retrospektív elemzést végeztünk a multicentrikus traumaregiszter prospektív módon összegyűjtött adatairól. Az AKI-t csak a szérum kreatinin alapján határozták meg a kockázat, a sérülés, a kudarc, a vesefunkció csökkenése és a végstádiumú vesebetegség (RIFLE) besorolása alapján. Az AKI előtti kórházi és korai kórházi kockázati tényezőket logisztikai regresszióanalízissel azonosítottuk. A prediktív modelleket belsőleg validálták bootstrapping resampling technikával.
Eredmények
3111 beteget vontunk be az elemzésbe. Az AKI incidenciája 13% volt, beleértve 7% R stádiumot, 3,7% I. stádiumot és 2,3% F. stádiumot. Az AKI incidenciája 42,5% -ra emelkedett a vérzéses sokkban szenvedő betegeknél; Az AKI 96% -a a traumát követő 5 napon belül fordult elő. A többváltozós elemzés során a prehospital változók, beleértve a minimális prehospital átlagos artériás nyomást, a maximális prehospitalis pulzusszámot, a másodlagos transzfert a traumaközpontba és a kórházi felvétel után korán összegyűjtött adatokat, beleértve a sérülés súlyosságát, a vesetraumát, a vér laktátját és a hemorrhagiás sokkot, független kockázati tényezők voltak a az AKI-t jósoló modellek. A modell jól megkülönböztette a vevő működési jelleggörbéje alatti területet: 0,85 (0,82–0,88) az AKI I. vagy F stádiumának megjóslásához, és 0,80 (0,77–0,83) az összes stádium AKI-jának előrejelzéséhez. A kreatin-kináz-csúcs alapján értékelt rhabdomyolysis súlyossága az AKI további független kockázati tényezője volt, amikor 1000 U/ml lépésenként modellbe kényszerítették (OR 1,041 (1,015–1,069)., o
Háttér
A szervi diszfunkció a vérzés és a traumás agysérülés után továbbra is a harmadik fő halálok a traumás betegeknél [1]. A traumát követő szervi elégtelenségek között az AKI gyakori, jelentett incidenciája akár 50% is lehet, és függetlenül összefügg a kórház hosszabb tartózkodási idejével és a halálozással [2, 3].
A súlyos trauma kiváltja az AKI kezdeti kockázati tényezõit, beleértve a vérzést, a rabdomiolízist, a traumás gyulladást, és második találathoz vezet a sürgõs mûtétek vagy olyan fertõzések miatt, amelyek további vesebetegségeket okozhatnak, amelyek vesefunkció károsodást eredményezhetnek. A traumát követő AKI kockázati tényezők azonosítása elengedhetetlen az AKI és az azzal összefüggő szövődmények megelőzésére irányuló stratégia kialakításához. Korábbi tanulmányok, amelyek a traumát követő AKI incidenciáról számoltak be, az anamnézisre [4, 5], a hemodinamikai változókra [6, 7], a trauma típusára [8] vagy a rabdomyolysisre [9], mint az AKI lehetséges kockázati tényezőire összpontosítottak, de mindegyiküket figyelembe véve adjon teljesebb áttekintést a veseelégtelenséghez társuló vese agresszióról. Sőt, a kórház előtti időszakot alig veszik figyelembe, mégis ez egy olyan időszak, amikor valószínűleg vese agresszió lép fel (azaz hipotenzió, hipoxémia). Ezenkívül a legtöbb vizsgálatban azokat a betegeket vonták be, akik traumát követően kerültek az intenzív osztályra (ICU), majd kiválasztották azokat, akik a legsúlyosabban sérültek, annak ellenére, hogy figyelmet kell fordítani a közepesen sérült betegekre is.
Ennek a tanulmánynak a célkitűzései az alábbiak voltak: (1) az AKI prevalenciájának jelentése, (2) az AKI-val kapcsolatos kockázati tényezők leírása és (3) annak feltárása, hogy az AKI függetlenül összefügg-e a halálozással egy traumás betegek multicentrikus kohorszában, amelyek jellemzői és fiziológiai jellemzői a változókat prospektív módon gyűjtik egy kutatási nyilvántartásba.
Mód
Retrospektív multicentrikus megfigyelési tanulmányt végeztünk három francia regionális 1. szintű kijelölt traumaközpontban 2011. májusa és 2014. júliusa között. A három traumaközpont fokozatosan csatlakozott a TraumaBase nyilvántartáshoz 2011 és 2012 között (http://www.traumabase.eu/fr_FR ). Az ebbe a három központba felvett minden beteg klinikai, biológiai és anamnéziás adatait prospektív módon gyűjtötték az adatbázisba. A TraumaBase® csoport jóváhagyást kapott ehhez a tanulmányhoz, ideértve az intézményi felülvizsgálati testület (Comité pour la Protection des Personnes, Párizs VI-Pitié-Salpêtrière, Franciaország) lemondását. Az adatbázist jóváhagyta az egészségkutatás információfeldolgozásával foglalkozó tanácsadó bizottság (Comité Consultatif sur le Traitement de l'Information en matière de Recherche dans le Domaine de la Santé, CCTIRS 11.305 bis) és a Francia Számítástechnikai és Szabadságbizottság ( Commission Nationale Informatique et Liberté, CNIL 911461).
Vizsgálati populáció
Az összes 16 évesnél idősebb traumás beteget felvették a három részt vevő központba elsődleges vagy másodlagos (egy másik létesítményből 48 órán belül a trauma után) transzportként. A Beaujon, a Pitié-Salpêtrière és a Bicêtre Egyetemi Kórházak három traumaközpont a párizsi régióban. A párizsi régióban súlyos traumával küzdő betegek (12 millió lakos) megközelítőleg 60% -át kezelik. A párizsi sürgősségi orvosi rendszert és a traumakezelést máshol írták le [10]. A súlyos traumával gyanús betegeket (legalább egy Vittel triage kritérium jelenléte szerint, amelyet az orvos a helyszínen értékel, lásd az 1. kiegészítő aktát) közvetlenül vesznek részt az ICU-ban a résztvevő traumaközpontok bármelyikében. Nyilvántartásaink azt mutatják, hogy a súlyos traumával gyanús betegek ICU-ba történő szisztematikus befogadása enyhe vagy közepesen súlyos sérülésekkel rendelkező betegek egy alcsoportját foglalja magában, akik általában nem vesznek részt az AKI traumával kapcsolatos tanulmányokban [11].
A TraumaBase nyilvántartásba beletartoztak a tanulmányi központokba felvett összes beteg. Az adatokat manuálisan vezetik be a dedikált kutató szakemberek. A következetesség és a koherencia algoritmusai beépülnek az adatbázis struktúrájába. A nyilvántartásban történő adatgyűjtést megelőzően 35 változóból álló alapadatkészletet hoztak létre, amelynek adatgyűjtését kötelezőnek tekintik. Az adatok teljességét minden központban ellenőrizték és rendszeresen ellenőrizték. Az adatfigyelést központi adminisztrátor végzi.
Az adatbázisban a vérzéses sokkot úgy határozzuk meg, hogy az első 6 órában legalább négy egység csomagolt vörösvértestet (RBC) transzfúzióval kezelünk [14, 15]. A traumás agysérülést (TBI) legalább egy traumatikus elváltozás határozza meg a kezdeti agyi CT-vizsgálat során.
A vesefunkció értékelése
A vesefunkciót a szérum kreatinin-variációkkal értékelték a kockázat, a sérülés, a kudarc, a veszteség, a vesebetegség végstádiumának (RIFLE) [16] osztályozása szerint, és a nyilvántartásba az ICU-tartózkodás legrosszabb RIFLE-szakaszát rögzítették. A vese működéséről nem gyűjtöttek adatokat az ICU-ból történő kiürítést követően. A traumás betegek kiindulási kreatinin-mérése ritkán áll rendelkezésre, ezért a referenciát választottuk a plazma kreatinin legalacsonyabb értékeként a kórházi kezelés első 5 napja alatt [17,18,19,20]. Ez a módszertan a közelmúltban pontosabbnak bizonyult, mint a módosított étrend a vesebetegségben (MDRD) képlet alapján visszakalkulált kreatininérték a glomeruláris szűrési sebességhez 75 ml ∙ perc - 1/1,73 m 2 fiatal traumák populációjában. betegek [20]. Meghatároztuk a korai AKI-t, mint AKI-t, amely a felvétel után az első 5 napban fordul elő, és a késői AKI-t, mint AKI-t, amely 5 nap elteltével fordul elő [4].
Statisztikai analízis
A kvantitatív változókat átlagként (SD) vagy mediánként (25. – 75. Interkvartilis) fejeztük ki eloszlásuk szerint, a kategorikus változókat pedig számokkal (arányok) fejeztük ki. Az egyes AKI súlyossági stádiumok előfordulását az egész kohorszban és három, a szakirodalomban általánosan ismertetett alpopulációban jelentették: (1) súlyosan sérült betegek, akiknél ISS ≥ 16 volt [21], (2) traumás betegek, akiknél egynél több csomagolt vörösvértestre volt szükség koncentrálni az ICU-tartózkodásuk alatt [22, 23] és (3) vérzéses sokkban szenvedő traumás betegek [24]. A következő lépésben létrehoztunk egy bináris kimeneti változót, amelynek értéke 0 volt, amikor AKI nem volt, vagy értéke 1, amikor AKI R, I vagy F stádium volt. Létrehoztunk egy bináris kimeneti változót is, amelynek vagy 0 értéke, amikor nem volt AKI vagy AKI R stádium, vagy 1 értéke, amikor AKI I. vagy F. stádium volt. Ez arra a tényre támaszkodik, hogy az AKI R stádium többnyire a traumát követő első 24 órán belül jelentkezik, ami a prediktív modellt eredményezi az AKI R stádium esetében kronológiai szempontból kevésbé releváns, ha 6 órás transzfúziót igénylő kockázati tényezőket vesznek figyelembe (vérzéses sokk).
Az AKI I. vagy F stádiumának (vagy az AKI minden szakaszának) kockázati tényezőit egyváltozós elemzéssel értékelték (t teszt a Gauss-változókra, a chi-négyzet teszt az arányokra és a Mann Whitney-teszt a nem normálisan elosztott változókra). Az egyváltozós elemzés során kiválasztottuk azokat a tényezőket, amelyek jelentősen összefüggenek az AKI-vel (o 0,8). Ha a változók korreláltak, akkor a klinikai/fiziológiai szempontból a legmegfelelőbbet választottuk. A jelölt változókat egy visszamenőleges szelekciós modell segítségével lépésenként többváltozós logisztikai regresszióba vittük be. A prediktív modell teljesítményének jobb megítélése érdekében bootstrapping (10 000 újramintavétel) elemzést alkalmaztunk a páratlan arányok (OR) és a 95% -os konfidencia intervallumok (CI) megbecsülésére. Belső validációként a rendszerindítás robusztus becsléseket nyújt alacsony torzítással az optimizmus és a túlillesztés kezelésével [26, 27]. A modell kalibrálását a Hosmer-Lemeshow statisztika és a megkülönböztetés segítségével értékeltük a vevő működési jelleggörbéje (AUC-ROC) alatti terület jelentésével. Az elsőrendű kölcsönhatásokat vizsgálták.
A CK csúcs nem szerepelt a prediktív többváltozós modellekben, mert ez egy késői változó, amely nem releváns az AKI előrejelzésében. A rhabdomyolysis súlyosságának markerként azonban bekerült egy második többváltozós elemzésbe annak feltárására, hogy a rhabdomyolysis függetlenül kapcsolódott-e az AKI-hoz vagy sem.
ROC görbéket építettünk az AKI-hez társított változók különböző küszöbértékeihez. Szenzitivitást, specificitást, pozitív és negatív prediktív értékeket (PPV és NPV), pozitív és negatív valószínűségi arányokat (PLR és NLR) és az AUC-ROC kiszámítását számoltuk be minden változóra. A legjobb küszöbértéket úgy határoztuk meg, hogy maximalizálja a Youden-indexet (érzékenység + specifitás - 1). Az AKI és az ICU mortalitás összefüggésének vizsgálatához az AKI faktort egyváltozós elemzés során egy lépésenkénti logisztikai regressziós modellbe vonták be, az eredményhez (halálhoz) kapcsolódó egyéb tényezőkkel együtt. A hiányzó adatokat nem pótolták, és csak a teljes esetek kerültek be a többváltozós modellekbe. Az egyes modelleknél a hiányzó adatok arányát és a hiányzó adatok jellemzőit jelentették. A szignifikancia kétoldalas szintjét 5% -ban rögzítettük. Az eredményeket az R nyílt forráskódú 3.1.1 szoftver segítségével elemeztük (https://www.r-project.org/) (The R Foundation for Statistics Computing, Bécs, Ausztria).
A minta méretének kiszámítása
A súlyos AKI (I. vagy F stádium) prevalenciája változó a traumás betegek kohortjában, a jelentett százalékarány 1 és 26% között mozog [2,3,4,5,6, 9, 17, 18]. Ráadásul kutatási adatbázisunkban nincs becslés az AKI prevalenciáról. Ez kizárja annak a mintaméretnek a kiszámítását, amely pontosan megadná a korábban közzétett szabályok (legalább 100 esemény) alapján megállapított események szükséges számát a kockázat előrejelzési modellek felépítéséhez [27]. Ezért felvettük az adatbázisban a vizsgált időszakban rendelkezésre álló összes beteget (n = 3111), ezáltal elvárva, hogy megbízható becsléseket nyújtson olyan súlyos AKI prevalencia esetén is, amely mindössze 3%.
Eredmények
Adatbázisunkban 3488 traumás beteget regisztráltunk 2011 júniusától 2014 júliusáig. A vesefunkcióra vonatkozó adatok 3111 beteg esetében álltak rendelkezésre. A 377 kizárt páciens jellemzőit a 2. kiegészítő fájlban közöljük. A teljes kohorsz jellemzőit az 1. táblázat mutatja be. A traumabetegek fiatalok voltak, 38 (18) évesek, az átlagos ISS 14 (9–25) volt, és túlnyomórészt tompa trauma (91%): a TBI-ben szenvedő betegek 31% -a. Vérzéses sokkot jelentettek a betegek 11,4% -ánál. Az összes halálozás 10,8% volt.
Az AKI előfordulása
Az AKI prevalenciája a teljes populációban 13% (CI 11,8–14,2) volt, beleértve az R stádiumú betegek 7% -át (CI 6,1–7,9), az I. stádiumú betegek 3,7% -át (CI 3,0–4,4) és 2,3% -át (CI) 1,7–2,8) az F stádiummal (2. táblázat). Az AKI előfordulása 20,9% -ra, 28,3% -ra és 42,5% -ra emelkedett a 16-os ISS-t meghaladó traumás betegek alcsoportjaiban, legalább egy egység csomagolt vörösvérsejt-koncentrátumot kapó betegeknél és hemorrhagiás sokkban szenvedő betegeknél (2. táblázat) . Az AKI korán jelentkezett, a kreatinin-csúcs medián késése nem haladta meg a 2 napot (3. táblázat): az AKI-ban szenvedő betegek 96% -a (n = 388) korai AKI volt, mivel a traumát követő 5 napon belül elérték a kreatinin csúcsot, míg az AKI-ban szenvedő betegek 4% -a (n = 17) késői AKI volt (8 AKI R stádiumú és 9 AK F fázisú beteg), és 5 nap múlva érte el a kreatinin csúcsot. Vesepótló kezelést 49 betegnél alkalmaztak (1,6%).
Az AKI-ban szenvedő traumás betegek jellemzői
A korai AKI-ben szenvedő betegek súlyosabb betegek voltak, mint AKI vagy R-stádiumú AKI nélküli betegek, amit a rosszabb hemodinamikai változók, a súlyosabb TBI (kezdeti GCS) és több vértermék-transzfúzió tükröz (1. táblázat, 3. kiegészítő fájl). Az egyváltozós elemzés során a súlyos AKI-hez kapcsolódó változók között a kollináris változók a TBI, a kezdeti GCS, valamint a minimális kórház előtti MAP és SAP voltak. A kezdeti GCS és a minimális MAP megmaradt a végső elemzéshez. A többváltozós modellbe 2345 beteget vontak be (a hiányzó értékek miatt 766 beteget kizártunk, akiknek jellemzőit a 2. kiegészítő fájlban közöljük). A következő tényezők társultak az AKI I. vagy F stádiumához (4. táblázat): hemorrhagiás sokk jelenléte, vérlaktát, minimális prehospitalis MAP, maximális prehospitalis pulzus, ISS és másodlagos transzfer traumaközpontba. A modell AUC-ROC értéke 0,85 (0,82–0,88). Ugyanazokat a prediktorokat választották ki az AKI-t előrejelző összes modellben (R, I vagy F), kivéve a maximális prehospitalis szívritmust, amelyet a végső modell nem tartott meg, és a vese traumát, amelyet a végső modellbe bevontak (3. kiegészítő fájl). Ez utóbbi modell AUC-ROC értéke 0,80 (0,77–0,83). Jelentős interakció nem volt.
Rhabdomyolysis és AKI
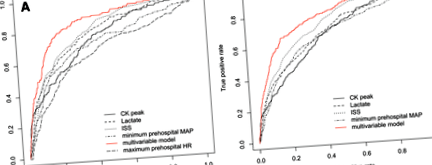
A CK-csúcs 1382 betegnél volt elérhető (a hiányzó értékek miatt 963 beteget kizártunk, akiknek jellemzőiről a 2. kiegészítő fájlban számolunk be). Az AKI vagy R stádiumú AKI nélküli betegeknél a CK csúcsérték elérte a 1052 U/L-t (403–2897), míg az AKI I vagy F stádiumú betegeknél a 3942 U/L-t (1481–11 338).o 1. ábra
a A vevő működési jellemzőinek (ROC) görbéi az akut vesekárosodás (AKI) (I. vagy F stádium) előrejelzésére, sérülés súlyossági pontszámával (ISS) (AUC = 0,79 (0,75–0,83)), vérlaktáttal (AUC = 0,77 (0,73–0,81) )), A kreatin-kináz (CK) csúcsa (AUC = 0,73 (0,69–0,78)), a kórház előtti minimális artériás nyomás (MAP) (AUC = 0,70 (0,65–0,75)) és a maximális prehospitalis pulzus (HR) (AUC = 0,66) (0,61–0,71)). A többváltozós modell a következő változókat tartalmazza: hemorrhagiás sokk jelenléte, vérlaktát, minimális prehospitalis MAP, maximális prehospitalis pulzus, ISS és másodlagos transzfer traumaközpontba (4. táblázat). A többváltozós modell AUC-ROC értéke 0,85 (0,82–0,88). b ROC görbék az AKI (R, I vagy F stádium) ISS-sel (AUC = 0,76 (0,73–0,78)), vérlaktáttal (AUC = 0,70 (0,67–0,73)), CK-csúcs (AUC = 0,68 (0,65–0,71)) előrejelzésére )), minimális kórház előtti MAP (AUC = 0,68 (0,65–0,71)). A többváltozós modell a következő változókat tartalmazza: vérzéses sokk jelenléte, vérlaktát, minimális kórház előtti MAP, ISS, másodlagos átvitel traumaközpontba és súlyos vesetrauma (3. kiegészítő fájl). A többváltozós modell AUC-ROC értéke 0,80 (0,78–0,83)
AKI és kimenetel trauma után
Egy lépésenkénti logisztikai regressziós modellben az AKI függetlenül társult az ICU mortalitásának kétszeres növekedésével (OR = 2,321 (1,389–3,85) az AKI I. vagy F stádiumában (o = 0,001) és OR = 1,943 (1,300–2,890) az AKI R, I vagy F szakaszában (o = 0,001)) (6. kiegészítő fájl).
Vita
Ebben a 3 éves multicentrikus megfigyeléses vizsgálatban azt találtuk, hogy az AKI a traumás betegek 13% -ában fordult elő, de ez vérzéses sokkban szenvedő betegeknél akár 42% -kal is növekedett. Másodszor azt is megállapítottuk, hogy az AKI korán jelentkezett, az AKI 96% -át a traumás sérülést követő első 5 napon belül diagnosztizálták. Harmadszor, az AKI-t előrejelző modell jól teljesített, és korai kockázati tényezőket szolgáltatott az AKI számára, amelyek a hipoperfúzió és az anyagcsere-agresszió markerei (befogadó laktátérték, vérzéses sokk, minimális kórház előtti MAP és maximális kórház előtti pulzusszám), sérülés súlyossága (ISS), vesetrauma és késleltetett felvétel. Negyedszer, a rabdomiolysis súlyossága (CK-csúcs) az AKI további független kockázati tényezője volt. Ötödször, az AKI függetlenül társult az ICU-mortalitás fokozott kockázatával. Tudomásunk szerint ez a traumás betegek legnagyobb multicentrikus kohorsza, amelyben az AKI rizikófaktorokat értékelték. Először a felvételkor korán gyűjtött kórházi változókkal együtt beszámolunk a kórház előtti változókról, hogy megjósoljuk az AKI előfordulását a trauma után. Ez annál is inkább releváns, hogy az AKI a traumát követően korán jelentkezik, ezért korai előrejelzését szorgalmazza az AKI megelőzését célzó közvetlen kezelésre.
Ami az AKI előrejelzést illeti, az AKI-hoz társított változók egyike sem teljesített kielégítően az AKI I. vagy F. stádiumának előfordulásának egyénileg történő megkülönböztetésére. Azonban a kórház előtti és korai kórházi változók alkalmazásával logisztikai regressziós modellünk jól teljesítette az AKI I. vagy F stádiumának megjóslását egy AUC-ROC 0,85. Az AKI modellje az összes szakaszban (R, I vagy F) rosszabbul teljesített, az AUC-ROC értéke 0,80 volt. Ehhez képest egy jól lefolytatott vizsgálatban Haines és mtsai. a közelmúltban kórházi változók segítségével építettek egy modellt, amely jósolta a 2. vagy 3. stádiumú AKI-t (vesebetegség javító globális kimenetel (KDIGO) besorolása) traumás betegeknél, AUC-értéke 0,81, míg az AKI-t előrejelző modelljük összes szakaszának AUC-értéke 0,77 [35 ]. További AKI kockázati tényezők, például AKI biomarkerek vagy plazma gyulladásos markerek figyelembe vétele segíthet az AKI előrejelzésének javításában a jövőbeni tanulmányokban.
Számos vizsgálat hangsúlyozta, hogy az AKI függetlenül kapcsolódik az ICU-betegek [41] vagy traumás betegek [3,4,5, 17, 42] káros klinikai kimeneteléhez. Jelen tanulmányban az AKI függetlenül társult a halálozáshoz, még a traumák súlyosságára vonatkozó standard pontszámokat is figyelembe véve, mint a TRISS. Így a veseelégtelenség további jelzője a magas halálozási kockázatnak a traumás betegeknél.
Következtetés
Az AKI korai kezdetű és függetlenül összefügg a traumás betegek halálozásával. Előfordulása 3-szoros mértékben változik a sérülések súlyosságától és a vérzésektől függően. Az előzetes kórház és a kórházi felvétel után korán gyűjtött adatok a kockázati tényezőkről hatékonyak lehetnek a traumát követő AKI korai előrejelzésében. Ezért az AKI megelőzését célzó vizsgálatoknak azokat a betegeket kell megcélozniuk, akiknek magas az AKI kockázata, és a traumakezelés korai szakaszában meg kell vizsgálni a terápiákat.
- A Giardia lamblia fertőzés prevalenciája és a kapcsolódó rizikófaktorok kórházban fekvő gyermekek körében
- A túlsúly, az elhízás, a hasi elhízás és az elhízással kapcsolatos kockázati tényezők elterjedtsége délen
- A székrekedés prevalenciája és kockázati tényezői Moszkva felnőtt lakosságában (
- Az alsúly, a túlsúly és az elhízás előfordulása és a hozzájuk kapcsolódó kockázati tényezők nepáli nyelven
- Az akut hemorrhagiás végbélfekély-szindróma és annak prognózisa kockázati tényezői A sűrűség-esetek ellenőrzése