Az alkoholos májbetegség legújabb fejleményei II. Minikérdés: az alkoholos zsírmáj molekuláris mechanizmusai
Orvostudományi osztályok, Indiana Egyetem Orvostudományi Kar és Richard Roudebush Veterán Ügyek Orvosi Központja, Indianapolis, Indiana 46202
Orvostudományi osztályok, Indiana Egyetem Orvostudományi Kar és Richard Roudebush Veterán Ügyek Orvosi Központja, Indianapolis, Indiana 46202
Absztrakt
Régóta úgy gondolják, hogy az alkohol a májban megváltoztatott NADH/NAD + redoxpotenciál révén zsírmájat okoz, ami viszont gátolja a zsírsav oxidációt és a trikarbonsav ciklusreakciók aktivitását. Újabb tanulmányok azt mutatják, hogy az etanol további hatásai károsítják a zsír oxidációját és serkentik a lipogenezist. Az etanol megzavarja a peroxiszóma proliferátorral aktivált receptor-α (PPARα) DNS-kötő és transzkripciót aktiváló tulajdonságait, amint ezt tenyésztett sejtek és etanollal táplált egerek mutatják. Az etanollal táplált egerek PPARa agonistával történő kezelése még a folyamatos etanolfogyasztás ellenére is megfordíthatja a zsírmájat. Az etanol aktiválta a szterin szabályozó elemet megkötő 1 fehérjét is, indukálva egy mennyiségű lipogén enzimet. Ezek a hatások részben az AMP-függő protein-kináz gátlásának, a plazma adiponektin csökkenésének vagy a májban a TNF-α szintjének emelkedésének köszönhetők. Ezeknek az etanolhatásoknak a megértése új terápiás célpontokat nyújt az alkoholos zsírmáj visszafordításához.
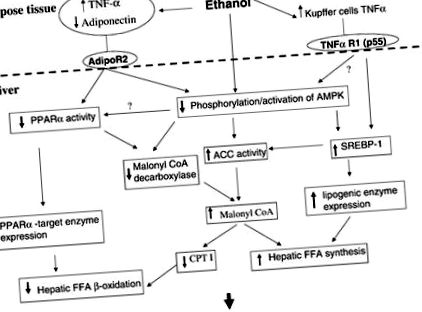
1. ábra.Az alkoholos zsírmáj mögött álló potenciális mechanizmusok. Az etanol közvetlenül vagy az adiponektinre és a TNF-α-ra gyakorolt hatás révén befolyásolhatja a peroxiszóma-proliferátor-aktivált receptor-α (PPARα), a szterin-szabályozó elemet kötő 1-es fehérje (SREBP-1) és az AMP-függő protein-kináz (AMPK) aktivitását. . Ezek a hatások viszont aktiválják a lipogén útvonalakat, gátolják a zsírsav oxidációs útvonalakat, és növelik a malonil-CoA koncentrációját. A malonil-CoA gátolja a szabad zsírsav (FFA) bejutását a mitokondriumba, és blokkolja a mitokondrium zsírsav oxidációját. CPT I, karnitin-palmitoil-transzferáz; ACC, acetil-CoA karboxiláz; AdipoR2, adiponektin receptor 2; TNF-a R1, TNF-a receptor 1.
Az alkoholfogyasztás után a májban a zsírsavszint jelentősen megnő; ezért azt lehetne megjósolni, hogy a PPARα által vezérelt zsírmetabolizáló enzimek akkumulátorát az alkoholfogyasztás indukálja. Míg a PPARα-érzékeny gének egy részhalmazáról számoltak be, hogy etanol, például citokróm indukálja P-450 4A1 (lauril-ω-hidroxiláz) és a máj zsírsavat megkötő fehérje, sok más nem változott, sőt csökkent; például a közepes láncú acil-CoA dehidrogenáz aktivitást és az mRNS szintjét etanolos etetéssel csökkentették. A dikarbonsav-zsírsavak fokozott termelésének a lauril-ω-hidroxiláz aktivitás és az etanol acil-CoA-oxidáz-indukálásának elmulasztása, amely a peroxiszomális β-oxidáció első lépcsője, fiziológiai eredménye a vizeletből származó dikarbonsav-zsírsavak fokozott kiválasztása az alkohol- táplált patkányok és alkoholista férfiak. Tehát úgy tűnik, hogy az alkohollal táplált állatokban a zsírsavat metabolizáló gének teljes indukciójának sikertelensége hozzájárulhat a zsírmáj kialakulásához.
Talán a legfontosabb kérdések maradtak: mi közvetíti az etanol hatását ezekre a transzkripciós tényezőkre? Hatással van-e az etanol egy központi szabályozó rendszerre, amely mind a PPARα csökkenéséért, mind az SREBP-1 aktivitás növekedéséért felelős, vagy ezek az etanol független tevékenységeinek eredményei? Vajon a zsírmáj megelőzése - akár folyamatos alkoholfogyasztás mellett is - megakadályozná az alkoholos májkárosodás súlyosabb szövődményeit? A közelmúltban számos új vezető jelent meg ezekre a kérdésekre. A jelentések szerint az etanol csökkenti az adiponektin, a zsírszövetben előállított hormon vérszintjét, amely a jelentések szerint aktiválja a PPARα-t és az AMP-függő protein-kinázt (AMPK), és gátolja az SREBP-1-et. Továbbá arról számoltak be, hogy az AMPK csökkenti az SREBP-1 expresszióját és gátolja az acetil-CoA karboxilázt (ACC). Ez utóbbi hatás csökkenti a malonil-CoA szintjét és növeli a zsíros acil-CoA belépési sebességét a mitokondriumba. Ez az áttekintés feltárja az etanol kölcsönhatásait a máj zsíranyagcseréjének ezen szabályozóival és a zsírmáj farmakológiai beavatkozással történő szabályozásának lehetőségét.
Az etanol gátolta a PPARα transzkripciós aktiváló és DNS-kötő képességét, valamint annak ligandumokra (klofibrát, WY14 643) adott válaszát hepatoma sejtekben vagy hepatociták primer tenyészeteiben, sejtekben, amelyek képesek oxidálni az etanolt (7). Ez a hatás nem volt megfigyelhető azokban a sejtekben, amelyekben nincs alkohol-dehidrogenáz (ADH), ami arra utal, hogy az etanol metabolizmusa szükséges ehhez a hatáshoz. Ennek a hipotézisnek további alátámasztása szolgált azzal, hogy megmutatta, hogy az ADH-gátló 4-metil-pirazol megszüntette az etanol hatását, és az aldehid-dehidrogenáz (ALDH) inhibitor cianamid növelte. A sejtek acetaldehiddel (50–200 μM) történő inkubálása csökkentette a nukleáris kivonatokban lévő PPARα DNS-kötő képességét is. Így valószínűleg az acetaldehid felelős az etanol hatásáért. Az etanol nem befolyásolta számos más nukleáris receptor (hepatocita 4-es nukleáris faktor, apolipoprotein AI szabályozó fehérje-1 és csirke ovalbumin felfelé irányuló promoter-transzkripciós faktor) aktivitását (7), ami arra utal, hogy ez sem az acetaldehid nem specifikus toxicitása, sem nem a nukleáris receptorok által megosztott downstream jelátviteli utakon.
Annak megállapítására, hogy az etanol ezen hatása in vivo is jelentkezik-e, krónikus etanol-etetési vizsgálatokat végeztek (6). Négy hetes etanolos táplálás szövettani és biokémiai zsírfelhalmozódást eredményezett. A PPARα fehérje szintje viszonylag változatlan volt, míg az RXRα szintje lényegesen csökkent. Ez tükrözheti a megnövekedett portális véna endotoxin hatását, mert beszámoltak arról, hogy az endotoxinra reagálva csökkent a máj RXRα értéke (3). A PPARα/RXR konszenzusszekvenciához való kötődése szintén jelentősen csökkent (6). A PPAR által kontrollált génakkumulátorok közül a közepes láncú acil-CoA dehidrogenáz mRNS-je 40% -kal csökkent, de az acil-CoA-oxidázt, a CPT I-t, a nagyon hosszú láncú acil-CoA szintetázt és a nagyon hosszú az acil-CoA dehidrogenáz lánc változatlan volt az etanolos táplálási protokoll szerint. Amint mások beszámoltak róla, a máj zsírsavat megkötő fehérjét etanollal történő etetés indukálta.
Az állatok csak a WY14 643 PPARα agonistával történő kezelése a kísérlet utolsó 2 hétében a PPARα fehérje ~ 1,5-szeres indukcióját eredményezte, nem változott az RXRα szint, háromszorosára nőtt a PPARα/RXR kötődése konszenzusához Számos PPARα célgén DNS-szekvenciája és mRNS-szintje (hosszú láncú acil-CoA dehidrogenáz, közepes láncú acil-CoA dehidrogenáz, acil-koA oxidáz, nagyon hosszú láncú acil-CoA szintetáz és zsírsavkötő fehérje) jelentősen magasabb, mint az etanollal kezelt egerekben.
Az állatok WY14 643 kezelése az utolsó 2 hét etanollal történő etetése során növelte a PPARa fehérje szintjét és a DNS megkötésére való képességét. Ez a PPARα célgének mRNS-szintjét is indukálta, és ez összefüggésben volt a magasabb zsírsav-β-oxidáció, a szérum FFA- és trigliceridszint normalizálódásával, valamint a májban a zsír felhalmozódásának megfordulásával. Nyilvánvaló, hogy az enzimek PPARα akkumulátorának hiányos aktiválása az etanolfogyasztás során hozzájárul az alkohol okozta zsírmáj kialakulásához (6).
A zsírsav-oxidációt nem kizárólag a β-oxidációs enzimek aktivitása szabályozza. A zsírsav-acil-CoA bejutását a mitokondriumba a malonil-CoA szintje szabályozza, amely a CPT I alloszterikus szabályozója. A malonil-CoA-t az ACC szintetizálja, és az MCD lebontja. A PPARα szerepe a malonil-CoA szint szabályozásában szerepet játszó enzimek expressziójának és aktivitásának szabályozásában nemrégiben figyelemre méltó. A PPARa (-/-) egerek szívében a zsírsav oxidációjának csökkenő sebessége a malonil-CoA magasabb koncentrációival, valamint az MCD csökkent expressziójával és aktivitásával járt, ami arra utal, hogy a PPARα transzkripciós úton szabályozhatja az MCD expresszióját (4). A PPARα aktiváció (WY14, 643), de nem a PPARγ aktiváció (troglitazon által), növelte az MCD mRNS expresszióját és aktivitását a szív- és vázizmokban (24). További vizsgálatok kimutatták, hogy az MCD promotere 17-szer aktiválódott a PPARα/RXRα expressziós plazmidokkal együtt transzfektált sejtekben, és az MCD mRNS szintje a hepatoma sejtekben és a fenofibráttal táplált patkányok májában is megnőtt (12). Így a PPARα funkció gátlása etanollal valószínűleg a malonil-CoA megnövekedését és a mitokondriumba történő zsírsav bejutás gátlását is eredményezné.
Továbbá megvizsgáltuk az etanol SREBP-1-re gyakorolt hatását in vivo standard folyékony étrend, páros táplálási protokoll alkalmazásával. Az egerek zsírtartalmú étrendjének (4% sáfrányolaj, 6% kakaóvaj és 72% magas szénhidráttartalmú) etanollal (az összes kalória 27,5% -ával) történő táplálása 4 héten át zsíros májfejlődéshez vezetett. Az érett SREBP-1 fehérje mennyiségének jelentős növekedését találták az etanollal táplált egerek májában. Ezenkívül az etanollal történő táplálás megnövelte számos ismert SREBP-1 cél máj lipogén gén expresszióját, beleértve a zsírsav szintetázt (FAS), a szteroil-CoA deszaturázt, az almas enzimet, ATP citrát liázt és az ACC-t, ami azt jelzi, hogy az SREBP-1 etanollal közvetített indukciója az érés összefüggésbe hozható e gének expressziójának növekedésével (23). Megállapításunkkal összhangban Ji és Kaplowitz (9) arról számolt be, hogy az egerek magas zsírtartalmú étrendet (15,7% szénhidrát, 25% fehérje, 35% kukoricaolaj) etettek etanollal (24,3%) 6 héten keresztül az intragasztrikus infúziós modell alkalmazásával. SREBP-1 mRNS 6 hét felett és növelte az SREBP-1 fehérje érett formáját. Ezek a vizsgálatok együttesen azt sugallják, hogy az etanol-anyagcsere termékei a máj SREBP-1 aktiválásával növelhetik a máj lipogenezisét.
Az AMPK a metabolikus mester kapcsolóként jelenik meg, amely szabályozza a máj triglicerid és koleszterin szintézisének útjait. Foszforilálja és gátolja a lipid metabolizmusban részt vevő enzimeket, például a 3-hidroxi-3-metil-glutamát-CoA reduktázt és az ACC-t. Az ACC-t általában a zsírsav-bioszintézisben sebességkorlátozó enzimnek tekintik, és amint arról tárgyaltunk, terméke, a malonil-CoA, a CPT I. erős inhibitora. Az AMPK az ACC inaktiválásáért felelős fő kináz, és a közelmúltban az Beszámoltak az MCD AMPK általi aktiválásáról (15). Ezért az AMPK aktiválása várhatóan csökkenti a malonil-CoA szintet, fokozva a zsírsav oxidációt.
Az adiponektin, más néven 30 kDa adipocita komplement-rokon fehérje (Acrp30), az adipociták által kiválasztott hormon. A teljes hosszúságú adiponektin proteolitikus feldolgozáson megy keresztül, és kis mennyiségű globuláris adiponektin (gAd) kering a plazmában. Két adiponektin-receptort, az AdipoR1 és az AdipoR2-t azonosítottak tavaly (21). Az AdipoR1 nagy affinitású receptor a globuláris adiponektinhez és alacsony affinitású receptor a teljes hosszúságú ligandumhoz, míg az AdipoR2 egy közepes affinitású receptor az adiponektin mindkét formájához. Az AdipoR1 bőségesen expresszálódik a vázizomzatban, míg az AdipoR2 túlnyomórészt a májban expresszálódik; ezért csak teljes hosszúságú adiponectin aktív a májban. Nagyszámú munka kimutatta, hogy a keringő adiponektin csökkent szintje elhízással, inzulinrezisztenciával, 2-es típusú cukorbetegséggel és érelmeszesedéssel jár, és az adiponektin beadása csökkentette a metabolikus szindrómához kapcsolódó rendellenességeket. További tanulmányok kimutatták, hogy az adiponektin hatását nagyrészt a zsírsav oxidáció növekedése közvetíti, ami az AMPK és a PPARα útvonalak aktivációjával jár együtt az adiponektin receptorok után, in vitro és állatokban egyaránt (16, 21).
Az alkoholos zsírmáj eredeti biokémiai magyarázata az etanol metabolizmus azon képességére összpontosított, hogy elmozdítsa a máj redox állapotát és gátolja a zsírsav oxidációját. A későbbi tanulmányok azt találták, hogy az etanollal táplált állatokban a zsírsav-oxidációban és a lipogén enzimek indukciójában szerepet játszó egyes enzimek elfojtása megtörtént, de nem volt egységesítő hipotézis ezen hatások magyarázatára. Javasoljuk, hogy az etanol lipid-anyagcserére gyakorolt hatása a PPARα gátlásából és az SREBP-1 stimulálásából származik, ami tulajdonképpen a máj metabolikus átalakulását eredményezi a zsírraktározó, nem pedig a zsíroxidáló szerv felé. Ezek a hatások viszont az etanol AMPK-ra gyakorolt hatásai lehetnek. Vonzó az AMPK-t tekinteni a máj zsíranyagcseréjének központi modulátorának, különösen azért, mert az AMPK aktivitása függ az etanol adiponektinre és esetleg a TNF-α-ra gyakorolt hatásától (1. ábra).
Javasoljuk, hogy az etanol proximális hatása magában foglalja a portális véna endotoxin, a zsír- és a Kupffer-sejt TNF-α termelésének növekedését, valamint a keringő adiponectin csökkenését. Bizonytalan, hogy az etanol hogyan hat a zsírszövetre. A hepatocytánál az alacsonyabb adiponektin a PPARα és az AMPK aktivitásának csökkenését eredményezné. A jel kaszkádjai az AdipoR2 és ezek a mediátorok között nem ismertek. Ismert, hogy a TNF-α csökkenti a PPARα expresszióját a májban. A TNF-α AMPK-ra gyakorolt hatása nem ismert, és laboratóriumunk aktuális érdeklődési területe.
Az AMPK gátlása etanollal történő adagolással az SREBP-1 aktivitás növekedését eredményezi. Ennek eredményeként az SREBP-1 célgénjei szabályozásra kerülnek, hozzájárulva a máj lipidszintézisének fokozásához. Az AMPK gátlás emellett az ACC fokozott aktivitását és az MCD aktivitásának csökkenését eredményezi ezen enzimek foszforilációs állapotának változásai révén, és ezáltal a malonil-CoA megnövekedett koncentrációja révén csökkentené a zsírsav oxidáció sebességét. Az AMPK szintén befolyásolhatja a PPARα aktivitását. A PPARα-t a p38 MAP kináz aktiválja a szívben (2), és a p38 aktivitását csökkentheti az AMPK-aktivitás gátlása (19). A csökkent PPARα aktivitás a zsírsav oxidációs képességének csökkenéséhez és az MCD csökkent expressziójához vezet.
Ezek a tanulmányok a zsírmáj genetikájáról az alkohollal táplált állatokban megalapozzák a további klinikai vizsgálatokat. Ezeknek a jelátviteli útvonalaknak a módosítása új és hatékony terápiákat nyújthat az alkoholos zsírmáj számára, és megakadályozhatja a máj gyulladásos és fibrotikus válaszait az etanolra.
Ezt a munkát az Országos Alkoholfogyasztási és Alkoholizmus Intézet támogatásával hajtották végre. Az AA-06434 (D. W. Crabbnak), az AA-013623 (M. You-nek) és a P50-AA-07611 támogatás az Indiana Alkoholkutató Központnak.
LÁBJEGYZETEK
A cikk megjelenésének költségeit részben az oldaldíjak megfizetése fedezte. A cikket ezért ezennel fel kell tüntetni:hirdetés”Szerint a 18 U.S.C. Az 1734. § kizárólag ennek a ténynek a feltüntetésére.
Adósok vagyunk Ruth Ann Ross, Yan Zeng és Michinaga Matsumoto kiemelkedő technikai és szellemi hozzájárulásával.
- A folsav által okozott májgyulladás szabályozása alkoholmentes zsírmájbetegségben (NAFLD) - Sid
- Szilimarin alkoholmentes zsírmájbetegségben
- A súlyos elhízás májbetegség súlyosságával jár együtt a gyermekek alkoholmentes zsírmájában
- Az alkoholos májbetegségek patogenezise és kezelése - FullText - Emésztőrendszeri betegségek, 2016. évf
- A nem alkoholos zsírmáj betegség (NAFLD) tünetei, okai; Kezelés