Az antioxidáns étrend-kiegészítés 24 órával az expozíció után kezdődik, és csökkenti a sugárzási halálozást
Absztrakt
BEVEZETÉS
Az antioxidánsokkal történő étrend-kiegészítés növelheti a túlélés valószínűségét egy egyébként halálos teljes test besugárzás (TBI) után. Nemrégiben Wambi és mtsai. kimutatta, hogy az antioxidáns diéta 1 héttel a sugárterhelés előtt kezdődött, és javította a TBI-t túlélő egerek százalékos arányát a kontroll étrendben részesülő egércsoportokkal összehasonlítva (1). Továbbá a TBI után 30 nappal az egerek ugyanazon százaléka élte túl a TBI-t, amikor az egerek órákkal a TBI előtt az antioxidáns étrendről a kontroll étrendre váltottak, vagy amikor az egerek 2 órával a TBI után egy antioxidáns étrendre váltottak. Úgy tűnik, hogy az egyes körülmények között a jobb túlélés érdekében az antioxidánsok jelenléte az étrendben körülbelül a sugárterhelés időpontjában plusz vagy mínusz néhány óra. Az antioxidáns étrend eredményeként javuló túlélésnek tulajdonítható a sugárzás által kiváltott oxidatív stressz és a csontvelő sejtpopuláció apoptózisának csökkenése, minimalizálva a csontvelő szindrómát (1). Az antioxidáns étrend könnyen elérhető és lefordítható ellenintézkedés emberi felhasználásra. Sajnos az antioxidáns kiegészítők korlátozott potenciálisan hasznosak lehetnek egy gyakorlati helyzetben, kivéve, ha kb. 1 nappal a TBI után hatékonyak.
Az antioxidáns étrend sugárzás ellenintézkedéseként történő alkalmazásának optimális időzítését nem határozták meg. Az ellenintézkedések kézbesítésének és terjesztésének lehetővé tétele érdekében valószínűleg 1 napra van szükség. Emellett a test teljes jelentős sugárterhelése (1–7 Gy) után az egyének hányingert, hányást és hasmenést tapasztalhatnak, megakadályozva az étrend hatékony beadását. Ezt a prodromális fázist követően a sugárterhelés tünetei alábbhagynak, és a sugárterhelés áldozatai antioxidáns étrendet kaphatnak. A jelenlegi tanulmányok célja annak meghatározása volt, hogy az antioxidáns étrend hatékony ellenintézkedés, ha 24 órával a TBI után kezdődik.
Az antioxidáns étrendnek háromféle előnye van az injekciót igénylő egyéb ellenintézkedésekkel szemben, mint például a növekedési faktorok és a citokinek. Először is, egy antioxidáns étrend könnyen elérhetővé tehető a kormányzati készlet és elosztás nélkül, amelyre a növekedési faktorokhoz és a citokinekhez szükség lenne. Másodszor, antioxidáns étrend adható szájon át, ellentétben az injekcióval, amelynek beadásához általában képzett személyzetre van szükség. Harmadszor, az antioxidáns étrendet tartós használat mellett is biztonságosnak tekintik, ami nem biztos, hogy a növekedési faktorok és a citokinek esetében áll fenn (2–4).
Ebben a közleményben bemutatjuk azt a korábban be nem jelentett megfigyelést, miszerint az egerek túlélése javul, ha az antioxidáns étrend beadásának kezdete 24 órával késik a sugárterhelés után, összehasonlítva az antioxidáns étrend kiegészítésével, néhány órával a sugárterhelés után.
MÓDSZEREK ÉS ANYAGOK
Az állatkísérleteket AAALAC által akkreditált létesítményben végezték a Henry Ford Kórházban, és az IACUC a Henry Ford Kórházban felülvizsgálta és jóváhagyta. A 7-8 hetes C57BL/6 egerek csoportjait önmagukban vagy antioxidánsokkal kombinálva sugárzásnak tettük ki, az alábbiakban leírtak szerint. Az egereket 1 hétig akklimatizálták a besugárzás előtt, szabályozott hőmérsékletű, HEPA-szűrt környezetben helyezték el őket, és ad libitum étellel és savanyított vízzel kínálták őket. Az étel vagy AIN-93G rágcsáló-chow volt (Land O'Lakes Purina Feed, Lansing, MI), vagy ugyanaz az étrend antioxidánsokkal kiegészítve.
Antioxidáns
Az antioxidánsokkal kiegészített AIN-93G rágcsáló chow-t irányításunk alatt a Land O'Lakes Purina Feed (Lansing, MI) készítette. Az antioxidáns étrend-kiegészítést a sugárterhelés után meghatározott időpontban kezdtük meg, amint azt jeleztük. Miután elkezdte, az étrendet a kísérlet időtartama alatt folytatták. Az antioxidáns kiegészítők az étrend egy grammjára a következők voltak: 0,12 μg l-selenometionin, 19 μg nátrium-aszkorbát, 51 μg N-acetil-cisztein, 100 μg α-liponsav, 8,6 μg α-tokoferol-szukcinát és 51 μg Q10 koenzim; az antioxidáns formulát úgy tervezték, hogy azonos legyen a „Diet A” sémával Guan et al. (5), de az előkészítés során előfordultak kerekítési hibák, amelyek kisebb eltéréseket eredményeztek.
Halálosság végpont
Reaktív oxigénfajok (ROS) a sejtekben
A ROS-t in vitro vagy in vivo a dihidroetídium (DHE) oxidációjával mértük. Az American Type Culture Collection-ből származó WI-38 humán embrionális fibroblasztokat Eagle minimális esszenciális táptalajában tartottuk, 10% magzati szarvasmarha-szérummal. Körülbelül 50% -ban összefolyó WI-38 sejteket y-besugároztunk (a fent leírt 137 Cs-forrást használva) vagy ál-besugároztuk. A besugárzás vagy az ál-besugárzás után azonnal friss sejttenyésztő táptalajt adtak hozzá antioxidáns kiegészítéssel vagy anélkül, és a sejteket a következő napig visszatették inkubátorukba. Az antioxidáns kiegészítő 50 μM aszkorbinsav, 50 μM α-liponsav, 10 μM l-selenometionin, 10 μg/ml Q10 koenzim, 50 μM E-vitamin-szukcinát és 0,1% (térfogat/térfogat) etanol (oldószer) volt. A DHE-festést 24 órával a besugárzás után végeztük, az alábbiakban a szövetmetszetekre vonatkozóan.
ROS a szövetben
Az antioxidáns étrendnek a bőr ROS-ra gyakorolt hatását azoknál az egereknél értékeltük, amelyek TBI-t kaptak 24 órával később kezdődő étrenddel vagy anélkül. Két héttel az ál-besugárzás vagy besugárzás után (azaz az antioxidáns étrend 13 napja után) az egerekbe DHE-t (27 mg/kg, i.p.) injektáltunk; 4 órával később az egereket ketaminnal (100 mg/kg, i.p.) és xilazinnal (10 mg/kg, i.p.) altattuk. Ezután a bőrt kivágtuk, –80 ° C-on lefagyasztottuk és krioszekcionáltuk az ezt követő fluoreszcens mikroszkópia céljából. A DHE port dimetil-szulfoxidban oldjuk, így DHE törzsoldatot kapunk (10 mg/ml). A DHE injekciót (200 ml végső, 27 mg/kg) úgy állítottuk elő, hogy DHE törzsoldatot adtunk 40 ° C-on tartott PBS-hez. Quick és Dugan (7) megjegyezte, hogy a 37 ° C-nál alacsonyabb hőmérséklet a DHE kicsapódását eredményezte.
Lép-telepképző egység (CFU) vizsgálata
A TBI-t túlélő csontvelő sejtek relatív számát a korábban leírt endogén lép CFU vizsgálattal számszerűsítettük (6). A lép kolóniaképző egységek számát mértük, hogy értékeljük az antioxidáns étrend in vivo hatását a csontvelő sejtek túlélésére. A C57BL/6 egerek csoportjait 7,0 vagy 7,5 Gy-nak tették ki önmagukban vagy az antioxidáns étrenddel kombinálva (24 órával a sugárterhelés után kezdődtek). A TBI után tizenkét nappal az egerek lépét kivágtuk és legalább 1 napig Bouin oldatába merítettük. Ezután a kolóniákat egy boncoló mikroszkóppal számláltuk.
Perifériás vérkép
A TBI után a kiválasztott időpontokban az egereket ketaminnal (100 mg/kg) és xilazinnal (10 mg/kg) altattuk vérvétel céljából. 25 ml-es tűvel szívszúrással nyert vért (0,5 ml) heparinizált antikoaguláns csövekbe helyeztünk. A teljes vérképet Advia 120 hematológiai analizátorral (Siemens Diagnostics) mértük az Antech Diagnostics (Detroit, MI) segítségével.
EREDMÉNYEK
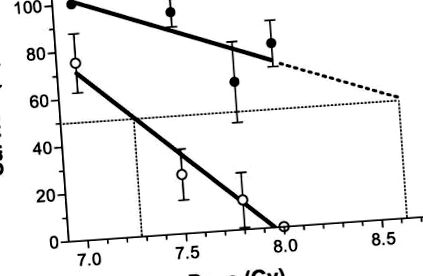
A 18 C57BL/6 egérből álló csoport többsége (78% ± 10%) túlélt egy egyébként halálos sugárzást, amikor étrendjüket antioxidánsokkal egészítették ki. Az 1. ábra szemlélteti, hogy a TBI után 24 órával kezdődő antioxidáns étrend jelentősen enyhítette a sugárzás okozta letalitást (Kaplan-Meier teszt, P 2. ábra). Minden egér a besugárzástól számított 30 napon belül elhunyt, amikor az antioxidánsokkal kiegészített étrendet közvetlenül a TBI után kezdték meg. A 8 Gy TBI után 24 órával kezdődő étrend szignifikáns enyhítést nyújtott, összehasonlítva az antioxidáns étrenddel, vagy közvetlenül a TBI után, 12 órával a TBI után, vagy 48 órával a TBI után (logrank teszt, P 3. ábra mutatja, hogy a növekvő sugárzási dózis mellett a túlélés csökkent megközelítőleg lineárisan, a 7,0–8,0 Gy tartományban lévő dózissal (a korrelációs együtthatók, r 2, önmagában a sugárzás és a sugárzás plusz antioxidáns étrend esetén 0,97, illetve 0,63 volt). szignifikánsan (P = 0,02) eltér a nullától, lejtése -74 ± 10 (túlélési%/Gy), míg a nullától való eltérés nem volt szignifikáns (P = 0,2) az antioxidáns étrend vonalánál 24 órával a besugárzás után kezdődött, amelynek a meredeksége –31 ± 17. A vizsgált sugárzási dózistartományban az antioxidáns étrend hozzáadása jelentős különbséget jelentett a túlélésben. A sugárvédelmi tényező körülbelül 1,18 volt, az ex a sugárzási görbe és az antioxidáns étrend görbe által becsült LD50 becslés, és csak a sugárzás becsült LD50 értéke.
Az egerek túlélése 30 napnál (n = 8–18/csoport) csökkent a növekvő sugárterheléssel; az étrendben antioxidánsokat nem tartalmazó egerek meredeksége (nyitott szimbólumok) meredekebb volt, mint azoknál az egereknél, amelyek antioxidáns étrendet kaptak (szilárd szimbólumok). Vonalakat illesztettek és az LD50-értékeket a szövegben leírtak szerint számolták ki.
A TBI után 24 órával kezdődő antioxidáns étrendnek a csontvelő őssejtekre gyakorolt hatását endogén S-CFU assay alkalmazásával mértük (4. ábra). A szubletális besugárzás plusz antioxidáns étrend (12 órával a besugárzás után kezdődött) után tizenkét nappal a léptelepek száma kétszer-háromszorosára emelkedett (P 3/μl vér. A vörösvérsejtszám 10 6/μl vér. A vérlemezkék száma 10 3 μl vérre.
A 4. ábrán a perifériás vérképet mutatjuk be a vér után, amelyet 12 nappal csak a subletalis TBI (7,0 Gy vagy 7,5 Gy) vagy a TBI után gyűjtöttek, majd 24 órával később kezdődött antioxidáns étrend-kiegészítés. A leukocita, az eritrocita, a thrombocyta és a neutrofil szám szignifikánsan alacsonyabb volt a besugárzott egerekben, mint a besugárzatlan kontroll egerekben (n = 4; P Az 5A és B ábra azt mutatja, hogy az antioxidánsokkal kezelt sejtek kevesebb ROS-t tartalmaztak. Az eredményeket a az egerek, akik korábban csak sugárzást vagy sugárzást kaptak, majd 24 órával később egy antioxidánsokkal kiegészített étrend megkezdésével kb. 2 héten át. A tenyésztett sejtekhez hasonlóan a besugárzott szövetek is ROS növekedést mutattak. A ROS növekedését enyhítette az antioxidáns étrend kiegészítés besugárzás (5C – H ábra). Következésképpen, mind in vitro, mind in vivo, a ROS a besugárzás után napoktól (sejttenyészetben) hetekig (állatokban) nőtt, és a hatást antioxidáns kiegészítéssel enyhítették.
A sugárzás által kiváltott reaktív oxigénfajtákat in vitro és in vivo antioxidánsok csökkentették. A panel: A WI-38 sejteket 8 Gy-nak tettük ki, és az ROS-t 24 órával később oxidált dihidroetídium (DHE) fluoreszcenciájával vizsgáltuk. B panel: DHE fluoreszcencia antioxidánsokkal kezelt WI-38 sejtekben 24 órán keresztül, közvetlenül a sugárterhelés után. C – H panelek: Az egerek bőre 2 héttel 8 Gy TBI után. A C, D és E panelek fénymikroszkópos felvételek a látszólagos besugárzás utáni bőrszakaszokról, önmagában 8 Gy TBI, illetve TBI és antioxidánsok. Az F, G és H panelek az oxidált DHE fluoreszcens képei a C, D és E panelekkel szomszédos szövetszeletekben. Az eredeti nagyításokat az egyes panelek mutatják.
MEGBESZÉLÉS ÉS KÖVETKEZTETÉSEK
Az ionizáló sugárzás a sejtkárosodást közvetlenül ionizálással és közvetett módon szabad gyökök előállításával indítja el. A sugárzás okozta károsodás körülbelül kétharmadát az expozíció során keletkező szabad gyökök okozzák. Az expozíció során keletkező rövid életű szabad gyökök mellett a sugárterhelés után szabad gyökök keletkeznek; A ROS és a gyulladáscsökkentő citokinek biológiai sérülések sokaságát idézik elő jóval a sugárterhelés befejezése után. A szabad gyökök és az ROS által okozott oxidatív stressz leküzdésének egyik megközelítése antioxidánsok, például α-tokoferol-szukcinát, aszkorbinsav, β-karotin, A-vitamin, α-liponsav, N-acetil-cisztein, szelén vagy SH-vegyület ( pl. amifosztin) (9, 10).
Az antioxidánsok kombinációjának felhasználásának indoklása számos megfigyelésen alapul. Az egyes antioxidánsok prooxidánsokként működhetnek, ha maguk is oxidálódnak; ezért az egyes antioxidánsok fokozhatják a szövetek és szervek besugárzás utáni károsodásának progresszióját. Ezenkívül az emberek rendelkeznek antioxidánsokkal, mind endogén antioxidánsokkal, amelyeket a sejtek konstitutív módon szintetizálnak, mind az étrendben elfogyasztott antioxidánsokkal. Az egyes antioxidánsok különböző mechanizmusokkal működnek, és különböző affinitásaik vannak a különböző szabad gyökök iránt. Például az α-tokoferol hatékonyabb, mint a szabad gyökök csillapítója redukált oxigén környezetben, az E-vitamin csekély hatással van a nitrogén-oxidból származó oxidálószerekre, az A-vitamin pedig a leghatékonyabb nagyobb légköri nyomáson. Az aszkorbinsavra a sejtkomponensek védelme szükséges vizes környezetben, míg a karotinoidok, az A- és E-vitamin a nemvizes környezetben a sejtkomponenseket. A C-vitamin újrafeldolgozza az oxidált E-vitamint aktív formává (11). Az E- és C-vitamin együttesen hatékonyabban gátolja az apoptózist az emberi endothelsejtekben, növelve a Bcl-2-t és csökkentve a pro-apoptotikus Bax-szintet (12).
Az itt bemutatott adatok azt mutatják, hogy egy antioxidánsokkal kiegészített étrend 24 órával az egyébként halálos sugárterhelés után kezdődött, amely hatékonyan enyhítette a halált (1. ábra), amelyet a csontvelősejtek kímélése (4. ábra) közvetített, valószínűleg a reaktív oxigén csökkenése miatt. faj (5. ábra). A 8 Gy hatása a gyomor-bél rendszerre vitát indokol. A legújabb bizonyítékok arra utalnak, hogy a csontvelő szindrómát és a gasztrointesztinális szindrómát irányító mechanizmusok a TBI után egyidejűleg fejlődnek (14). Következésképpen meg kell fontolni a sugárzás károsodásának az antioxidánsok felvételére gyakorolt lehetséges következményeit. Még nagyobb enyhítő hatásra lehet számítani, ha az antioxidánsok biodisztribúcióját a gyomor-bélrendszeri sérülés veszélyezteti.
A ROS és a hematopoiesis közötti kapcsolatot molekuláris szinten tisztázzák. Kimutatták, hogy a hematopoiesist stimuláló növekedési tényezők, például az IL3 és a GM-CSF növekedést okoznak az intracelluláris ROS-szintekben (15, 16). A vérképző növekedési faktorokra adott ROS előállítás hozzájárul a tirozin foszforilációval járó jelátviteli eseményekhez, például a sejtproliferációhoz (15) és az apoptózishoz (17). Iiyama és mtsai. (17) ROS szerepet játszott a hematopoietikus citokin által indukált sejtciklus G1-ből S-fázisba történő előrehaladásában a c-Myc, a ciklin D2 és a ciklin E expressziójának indukálásával és a p27 expressziójának csökkentésével. Iiyama és mtsai. (16) azt is kimutatta, hogy a ROS szerepet játszik a Jak2 citokinaktiválásában a proapoptózis útvonalak, köztük a MEK/ERK, downstream szignálozásával. Az antioxidánsokkal végzett kezelés gátolja az ROS növekedését, csökkenti a tirozin foszforilációját, csökkenti a GM-CSF által kiváltott proliferációt (15, 16) és csökkenti az apoptózist (1).
Adataink elsőként bizonyítják, hogy az antioxidáns beadásának késleltetése a sejtes stressz után előnyös lehet a sejtek és az állatok túlélése szempontjából. A hematopoietikus citokinek által termelt ROS kinetikáját, valamint azokat a mechanizmusokat, amelyek révén az ROS részt vesz a citokin receptor szignalizációban a hematopoietikus sejtek proliferációjának és apoptózisának szabályozására, Iiyama és mtsai. (16) Kimutatták, hogy az IL3 és az Epo hematopoietikus citokinek a ROS gyors és átmeneti növekedését váltják ki, amely 30 percnél tetőzött, majd 24 órával a citokin beadása után a ROS lassú, progresszív növekedése következett be. Úgy tűnik, hogy a hematopoietikus sejtek proliferációját és apoptózisát szabályozó ROS-útvonalak két különálló ROS-növekedést jelentenek, egy átmeneti növekedést 30 percnél és egy hosszan tartó növekedést, amely legalább 24 órán át folytatódik.
A sugárhalálosság enyhítése antioxidánsokkal, amelyeket nem sokkal a sugárterhelés után adnak be, az apoptózis csökkenésének tulajdoníthatóak (1). A C57BL/6 egerekkel kapcsolatos tapasztalataink nincsenek ellentmondásban ezekkel az eredményekkel, amint azt a 2. ábra mutatja, amely egyben az antioxidánsokkal kiegészített étrend beadásának megkezdésének megvárásának további előnyét is mutatja a besugárzás után 24 óráig. Úgy tűnik, hogy az első átmeneti ROS-hullámnak van némi kedvező hatása a túlélésre, mivel a ROS korai minimalizálása káros hatással van a csontvelő sejtek túlélésére.
Az apoptózis gátlásán túl az ROS antioxidánsokkal történő csökkentése rövid időn belül a sugárterhelés után gátolja a sejtek G1-ről S-re haladását (18), a sejtciklus azon szakaszát, amelyben a DNS-károsodás helyreállítása a leghatékonyabb (19). A DNS-károsodás helyrehozásának félideje 1-2 óra (20, 21). Következésképpen a sejtek S-fázis előtti letartóztatása túl hamar a sugárterhelés után csökkentheti a sejtek képességét a sérült DNS teljes helyreállítására. Az antioxidáns étrend 24 órával a besugárzás után kezdődő megnövekedett állat-túlélésének egyik magyarázata, hogy az antioxidáns étrend kezdetének késleltetése lehetővé teszi a sugárkárosodás leghatékonyabb helyreállítását és a csontvelő sejtek túlélésének legnagyobb növekedését. A hipotézis megerősítéséhez vagy cáfolásához további vizsgálatokra van szükség.
Összefoglalva: eredményeink kiterjesztik mások munkáját, megmutatva, hogy az antioxidánsokkal kiegészített étrend hatékonyan mérsékli a sugárpusztulást, amikor 24 órával a sugárterhelés után kezdik, és hatékonyabb, mint ha az expozíció után hamarosan alkalmazzák. Eredményeink alátámasztják az antioxidánsok értékét, mint ellenintézkedést a radiológiai terrorizmus ellen, különösen abban a gyakorlati forgatókönyvben, hogy az antioxidánsokkal kiegészített étrendet 24 órával az expozíció után el kell kezdeni.
ELISMERÉS
Ezeket a tanulmányokat támogatta az U19AI067734-020005 (igazgató: Jae Ho Kim), az NIH/NIAID támogatása, amely a Wisconsini Orvosi Főiskola sugárzási sérülések elleni orvosi ellenintézmények központjának (CMCR) része (PI: John E. Moulder ).
- A székrekedés elkerülhető okai az új étrend egészséges megkezdése után
- A magas zsírtartalmú étrendnek való heveny expozíció megváltoztatja az étkezési szokásokat és a testösszetételt
- 10 tipp a vegán kezdőknek a növényi étrend megkezdéséhez - ForksToFeet
- 7 kiegészítő, amelyet figyelembe kell venni a növényi étrend indításakor
- Az agydaganatok reagálnak az étrendre és a sugárterápiára