Az antioxidánsokban gazdag étrend enyhíti a magas vérnyomást és csökkenti a vese immun beszivárgását spontán hipertóniás patkányokban
Renal Service and Laboratory, Hospital Universitario, Instituto de Investigaciones Biomédicas (Fundacite-Zulia), Universidad del Zulia (B.R.-I., Y.Q.), Maracaibo, Venezuela; valamint a Kaliforniai Egyetem Orvostudományi, Élettani és Biofizikai Tanszékének Nefrológiai és Hipertónia Osztálya (C.-D.Z., R.K.S., N.D.V.), Irvine.
Renal Service and Laboratory, Hospital Universitario, Instituto de Investigaciones Biomédicas (Fundacite-Zulia), Universidad del Zulia (B.R.-I., Y.Q.), Maracaibo, Venezuela; valamint a Kaliforniai Egyetem Orvostudományi, Élettani és Biofizikai Tanszékének Nefrológiai és Hipertónia Osztálya (C.-D.Z., R.K.S., N.D.V.), Irvine.
Renal Service and Laboratory, Hospital Universitario, Instituto de Investigaciones Biomédicas (Fundacite-Zulia), Universidad del Zulia (B.R.-I., Y.Q.), Maracaibo, Venezuela; valamint a Kaliforniai Egyetem Orvostudományi, Élettani és Biofizikai Tanszékének Nefrológiai és Hipertónia Osztálya (C.-D.Z., R.K.S., N.D.V.), Irvine.
Renal Service and Laboratory, Hospital Universitario, Instituto de Investigaciones Biomédicas (Fundacite-Zulia), Universidad del Zulia (B.R.-I., Y.Q.), Maracaibo, Venezuela; valamint a Kaliforniai Egyetem Orvostudományi, Élettani és Biofizikai Tanszékének Nefrológiai és Hipertónia Osztálya (C.-D.Z., R.K.S., N.D.V.), Irvine.
Renal Service and Laboratory, Hospital Universitario, Instituto de Investigaciones Biomédicas (Fundacite-Zulia), Universidad del Zulia (B.R.-I., Y.Q.), Maracaibo, Venezuela; valamint a Kaliforniai Egyetem Orvostudományi, Élettani és Biofizikai Tanszékének Nefrológiai és Hipertónia Osztálya (C.-D.Z., R.K.S., N.D.V.), Irvine.
Ön a cikk legfrissebb verzióját nézi. Előző verziók:
Absztrakt
Az oxidatív stressz hipertenzív hatása - legalábbis részben - az endotél diszfunkció következménye, amely a vazodilatátor rendszerek zavaraiból, különösen a nitrogén-oxid oxigén szabad gyökök általi lebontásából következik be. 24–26 Ezenkívül a vese oxidatív stresszje szerepet játszhat a só-visszatartás patogenezisében. Feltételeztük, hogy az immunokompetens sejtek vese beszivárgása szerepet játszhat a sóérzékeny magas vérnyomás patogenezisében. A limfociták és a makrofágok tubulointerstitialis infiltrációja a magas vérnyomás kísérleti modelljeiben reaktív oxigénfajok (ROS) és angiotenzin II-t termelő sejtek képződésével jár. Ennek eredményeként a glomeruláris vazokonstrikció okozta fokozott nátrium-visszaszívódás, károsodott nyomás-natriuresis és csökkent szűrt nátrium alakulhat ki, 33 olyan patofiziológiai állapotot vezethet be, amely a nátrium-visszatartásnak kedvez (Johnson et al. 34).
Csoportunk korábbi vizsgálatai kimutatták, hogy az immunszuppresszív gyógyszerrel, a mikofenolát-mofetillel csökkentett immunszűrés javítja az oxidatív stresszt, valamint a magas vérnyomást. 29–32 Jelen vizsgálatok ugyanannak a kérdésnek az ellentétes oldalát vizsgálják: vajon az antioxidánsokban gazdag étrend hosszú távú beadása csökkentené-e a vese immunszivárgását és javítaná-e a szisztémás hipertóniát.
Eredményeink azt mutatják, hogy az antioxidánsokban gazdag étrend enyhíti a magas vérnyomást spontán hipertóniás patkányokban (SHR) a limfociták és makrofágok beszivárgásának csökkenésével együtt a vese tubulointerstitialis területein.
Mód
Állatok és kísérleti tervezés
A kísérleteket SHR-rel és a Charles River Laboratories-től kapott Wistar-Kyoto patkányokkal (WKY) végeztük. Egy hete vemhes patkányokat és utódaikat vagy rendszeres rágcsáló laboratóriumi étrenddel, vagy teszt étrendet etették, amelyet úgy készítettek, hogy a szokásos étrendhez E-vitamint, C-vitamint, cinket és szelént adtak. Az étrendeket a Purina Mills Inc.-től vásároltuk. A rendszeres étrend és a teszt étrend összetételének különbségeit a táblázat mutatja. A hím utódokat 7 hónapig figyelték meg
Az E-vitamin, a C-vitamin, a cink és a szelén tartalma a rendszeres és a teszt étrendben *
Az állatokat egy hőmérséklet által szabályozott, fény által szabályozott térben helyeztük el, 12 órás fény- és sötét ciklusokkal, és a kísérletek során korlátlan hozzáférést kaptak az élelemhez és a vízhez. Az ebben a vizsgálatban használt protokollt az Irvine-i Kaliforniai Egyetem állatgondozási és felhasználási bizottsága hagyta jóvá.
A vemhes állatokat és utódaikat véletlenszerűen a következő kísérleti csoportokba soroltuk (egyenként n = 5): SHR-R csoport, amely SHR patkányokat tartalmazott, akik a kísérlet során (7 hónap) rendszeres táplálékot kaptak; SHR-T csoport, amely SHR patkányokból áll, akiknek a kísérlet során (antioxidánsokban gazdag) étrendet adtak; SHR-S csoport, amely patkányokat tartalmazott, akik 4 hónapig tesztet kaptak, majd a fennmaradó 3 hónapban rendszeres étrendre váltottak; és a WKY-csoport, amely WKY-patkányokból áll, és a kísérletek során rendszeresen táplálkoznak.
A kísérletek végén az állatokat elaltattuk, miután pentobarbitál-nátrium (Nembutal, 50 mg/kg) intraperitoneális injekcióival altattuk őket. Vért nyertek és a veséket eltávolították. Az egyik vese szövettani és immunhisztológiai vizsgálatokhoz, a másik vese a malondialdehid (MDA) tartalom meghatározásához.
A szérum és a vizelet kreatinin mennyiségét a Sigma Chemical Inc.-től vásárolt készlet segítségével határoztuk meg. A vizelet fehérje és kreatinin koncentrációját a 24 órás vizeletgyűjteményekben határoztuk meg.
Plazma-hidrogén-peroxid
A plazma H2O2 koncentrációt a kvantitatív H2O2 assay kit (OXIS International Inc.) segítségével határoztuk meg. A nitrotirozin bőségét a veseszövetben Western-blot analízissel határoztuk meg, a korábbi tanulmányainkban leírtak szerint. 9.
Vérnyomás meghatározása
A vérnyomást farok-mandzsetta pletizmográfiával határoztuk meg, az előzőekben leírtak szerint. 35 eszméletlen patkányt melegített párnára tettek egy szabályozott hőmérsékletű csendes helyiségben. 15 perces pihenés után, a farokot a farok mandzsettájába helyezve, a mandzsettát 3-4 alkalommal felfújták, hogy az állatot az eljárásnak kitegyék; 4 egymást követő mérést végeztek és rögzítettek (Harvard Apparatus Inc.).
Szövettan
A szövettani vizsgálatokhoz 10% pufferelt formalinban (American Master * Tech Scientific, Inc.) rögzített parafinba ágyazott szövet koronális 3–4 μm-es szakaszait használtuk. Periodikus sav-Schiff (PAS), trikróm, valamint hematoxilin és eozin festést alkalmaztunk a fénymikroszkópos leletek értékelésére. Megvizsgáltuk a kérgi és a mellkasi régiókat. A glomeruloszklerózist PAS-vel festett anyagként határoztuk meg, sejtes elemek nélkül, Bowman kapszulájához tapadva vagy anélkül. A glomerulosclerosist a Raij 36 által leírt pontszám alapján osztályozták, és a korábbi közleményekben részletezték. 30 A tubulointerstitialis károsodást a tubuláris károsodás területeinek mértéke (%) szerint osztályoztuk 0 és 5+ közötti skálán, korábban 30-32: 0 = nincs változás; 1 + = 2. 29–32
Antiszérum
A limfocitákat anti-CD5 monoklonális antitesttel (MRCOX19 klón, Biosource), a makrofágokat anti-ED1 monoklonális antitesttel (Harlan Bioproducts) azonosítottuk. Az angiotenzin II-t termelő sejteket nyúl anti-humán angiotenzin II antiszérumokkal (Peninsula Laboratories) vizsgáltuk keresztreaktivitással patkány angiotenzin II-vel szemben. 29-32 patkány anti-egér és szamár anti-nyúl antitesteket, amelyek minimális keresztreaktivitással rendelkeznek a patkány szérumfehérjéivel szemben, az Accurate Chemical and Scientific Co.
Vese MDA
A vese MDA-tartalmát a vese homogenizátumaiban Buege és Aust módszerével határoztuk meg. 37
Statisztikai számítások
A csoportok összehasonlítását többcsoportos ANOVA elemzéssel végeztük. A szignifikáns különbségeket Tukey-Kramer utótesztekkel értékelték. A változók közötti összefüggéseket lineáris (Pearson), valamint nem paraméteres (Spearman) korrelációs együtthatókkal tártuk fel. A különbségeket akkor tekintettük jelentősnek, amikor a kétfarkú tesztek a P 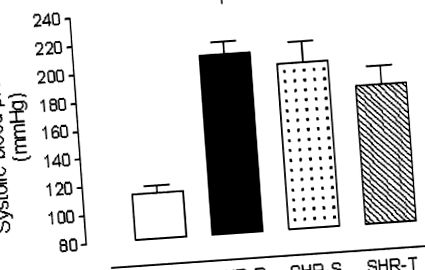
1.ábra. Szisztolés vérnyomás a kísérleti időszak végén. Valamennyi kísérleti csoport szignifikánsan (P
Sejtes beszivárgás
A glomerulusok nem mutattak be szignifikáns limfociták és makrofágok behatolását. Az intraglomeruláris limfociták (CD5-pozitív sejtek/gcs) WKY patkányokban 0,2 ± 0,27, SHR-R, SHR-S és SHR-T esetében 0,25 ± 0,29, 0,3 ± 0,45 és 0,1 ± 0,22. A makrofágok (ED1-pozitív sejtek/gcs) szintén minden csoportban hasonlóak voltak (WKY = 0,4 ± 0,42, SHR-R = 0,38 ± 0,48, SHR-S = 0,30 ± 0,27, SHR-T = 0,20 ± 0,27).
Ezzel szemben a kísérleti csoportokban szignifikáns különbségek voltak a limfociták és a makrofágok tubulointerstitialis infiltrációjában. Az összes csoportból származó SHR patkányokban szignifikánsan nagyobb volt a CD5-pozitív sejtek száma, mint a WKY patkányokban. Amint a 2. ábra mutatja, a CD5-pozitív sejtek intenzívebb beszivárgását figyelték meg a rendszeres táplálékon tartott patkányokban (SHR-R), és a legkevesebb CD5-pozitív sejtet az antioxidánsokban gazdag étrendben tartott patkányokban (SHR- T). A vizsgálati étrendről a szokásos étrendre (SHR-S) átállított patkányoknak köztes értékei voltak (2. ábra).
2. ábra. A limfociták (CD5-pozitív sejtek) tubulointerstitialis infiltrációja 7 hónapos SHR patkányokban, születésétől kezdve, rendszeres étrenden tartották (SHR-R, zárt bár), patkányok 4 hónap után váltottak antioxidáns étrendről (SHR-S, árnyékos sáv) ), és patkányok antioxidánsokban gazdag vizsgálati étrendet tartottak egész idő alatt (SHR-T, csíkos rúd). *P
A makrofágok beszivárgása ugyanazt a mintát mutatta, az SHR-R csoport mutatta a legtöbb ED1-pozitív sejtet. A rendszeres táplálékról antioxidáns étrendre (SHR-S) átállított patkányok köztes makrofág infiltrációval rendelkeztek, a teszt étrenden tartott állatokon (SHR-T) a legkevesebb tubulointerstitialis makrofág volt (3. ábra).
3. ábra. A makrofágok (ED1-pozitív sejtek) tubulointerstitialis infiltrációja 7 hónapos SHR patkányokban, születésétől kezdve, rendszeres étrenden tartották (SHR-R, zárt bár), patkányok 4 hónap után váltottak antioxidáns étrendről (SHR-S, árnyékos sáv ), és patkányok antioxidánsokban gazdag vizsgálati étrendet tartottak egész idő alatt (SHR-T, csíkos rúd). *P
Hasonló eredményeket mutattak ki az angiotenzin II-pozitív sejtekkel kapcsolatban. Amint a 4. ábra mutatja, az antioxidáns étrend csökkentette az angiotenzin II-t termelő sejtek számát. Ez a hatás kifejezettebb volt azoknál a patkányoknál, akiket a tesztet tartottunk (4. ábra).
4. ábra. Angiotenzin II – pozitív tubulointerstitialis sejtek a tubulointerstitiumban. SHR-R, SHR rendszeres étrenden tartották; Az SHR-S, az SHR az antioxidáns étrendről a szokásos étrendre váltott; Az SHR-T, SHR mindvégig antioxidánsokban gazdag teszt étrendet tartott. *P
Szövettan
A fénymikroszkópia lényegében lényegtelen volt minden patkánycsoportban. A glomerulusok normálisak voltak, a fokális cellularitással rendelkező területeken. A tubulointerstitialis területek fokális dilatációs területeket mutattak, de a trichromikus és a PAS festés nem mutatott fibrózisos területeket. A tubulointerstitialis sérülési pontszámok minden kísérleti csoportban hasonlóak voltak: SHR-R = 1,8 ± 0,45; SHR-S = 1,6 ± 0,55; SHR-T = 1,8 ± 0,55; WKY = 1,6 ± 0,55). A fénymikroszkópiát és az immunszövettan ábrázoló reprezentatív mikroszkópos fényképeket az 5. ábra mutatja.
5. ábra. A, Glomerulusok a glomeruláris csomó részleges összeomlásával és a fokális hipercellularitással, tubulusokkal körülvéve, amelyek közül néhány kitágult és hámsejtek részleges elvesztésével, de megmaradt az alapmembrán. A limfocitákat (CD5-pozitív sejtek) és a makrofágokat (ED1-pozitív sejtek) beszivárgó tubulointerstitialis területeken avidin-biotin-peroxidáz festéssel és FITC festéssel mutatjuk be B, illetve C. Angiotenzin II – pozitív tubuláris sejtekben és interstitialis sejtekben (peroxidáz festés) a D-ben láthatók.
Jelentős összefüggések voltak a szisztolés vérnyomás szintje és a limfocita infiltráció között (r= 0,80, P
6. ábra. Nagyon szignifikáns összefüggés a limfociták száma között (A, r= 0,80, P
Vita
Az antioxidánsokkal dúsított étrendnek a prenatális periódusban kezdődő hosszú távú fogyasztása javította a magas vérnyomást és enyhítette az oxidatív stresszt, amit a szöveti nitrotirozin és MDA tartalom csökkenése, valamint a plazma hidrogén-peroxid koncentrációja bizonyít az SHR-T csoportban. Ezek az eredmények összhangban vannak a csoportunk által végzett rövid távú vizsgálatok eredményeivel a 22 erős antioxidáns lazaroid vegyületet felhasználva, valamint Schnackenberg és mtsai 14 által a modellben a tempol szuperoxid-dizmutáz utánzó szer segítségével. Ezek a tanulmányok együttesen meggyőző bizonyítékokat szolgáltattak az oxidatív stressz szerepéről a magas vérnyomás patogenezisében az SHR-ben. Hasonlóképpen, az oxidatív stressz jelenléte és szerepe az artériás nyomás emelkedésében a genetikai és szerzett magas vérnyomás különféle egyéb formáiban is megmutatkozott, beleértve az ólom-expozíciónál tapasztaltakat, 9 krónikus veseelégtelenséget, 10 kísérleti szindrómát X, 38 sóérzékenységet, 39 koarktációt az aorta, 5 angiotenzin infúzió, 40 preeclampsia, 41 és veseartéria szűkület. 42
Jelen tanulmányunkban antioxidáns koktélt használtunk, amely E-vitamint, C-vitamint, szelént és cinket tartalmazott. Korábbi tanulmányok dokumentálták az E-vitamin és a C-vitamin jótékony hatásait a magas vérnyomás enyhítésében magas vérnyomásban szenvedő állatokban és az endotheliális funkció javítását magas vérnyomásban szenvedő embereknél. Ezenkívül kimutatták, hogy a szelén (az antioxidáns glutation-peroxidáz enzim kritikus alkotóeleme) késlelteti a vesebetegség progresszióját cukorbeteg és nem cukorbeteg állatokban. Végül, a cink a citoplazmatikus (Cu-Zn SOD) és az extracelluláris szuperoxid-diszmutáz fontos alkotóeleme, amely a reaktív oxigénfajták elleni védekezés frontvonalaként szolgál. Sőt, a cinkhiány súlyosbítja a magas vérnyomást az SHR-ben. 44 Tekintettel e tápanyagok természetes eredetére, alacsony toxicitására és készenléti elérhetőségére, úgy döntöttünk, hogy ezt a kombinációt használjuk a hatékonyabb, de kevésbé könnyen elérhető és potenciálisan mérgező vegyületek, például a korábbi vizsgálatokban alkalmazott lazaroid vagy tempol helyett. 14,22
Perspektívák
Ennek a vizsgálatnak a központi megállapításai egyrészt az, hogy a rendszeres étrendet fogyasztó SHR-ben súlyos hipertóniával összefüggésben beszűrődik a limfociták, a makrofágok és az angiotenzin II-pozitív sejtek, másrészt az antioxidánsokkal dúsított étrend csökkenti a vese immunszűrését és enyhíti a magas vérnyomást.
A megfigyelt hatások összhangban vannak korábbi SHR-vizsgálatainkkal, amelyek azt mutatják, hogy a vese immunsejt-infiltrációjának csökkenése immunszuppresszív gyulladáscsökkentő gyógyszer alkalmazásával a magas vérnyomás enyhülését eredményezi, amely párosul a vese malondialdehidtartalmának és a szuperoxid-pozitív sejtek száma a vesében. 31 Amint azt egy közelmúltbeli áttekintésben hangsúlyozták, 4 az oxidatív stressz okozza a magas vérnyomás okát 8 és egyben 45 következményét is, és ha a vesében jelen van, akkor ördögi körforgást okozhat, amely magában foglalja a vese gyulladását és a nátrium visszatartását. 34 Bár a rendelkezésre álló adatok nem teszik lehetővé a gyulladásos folyamat elsődleges vagy másodlagos természetének végleges következtetését a magas vérnyomás patogenezisében, az adatok meggyőző bizonyítékokkal szolgálnak a magas vérnyomás fenntartásában játszott szerepéről.
A sejtes infiltráció intenzitása és a hipertónia súlyossága közötti összefüggés a jelen tanulmányban felveti az ok-okozati összefüggés lehetőségét, amelyet tovább kell vizsgálni. Ezenkívül a jelen vizsgálatok megerősítik, hogy az étrendi antioxidáns kezelés javítja a magas vérnyomást az SHR-ben, és arra utalnak, hogy ez a terápiás megközelítés klinikailag alkalmazható.
Ezt a tanulmányt részben Thomas Yuen (Dr. Vaziri laboratóriuma) és a FONACYT S1–2001001097 (Venezuela) támogatása (Dr. Rodríguez-Iturbe laboratóriuma) finanszírozta.
- Baba táplálkozás; Diéta egészséges immunrendszerért Aptaclub
- Reggeli krónikus vesebetegségért Vese diéta menü székhelye
- 8 tipp az immunrendszer erősségéhez kemoterápiás étrend és M
- A legjobb diéta a magas vérnyomás ellen - San Diego - Sharp Health News
- Az antioxidánsokban gazdag étrend csökkentheti a fertőzést az ALL Kortárs Gyermekgyógyászatban szenvedő gyermekeknél