Az arachidonsav mint gyulladás korai mutatója alkoholmentes zsírmáj betegség kialakulása során
Absztrakt
1. Bemutatkozás
Az alkoholmentes zsírmájbetegség (NAFLD) a nyugati társadalmakban az egyik leggyakoribb krónikus májbetegség [1,2]. Becslések szerint ma a világ népességének csaknem 25% -a szenvedhet a NAFLD-től [1,3,4]. Ezt az állapotot szövettani változások jellemzik, amelyek a túlzott lipidlerakódásból erednek a májsejtek térfogatának több mint 5% -ában, túlzott alkoholfogyasztás nélkül [1,5,6]. Szinte az összes nyugati országban a májbetegség előfordulásának fő okai a magas kalóriatartalmú és a magas zsírtartalmú étrendek. Ezenkívül a legújabb tanulmányok megerősítették a NAFLD progressziója és a 2-es típusú cukorbetegség és elhízás eseteinek növekvő száma közötti jelentős összefüggést [6,7]. Az elhízott, egyidejűleg zsírmájjal rendelkező betegek szérumában jelentős változások tapasztalhatók az adiponektin, a leptin és az rezisztin szintjében. Ezek a molekulák a gyulladáscsökkentő citokinekkel együtt, amelyek felszabadulnak a zsírszövetből, részt vehetnek a máj steatosisának fejlődésében [8].
A NAFLD fejlődése gyakran enyhe zsírmájváltozásokkal kezdődik, és alkoholmentes steatohepatitiszé (NASH) válhat, amelyet a túlzott lipidfelhalmozódással járó gyulladás jellemez, amely reverzibilis állapot. A progresszív NASH azonban súlyosabb, visszafordíthatatlan változásokhoz vezet, például májfibrózis, cirrhosis és végül májelégtelenség vagy hepatocelluláris carcinoma (HCC) kialakulásához [1,2,4,5,6].
Hosszan tartó, megnövekedett étkezési zsírfogyasztás, amely meghaladja a test energiaigényét, a lipidek túlzott felhalmozódását eredményezi a májsejtekben, mitokondriális diszfunkciókat és az oxidatív egyensúly károsodását eredményezi a májban. A lipidek túlzott mértékű lerakódása elsősorban a triacil-glicerin (TAG) frakcióban olyan változások lépcsőjét indíthatja el, amelyek a diacilglicerin (DAG) és a ceramid (CER) megnövekedett felhalmozódásához vezetnek [2,9]. Ezeknek a lipidfrakcióknak a túlzott felhalmozódása károsíthatja a lipid anyagcserét, gyulladásos választ és az oxidatív stressz kialakulását [10,11]. A legfontosabb a NAFLD patofiziológiájában nemcsak a májban felhalmozódó fő lipidosztályok mennyisége, amely döntő fontosságú a steatosis romlása szempontjából, hanem az ezekben a frakciókban található zsírsavak összetétele is [10]. Érdekes módon a szabad zsírsavak (FFA) túlzott felhalmozódása meghatározhatja a máj szenzibilizációját a „találatok” sorozata felé, ezáltal steatosishoz és a NASH kialakulásához vezethet [1].
A túl táplálkozás és különösen a magas zsírtartalmú táplálás az n-6 többszörösen telítetlen zsírsavakhoz (PUFA) tartozó arachidonsav (AA, C20: 4) exogén forrásaként szolgál, és anyagcserezavarokkal jár. A megnövekedett PUFA-ellátás a gyulladásgátló lipidvegyületek, például az arachidonsav és az AA-származékok intenzívebb generációját idézheti elő, hozzájárulva a sejtek gyulladásos szignálozásához [2]. Az oxidatív stressz és a kapcsolódó gyulladás kulcsfontosságú szerepet játszik a NAFLD fejlődésében és előrehaladásában. Régóta felismerték, hogy az arachidonsav az eikozanoidként is ismert gyulladásgátló vegyületek, azaz prosztaglandinok, leukotriének és tromboxán A2 prekurzorai, amelyek fokozott lerakódása a NAFLD romlását okozhatja [2,12].
Mint korábban megjegyeztük, fontos meghatározni azt az időpontot, amikor a gyulladás és a kapcsolódó visszafordíthatatlan változások kialakulnak a májsejtekben. Az oxidatív stressz útjáért felelős enzimek aktivitásának változásai jól jelzik, hogy mikor kell orvosi beavatkozást végrehajtani. Ezért a következő tanulmány célja a lipidösszetétel változásainak meghatározása a NAFLD fejlesztése során. Az itt bemutatott adatok a zsírtartalmú étrend (HFD) által kiváltott NAFLD-ben a kiválasztott lipidfrakciók AA-tartalmának különbségeire vonatkoznak, különböző időpontokban, ami az oxidatív stressz és a gyulladás előfordulásának előrehaladásában játszik fő szerepet. Így tanulmányunk az AA-tartalom és a gyulladás előfordulásának lehetséges kapcsolatát vizsgálja az alkoholmentes zsírmáj betegség kialakulása során.
2. Anyagok és módszerek
2.1. Kísérleti modell
2.2. Májszövettani elemzés
Az elemzéshez az egyes patkányok májkaréjainak egyes részeit 10% -os vizes formaldehid-oldatban rögzítettük, majd alkoholok sorozatával dehidratáltuk. Ezáltal az előkészített májszöveteket paraffinba ágyazottuk. A metszeteket (4 μm vastag) hematoxilinnal és eozinnal (H + E) festettük, Konstantynowicz-Nowicka és mtsai. [13].
Az elkészített szövettani tárgylemezeket Olympus DP12 kamerával (200x nagyítás; 20x lencse, 10x okulár; Hamburg, Németország) felszerelt könnyű Olympus BX41 mikroszkóp segítségével értékeltük három független patológus által. Korábbi tanulmányunkban [13] ugyanazokat a szöveteket értékeltük a NAFLD előfordulása szempontjából a NAFLD aktivitási pontszám (NAS) rendszer alkalmazásával, amely azt mutatta, hogy a NAFLD 3 hét HFD után következett be.
2.3. A máj és a plazma lipidtartalmának elemzése
A kapott plazma- és májmintákban lévő egyes zsírsav-metil-észtereket kloroform/metanol (2: 1, v/v) oldattal extraháltuk (Folch módszere) [14], és frakciókra osztottuk - DAG, TAG, FFA és foszfolipidek (PL) - vékonyréteg-kromatográfiával (TLC) [15]. A szétválasztott frakciókat 14% -os bór-trifluorid-metanol-oldattal transzmetiláltuk, és a gáz-folyadék kromatográfia - GLC (Hewlett Packard 5890 II. Sorozatú gázkromatográf; Agilent Technologies, CA, USA; kapillárisot tartalmazó) retenciós időknek megfelelően számítottuk. oszlop és lángionizációs detektor - HP-INNOWax) - amint azt korábban részletesen leírtuk [15]. A zsírsavösszetétel alapján az adott lipidfrakcióban az arachidonsav-tartalmat nanomol/szövet grammban fejeztük ki.
2.4. Immunblot
A májszövet teljes fehérjekoncentrációjának meghatározását egy bicinchonininsav (BCA) fehérje vizsgálati készlet alkalmazásával, standardként BSA-val végeztük. Az immunoblotting jel denzitometriai elemzését ChemiDoc vizualizációs rendszerrel (BioRad) végeztük. Az elemzett fehérjék expresszióját standardizáltuk a teljes fehérje expresszióhoz, és a kontrollt 100% -ban állítottuk be.
2.5. Az oxidatív és antioxidáns paraméterek meghatározása
Az oxidatív stressz komponensek meghatározása előtt a májszövetet egy radioimmunprecipitation assay (RIPA) pufferben (25 mg szövet/250 ul puffer) homogenizáltuk malonildialdehidre (MDA); jéghideg foszfátpuffer sóoldatban (PBS) 20 mg szövet/1 ml PBS-ben szuperoxid-diszmutáz 2 (SOD2), kataláz (CAT) és teljes antioxidáns kapacitás (TAC) esetében; és ebben 10 mg szövet/90 ul PBS-ben 4-hidroxinonénális (4-HNE) és előrehaladott glikációs végtermék (AGE) meghatározásához. Ezután a kapott homogenizátumokat RIPA pufferben, 1600 x g értéken, 4 ° C-on 10 percig centrifugáltuk az MDA mennyiségi meghatározásához. A CAT, SOD2 és TAC számszerűsítése érdekében a PBS-ben lévő homogenizátumokat 12 000 x g-vel, 4 ° C-on 5 percig centrifugáltuk, és a mintákat 5000 x g-vel 4 ° C-on 5 percig centrifugáltuk a 4-HNE és az AGE értékének meghatározása céljából. Ezután a felülúszó frakciókat külön csövekbe helyeztük, és további elemzés céljából -80 ° C-on tároltuk.
A CAT és az SOD2 májkoncentrációit a Cloud-Clone Corp. (Houston, TX, USA) kereskedelmi ELISA kitjeivel határoztuk meg. Ezeknek a biomarkereknek az abszorbanciáját spektrofotometriásán mértük 450 nm-en mikrolemez-leolvasó (Synergy H1 Hybrid Reader, BioTek) alkalmazásával. Végül a kapott standard görbékből kiszámítottuk az oxidatív stressz enzim koncentrációit. Az eredményeket pikogrammokban és nanogrammokban fejezzük ki szövet milligrammjára az SOD2 és a CAT esetében.
A máj homogenizátumok MDA-tartalmának mennyiségi meghatározásához a Cayman Chemical Company (Ann Arbor, MI, USA) tiobarbitursav-reaktív anyagok (TBARS) vizsgálati készletét használtuk. Ez a módszer az MDA-kötés tiobarbitursavval (TBA) történő reakcióján alapul, és az így kapott MDA – TBA-adduktokat kolorimetriásan mértük 530 nm-en. Ezután kiszámítottuk az MDA értékeket, és ezeket nanomol/szövet milligrammban fejezzük ki.
A 4-HNE és az AGE koncentrációk meghatározásához ELISA készleteket használtunk a Biorbyt-től (Cambridge, Egyesült Királyság). Az abszorbanciát spektrofotometriásan határoztuk meg 450 nm-en. Ezután az oxidatív komponens koncentrációit standard görbékből kaptuk. A 4-HNE és az AGE expresszált mennyiségét pikogrammként és nanogrammként adjuk meg szövet milligrammjára számítva.
Ezenkívül a májszövet TAC paraméterét kolorimetrikus TAC assay kit (Abcam) alkalmazásával határoztuk meg. Az abszorbanciát spektrofotometriásan mértük 570 nm-en. Ezután a paramétert a gyártó protokolljai szerint számították ki, és nanomol/szövet milligrammban fejezték ki.
2.6. Adatelemzés
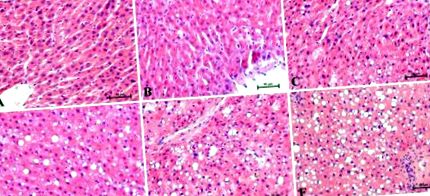
A kísérlet adatait átlag ± szórásként fejezzük ki. Statisztikai elemzésünket a GraphPad Prism 5 (Kalifornia, USA) segítségével végeztük. Az elemzés során alkalmazott módszerek feltételezéseit (az adateloszlás normalitása és a variancia homogenitása) Shapiro – Wilk teszt és Bartlett teszt segítségével ellenőriztük. A csoportok közötti statisztikai különbségeket egyirányú ANOVA-vizsgálattal vizsgálták, amelyet megfelelő post-hoc teszt (Tukey-teszt és t-teszt) követett. Az összes adatra egy p-értékű 1. ábra mutatja a H + E-vel festett májszakaszok reprezentatív szövettani képeit. A szövettani elváltozásokat három független patológus értékelte. Az öthetes, magas zsírtartalmú táplálás hatással volt a máj lipid-lerakódásának szintjére, és fokozott hepatocita-ballonozást figyeltek meg. A kontroll csoportban (0 hét) H + E festést követően radiálisán elrendezett májtrabekulákat figyeltünk meg ballonos degeneráció nélkül (1. A. ábra). A kísérlet végén az összes vizsgált szakasz a különböző időpontokban (1., 2., 3., 4. és 5. hét) enyhe vagy súlyos steatózist mutatott, lineáris növekedéssel a ballon degenerációban (1. B – E ábra) a kontrollhoz képest. csoport. Vizsgálatunk minden egyes egymást követő hetével a steatosis súlyosabb lefolyású lett. A patológusok a máj parenchyma látható rendezetlenségére figyeltek fel a zsírtartalmú táplálkozás hatására. A steatosis és a ballonozás legmagasabb fokozata a HFD-etetés ötödik hetében következett be (1. F ábra).
A májszakasz reprezentatív hematoxilin- és eozin (H + E) foltjai az egyes időpontokban (A) 0 hét kontrollcsoportként és a kísérleti HFD hetek: (B) 1, (C) 2, (D) 3, (E) 4 és (F) 5. Az egyes patkányok (n = 6) eredményeit a májlebenyek specifikus részeinek független meghatározásaként gyűjtöttük össze. 200 × nagyítás. A jobb alsó sarokban a kalibráló oszlop egyenlő 50 μm-rel.
3.2. Az arachidonsav-tartalom változásai a májban és a plazmában
A májban a magas zsírtartalmú táplálkozási csoportban minden héten szignifikánsan megnövekedett arachidonsav-tartalmat figyeltünk meg a DAG-frakcióban (első hét: + 107,2%; második hét: + 94,9%; harmadik hét: + 77,5%; negyedik hét: + 59,8%; ötödik hét: + 123,8%; p 2. A ábra) a kontroll csoporthoz képest. Ezenkívül a TAG frakcióban az AA szintje fokozatosan emelkedett az összes vizsgált csoportban, és ezek a változások statisztikailag szignifikánsak voltak (első hét: + 405,2%; második hét: + 498,7%; harmadik hét: + 571,4%; negyedik hét: + 815,0%; ötödik hét: + 945,5%; p 2. B ábra) a kontroll csoporthoz képest. A magas zsírtartalmú táplálás minden egyes hetében szignifikánsan megnövekedett arachidonsav-tartalmat is találtunk az FFA-kban (első hét: + 134,7%; második hét: + 93,7%; harmadik hét: + 41,6%; negyedik hét: + 25,2%; ötödik hét: + 97,4%; p 2. ábra C) és PL-k (első hét: + 89,5%; második hét: + 86,4%; harmadik hét: + 108,9%; negyedik hét: + 104,9%; ötödik hét: + 119,3%; p 2. ábra D) összehasonlítva a kontrollcsoportéval.
- A káposzta segíthet az alkoholmentes zsírmájbetegségek leküzdésében. Egyéb természetes megoldások, amelyek kipróbálhatók - Hang
- Az alkoholmentes zsírmájbetegségek és anyagcsere-szindrómák társulása a központtól függetlenül
- A káposzta segíthet az alkoholmentes zsírmájbetegségek leküzdésében. Egyéb természetes megoldások, amelyek kipróbálhatók
- Az artériás magas vérnyomás, az elhízás és az alkoholmentes zsírmájbetegség fennáll-e összefüggés
- 6 tipp a zsírmájbetegség csökkentésére - a cukorbetegség, az elhízás gyakori szövődményei - fejlődő