Az autofágia elnyeri a fiziológia vagy az orvostudomány Nobel-díját 2016-ban: Áttörések a pékélesztő üzemanyagban az orvostudományi kutatások terén
Beth Levine
Autofágia-kutató Központ, Belgyógyászati Klinika, Texas Egyetem Délnyugati Orvosi Központ, Dallas, TX, 75390;
b Mikrobiológiai Tanszék, Texas Egyetem Délnyugati Orvosi Központ, Dallas, TX, 75390;
c Howard Hughes Orvostudományi Intézet, Texas Egyetem Délnyugati Orvosi Központ, Dallas, TX, 75390;
Daniel J. Klionsky
d Élettudományi Intézet, Michigani Egyetem, Ann Arbor, MI, 48109
Szerző közreműködései: B.L. és D.J.K. írta a lap.
Absztrakt
2016. október 3-án az élettani vagy orvosi Nobel-díjat Yoshinori Ohsumi kapta „az autofágia mechanizmusainak felfedezéséért”. Alig néhány héttel korábban, a 2016. évi Paul Janssen-díj elfogadó beszédén Yoshinori Ohsumi kijelentette, hogy bár egyszerű szervezetben - pékélesztőben - végez kutatásokat, mindig remélte, hogy kutatásai hatással lesznek az emberi egészségre. Valójában Ohsumi felfedezései, az élesztő autofágia útvonalain egyidejűleg dolgozók felfedezésével együtt hatalmas molekuláris eszközkészletet nyújtottak, amelyet tudósok ezrei használnak világszerte az autofágia szerepének megfejtésére az emlősök egészségében és betegségében. Az idei Nobel-díj története a tankönyvnél jobb példát mutat be arra, hogy az alapvető alaptudomány féktelen felfedezése miért kulcsfontosságú az orvostudomány új határainak megnyitása szempontjából.
Autofágia valószínűleg évmilliárdokkal ezelőtt alakult ki
Az autofágia a görögből származik, és azt jelenti, hogy megeszi („phagy)” („auto”), és az önemésztés lizoszomális lebomlási útjára utal (1. ábra) (1). Ez a folyamat magában foglalja a membrán dinamikus átrendeződését a rakomány elválasztására a lizoszómába juttatáshoz, ahol a leválasztott anyag lebomlik és újrafeldolgozódik. Ma már tudjuk, hogy az autofágia lehet nem szelektív (például tápanyaghiány alatt) vagy tökéletesen szelektív (például amikor a sérült organellák vagy az intracelluláris kórokozók lebomlanak). Az autofágia molekuláris mechanizmusa (amelyet először az élesztőben fedeztek fel az alábbiakban leírtak szerint) minden eukarióta szervezet genomjában jelen van, amelyet eddig szekvenáltak, de egyetlen prokarióta esetében sem. Így az autofágia eredete elválaszthatatlanul összefügg az eukarióta élet kialakulásához nélkülözhetetlen koevolúciós eseményekkel.
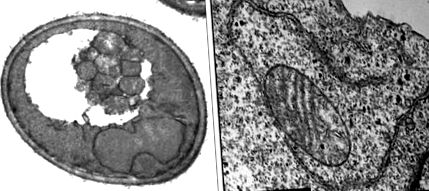
Az autofágia ultraszerkezete élesztő- és emlőssejtekben. (Balra) Élesztő (S. cerevisiae) sejt elektronmikroszkópiája autofág testekkel a vakuolban nitrogén éhezés során. Reprodukálva a ref. Engedélyével 54. (Jobbra) Elektrogén mikrográfia egy képződő autofagosomáról egy exogén Beclint expresszáló aminosav-éhezett beclin 1-hiányos humán emlőrák sejtben 1. X. H. Liang, N. Furuya, Y. Wei és B. Levine jóvoltából. (Mérlegsorok, 1 μm.)
Az autofágia először az 1950-es években íródott le az emlőssejtekben
Ezek a legfontosabb korai eredmények megállapították az autofágia létezését emlős sejtekben; tápanyag-állapot, tápanyag-érzékelő hormonok, kinázok és foszfatázok általi szabályozása; a rakomány szelektív romlásának lehetősége; és bizonyos stressz- és fejlődési viszonyok növekedése. Figyelemre méltó, de Duve és Wattiaux 1966-ban készült áttekintő cikke (16) előrevetítette mindazt, amit ma ismerünk az autofágia funkcióiról. Ezek magukban foglalják a „táplálkozás kedvezőtlen táplálékellátás körülményeit az önálló emésztés révén”, „a sejtek differenciálódása és metamorfózisa”, „a hosszú életű sejtek önmegújulásának részeként történő intracelluláris megkötés” és a elhalt sejtek. ” Volt azonban egy fő probléma - hogyan lehet az autofágia (vagy más) funkcionalitását morfológiai megfigyelésekkel igazolni? Ebben rejlik az alapja annak, hogy mennyire fontos leírni az élesztőben lévő autofágia konzervált genetikai mechanizmusát.
Írja be Ohsumi és más élesztő kutatók: Az autofágia kutatás genetikai korszakának hajnalát
Az 1990-es évek elején számos laboratórium elkezdte a nem szelektív és szelektív autofágia tanulmányozását élesztőkben. 1992-ben Ohsumi és munkatársai (17) leírtak „autofág testek” jelenlétét a tápanyagoktól mentes proteázhiányos Saccharomyces cerevisiae vakuolájában (a lizoszóma analógja) - a nem szelektív autofágia első morfológiai jellemzése élesztőben. A Journal of Cell Biology ugyanebben a számában Klionsky és mtsai. (18) leírta az aminopeptidáz I behozatalát a Saccharomyces cerevisaie vakuolájába - az élesztő szelektív autofágia első jellemzése. Röviddel ezután Dunn és munkatársai (19) a metilotróf élesztőkben, a Pichia pastoris és a Hansenula polymorpha szelektív autofágia egy formáját írták le, amely a vakuoliában a peroxiszómák szelektív lebontását foglalja magában.
Ezek a morfológiai és biokémiai jellemzések három laboratóriumban közel párhuzamos erőfeszítéseket hoztak létre a S. cerevisiae mutánsainak izolálása és az élesztő autofágia gépezetét kódoló gének klónozása céljából, amelyeket ma autofágia-rokon (ATG) géneknek neveznek (20); hasonló erőfeszítéseket tettek számos metilotróf élesztővel dolgozó laboratóriumban (21). Ohsumi csoportja (22) genetikai szűrést végzett azoknak a mutánsoknak az izolálására, amelyek autofág testeket halmoznak fel a vakuolában, és csökkent életképességet mutatnak a nitrogén-éhezés során (eredetileg apg mutánsokként ismertek); Thumm et al. (23) genetikai szűrést hajtott végre a vakuolában lebontás céljából fehérjefelvételből hiányos élesztők izolálására (eredetileg aut mutánsként ismertek); és Klionsky csoportja (24) olyan mutánsok szűrését végezte el, amelyeknek hiányosak a rezidens vakuoláris hidroláz citoplazmából a vakuolába történő eljuttatása (eredetileg cvt mutánsok).
1996 októberében Ohsumi és munkatársai beszámoltak az első élesztő autofágia génről, az APG5-ről (ma már ATG5 néven) (25). Röviddel ezután, 1997 februárjában, Thumm csoportja (26) az AUT1 (ma már ATG3 néven ismert) klónozásáról számolt be, amely egy E2-konjugáló enzimet kódol, amely részt vesz az ubikvitin-szerű Atg8 fehérje módosításában. 1998-ban Mizushima és mtsai. (27) az élesztő fehérje konjugációs rendszerét, az Atg12 – Atg5 rendszert írta le, amely ubikvitint aktiváló E1-szerű enzimet, az Atg7-et igényel, és 1999-ben három további csoport (28–30) számolt be back-to-back dolgozatban. és az élesztő ATG7 jellemzése. 2000-ben Ichimura és mtsai. (31) arról számolt be, hogy az Atg7 E1-szerű enzim konjugálja az Atg8-at foszfatidil-etanol-aminnal, szerepet játszva a fehérje lipidációjának a membrándinamikában az autofágia során.
1996 és 2000 között az élesztőgombákkal dolgozó különféle laboratóriumok klónozták az autofágia különböző szakaszaiban működő komponenseket kódoló géneket, beleértve az iniciációt (az Atg1 szerin/treonin kináz komplexet és a Vps34 lipid kináz komplexet), valamint a fagofór expanziót és az autofagosomát. érés (a két ubiquitin-szerű fehérje konjugációs rendszert érintve). Ettől az időszaktól kezdve a molekuláris genetikai, biokémiai és strukturális megközelítéssel végzett átfogó vizsgálatok (különösen a S. cerevisiae-nél) tovább tanítottak bennünket az alapvető autofágia-gép működéséről, és további komponenseket azonosítottak a szelektív autofágia különféle típusai szempontjából.
Az emlősök autofágia kutatásának genetikai korszakának hajnala
Az élesztővel végzett vizsgálatok döntő fontosságúak voltak az autofagoszóma képződésének molekuláris mechanizmusainak tisztázásában. A korai élesztő genetikai szűrők azt is megállapították, hogy az autofágia elengedhetetlen az éhezés alatti túléléshez és a sporuláció élesztő differenciálódási folyamatához. Mivel azonban az élesztők egysejtű szervezetek, az autofágia molekuláris mechanizmusának felfedezése bonyolultabb eukariótákban (különösen emlősökben) kritikus jelentőségű volt az autofágia funkcióinak meghatározásában az egészség és a betegség szempontjából.
Az 1990-es évek során számos gerinces gént klónoztak, amelyek nagyfokú szekvencia homológiát mutattak az esszenciális élesztő autofág génekkel, köztük a szarvasmarha PIK3C3/VPS34 (32), a patkány MAP1LC3/LC3 (33), az egér és az emberi Ulk1/ULK1 (34, 35). ), humán ATG5 (36, 37), humán ATG12 (37) és humán VPS30/ATG6 (beclin 1) (38). 1999-ben Levine csoportja (39) bemutatta az emlős fehérje autofág funkcióját; A Beclin 1, a Vps30/Atg6 élesztő emberi ortológusa autofágiát mentett meg VPS30/ATG6-hiányos élesztőgombákban és autofágia-hiányos emlőrákos sejtekben, amelyekből hiányzott a beclin 1 egy példánya. A következő néhány évben bebizonyosodott, hogy gyakorlatilag az összes az élesztő autofágia génjei funkcionálisan konzerváltak a metazoa evolúció során.
Ezeket a korai vizsgálatokat hamarosan rengeteg további genetikai elemzés követte különböző metazoán organizmusokban, amelyek egyértelműen meghatározták az autofágia gépezetének döntő szerepét a differenciálódásban és fejlődésben, a tápanyagok és az energia homeosztázisában, a stressz adaptációjában, a tumor szuppressziójában, a veleszületett és adaptív immunitásban, az anyagcserében., a gyulladás szabályozása, valamint a szív- és csontvázbetegségek, a neurodegeneráció és az öregedés elleni védelem (48–50). Ezek a szerepek abból fakadnak, hogy az autofágia lebontja a nem kívánt vagy káros szubsztrátumokat (nagyrészt szelektív autofágia révén), a citoplazmatikus alkotóelemeket újrahasznosítja a környezeti stressz alatt (nagyrészt a nem szelektív autofágia révén), valamint az autofágia gépezetének egyéb homeosztatikus funkcióiból. Fontos, hogy ma már világos, hogy az autofagoszóma kialakulásához szükséges magkomponenseket kódoló gének mutációi emberi betegséggel társulnak (51, 52).
Élesztő és emlős autofágia kutatók egyesülnek
Az első autofágiai kutatási konferencia, amelyet 2003-ban tartottak, észak- és dél-amerikai, európai, közel-keleti és ázsiai kutatókat hozott össze (2. ábra). Résztvevői közé tartozott a fent említett élő autofágia szinte összes kutatója, valamint számos más vezető vezető és a területen emelkedő csillag. Yoshinori Ohsumi tartott előadást és dobta az első pályát egy délutáni szünetben megrendezett „élesztő kontra emlősök” softball játékon. A találkozó transznacionális és transzkommunikációs jellege sokrétű szakértelemmel, de közös autofágia iránti szenvedéllyel egyesítette a résztvevőket, ezzel megalapozva a tartós tudományos együttműködéseket, amelyek jelentősen felgyorsították a felfedezés ütemét a területen. A sok példa egyikeként Yoshimori csoportja (53) felfedezte, hogy a GFP-LC3 az autofagoszómák hasznos markere volt; nagylelkűen megosztotta reagenseit, és az Atg8/LC3 ortológusok fluoreszcens címkével ellátott változatait azóta világszerte használják az autofagoszóma számának figyelemmel kísérésére számos fajban.
Az „Autofágia a stresszben, a fejlődésben és a betegségben” című első gordoni kutatási konferencia résztvevői (Colby College, Maine, 2003. június 22–27.). Az első sorban (10–12. Pozíció) Daniel J. Klionsky, az alelnök áll; Beth Levine, az elnök; és Yoshinori Ohsumi, a fiziológia vagy az orvostudomány 2016. évi Nobel-díjasa.
Az autofágia kutatásának magas dél
Az élesztőben az autofágia genetikai mechanizmusának és molekuláris mechanizmusainak tisztázásának köszönhetően (és az ezt követő, összetettebb eukariótákban végzett munkáknak, amelyek erre az alapra épültek) egy izgalmas új korszakba léptünk az autofágia kutatásában. Jelentős lépéseket tettünk annak megértésében, hogy az autofágia hogyan szabályozott, hogyan néz ki az autofágia alapvető szerkezete szerkezetileg és hogyan működik, mit tesz az autofágia, hogy egészségesek legyünk (vagy ritkább esetekben betegessenek meg bennünket), és hogyan tudunk manipulálni autofágia farmakológiailag vagy életmódbeli beavatkozások révén az öregedés és számos gyakori betegség megelőzésére és/vagy kezelésére. Azt is megtudjuk, hogy az autofágia genetikai mechanizmusa részt vesz az emberkereskedelem és a jelátviteli útvonalakban az emlősök fiziológiájának ellenőrzése érdekében, ezáltal tovább bővítve az eredeti élesztő genetikai szűrők hosszú távú orvosbiológiai hatását. Noha nem kapcsolódik közvetlenül az autofagoszóma képződéséhez szükséges gének élesztő-szűrőihez, a közelmúltbeli forradalom a szelektív autofágia szempontjából szükséges gének azonosításában (amelyek közül sok az emberi betegségekben, különösen a rákban és a neurodegeneratív rendellenességekben mutálódott) szintén nagy ígéretet támaszt az autofágia fokozására irányuló stratégiákkal kapcsolatban. védekezni a betegségekkel szemben.
Az biztos, hogy sok kérdés megválaszolatlan még az autofágia (és más autofágia géntől függő folyamatok) alapvető mechanizmusaival, a betegségekben betöltött szerepével és a gyógyszercélzás útjának lehetőségével kapcsolatban. Mindazonáltal teljesen lehetséges, hogy életünkben, vagy legalábbis gyermekeinkben, tanúi lehetünk Yoshinori Ohsumi reményének megvalósulásának - egy korábban alábecsült élesztő sejtbiológiai folyamat beszédes molekuláris boncolása valószínűleg végső soron az úttörő előrelépéseket fogja elősegíteni Egészség.
Köszönetnyilvánítás
A szerzőket az NIH Grants U19 AI199725 és RO1 CA109618 (B.L.-ig) és RO1 GM053396 (D.J.K.-hez) támogatásával támogatja.
Lábjegyzetek
A szerzők nem jelentenek összeférhetetlenséget.
Ez a cikk a PNAS közvetlen benyújtása.
Ez a cikk a PNAS cikksorozatának része, amely kiemeli a Nobel-díj felfedezéseit és profiljait. A 2016. évi fizikai és kémiai Nobel-díjasokról szóló cikkek a 10.1073/pnas.1620134114 és 10.1073/pnas.1619330114 címen találhatók.
- 2016. augusztus; Növényi étrendek az orvostudományban
- Vissza a korábbi piócákra ismételt phlebotomiák és kardiovaszkuláris kockázat BMC Medicine Full Text
- Rossz szokások, nem genetika, táplálja a gyermekkori elhízást
- 10 legjobb energia snack gyerek sportolók számára aktív testük táplálására
- Allergia Tünetek Gyógyító Fa - Integratív Gyermekgyógyászat és Orvostudomány