Az élelmiszer-allergia jövőbeli terápiái
Absztrakt
Az elmúlt két évtizedben az élelmiszerallergia a népies nyugati társadalmak egyik legfontosabb népegészségügyi problémájává vált. 1 2 A 18 év alatti amerikai gyermekeknél az ételallergia prevalenciája 18% -kal nőtt, a mogyoróallergia előfordulása pedig megháromszorozódott (0,4–1,4%) 1997 és 2008 között. 3, 4 5 Az ételallergia a leginkább Az anafilaxia általános oka, amelyet minden sürgősségi osztályon értékeltek minden korcsoportban, és az élelmiszer okozta anafilaxia miatt a kórházi kezelések száma az elmúlt évtizedben több mint háromszorosára nőtt az Egyesült Államokban és az Egyesült Királyságban. 3, 6, 7 Az étel okozta anafilaxia időnként halálos kimenetelű, az Egyesült Államokban a halálozás több mint 90% -át a mogyoróra vagy a diófélékre adott reakció okozza. 8, 9
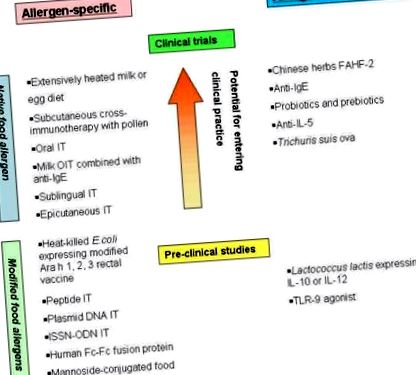
Az ételallergiás immunterápia megközelítései
A nem specifikus megközelítések közé tartoznak a monoklonális anti-IgE antitestek, amelyek növelhetik az élelmiszerallergénekkel szembeni reakcióképesség küszöbértékét, és egy kínai gyógynövénykészítmény, amely megakadályozta a mogyoró okozta anafilaxist a mogyoró anafilaxia egérmodelljében, és jelenleg klinikai vizsgálatokban vizsgálják.
Jelölők kiválasztása új élelmiszer-allergiás terápiákra
I. TÁBLÁZAT
A szekvenciális IgE-kötő epitópok jelentősége a tojásfehérjében, a tehéntejben és a mogyoróban
| Tojásfehérje ovomucoid | ||
| Cooke & Sampson 1997 16 | Tartós tojásallergiában és atópiás dermatitiszben szenvedő gyermekek; 10 aminosavval átfedő ovomucoid dodekapeptidek (AA) szintézisét a HELYEK membrán. | Átmeneti petesejt-allergiás alany szérumában nem volt IgE redukált és alkilezett antitestek (szekvenciális epitópok) ovomucoid, míg a perzisztens petesejtű alany széruma allergia által felismert szekvenciális ovomucoid epitópok. |
| Jarvinen 2007 20 | 11 gyermek átmeneti és 7 gyermek tartós tojásallergia; a központi dekapeptidek mindegyikéből -én szintetizált ovomucoid fő IgE-kötő epitópjai a Helyek membrán; Az immunjelölést azzal végeztük az egyes betegek szérumai. | Mindkét csoportban a tojás-specifikus IgE szintek összehasonlítható tartományban voltak, de átmeneti tojásallergiában szenvedő betegek egyike sem rendelkezett IgE antitestekkel az ovomucoid ezen epitópjaival szemben: AA 1-10, 11-20, 47-56 és 113-122. Ezzel szemben mind a 7 beteg tartós tojásallergiában szenved ezen immunodomináns epitópok közül legalább 4 felismerhető. |
| Tej | ||
| Jarvinen 2001 18 | 10 tartós tejallergiában szenvedő és 10 beteg akik később kinőtték tejallergiájukat; 25 alfa (s1) kazein, alfa (s2) kazein dekapeptidjei, kappa-kazein, alfa-laktalbumin és béta-laktoglobulin, a mag epitópokat tartalmazza, szintetizálva a Helyek membrán; Az egyes betegek szérumát használták immunjelölés | Öt IgE-kötő epitóp (2 alfa (s1) -kazein, 1 alfa (s2)- kazein és 2 kappa-kazein) egyikét sem ismerte fel átmeneti tejallergiában szenvedő betegek, de a a tartósan allergiás betegek többsége. Antitestek a 3 epitóp közül legalább az egyik (AA 123-132 az alfa (s1) kazeinen, AA 171-180 alfa (s2) kazeinnel és AA 155-164 kappa-kazeinnel) tartós tejallergiában szenvedő betegeknél azonosították. |
| Wang 2010 23 | 33 tejallergiás és 8 gyermek kinőtt gyermek tejallergia; peptidek, 20 aminosavból áll átfedésben van 17-vel (3 eltolás) és megfelel az elsődleges értéknek αs1-, αs2-, β- és κ-kazeinek és β-laktoglobulin szekvenciái, üveglemezeken helyezkedtek el. | A tejallergiás alanyok epitóp változatossága megnőtt a tejallergián túlmutatókkal. Kötés nagyobb számú Az IgE peptidek súlyosabb allergiás reakciókkal társultak kihívás közben. Versenyképes peptid mikroarray vizsgálatban allergiás a betegek magas és alacsony affinitású IgE kombinációját mutatták ki kötelező, míg azoknál az alanyoknál, akik kinőtték a tejallergiát, volt elsősorban alacsony affinitású kötés. |
| Földimogyoró Ara h 1, Ara h 2, Ara h 3 (peptid mikroarray) | ||
| Shreffler 2004 21 | Hetvenhét beteg és 15 kontrollszérum volt elemzik. 213 átfedő 20-maradék készlet peptidek az elsődlegesnek megfelelően szintetizáltuk Ara h 1, Ara h 2 és Ara h 3. peptidek szekvenciái három példányban voltak elrendezve a megfelelővel együtt rekombináns fehérjéket üveglemezekre és felhasználjuk immunjelölés | A betegek többségének (97%) specifikus IgE volt legalább az egyikhez rekombináns allergének; 87% -ának volt kimutatható szekvenciális IgE-je epitópok. Az egyes betegeknél szignifikáns heterogenitás volt a felismert epitóp száma és mintázata. Nagy epitóp sokféleség súlyosabb allergiás kórtörténetben szenvedő betegeknél találták reakciók. |
| Flinter- mann 2008 22 | 24 földimogyoróval érzékeny gyermek és 6 atópiás kontroll; Specifikus IgE és IgG4 kötődik 419-hez, átfedésben lévő 15-AA-val a rekombináns Ara szekvenciáját képviselő peptidek h 1, Ara h 2 és Ara h3 mikroarray-vel elemeztük immunvizsgálat. | A földimogyoró-szenzibilizált szérumok lényegesen több IgE-t és IgG4-et kötöttek epitópok, mint kontroll szérumok. Pozitív összefüggés volt a között a felismert IgE epitóp száma és klinikai érzékenység (r = 0,6; P = .021). Az IgE és IgG4 epitóp-felismerési minták stabilak voltak 20 hónapos időszak. |
AZ ÉLELMISZER-ALLERGIA KEZELÉSÉNEK IMMUNoterápiás megközelítései
Az ételallergiás betegek 3 alapvető fenotípusra oszthatók; átmeneti ételallergia, tartós ételallergia és élelmiszer-pollen (orális allergia) szindróma. Fejlődő bizonyítékok alapján úgy tűnik, hogy az IgE által közvetített ételallergia mindegyik formája különböző immunológiai mechanizmusok eredménye, és ezért valószínűleg különböző immunterápiás megközelítéseket igényelnek a feloldáshoz. Úgy tűnik, hogy az átmeneti ételallergiában szenvedő betegek reagálnak a legkedvezőbben a terápiára. Bár vitatható, hogy az átmeneti ételallergia nem igényel kezelést, a terápia lehetséges előnyei közé tartozik a tolerancia felgyorsult fejlődése, valamint az életminőség és a táplálkozás javulása. A tartós ételallergia nagyobb kihívást jelenthet. Azoknál a betegeknél, akiknek az élelmiszerallergia kitartó formája van, valószínűleg kevésbé lesz kedvező válaszuk a terápiára, ideértve a deszenzitizálás elmulasztását, az orális tolerancia kialakulásának elmulasztását, a hosszabb kezelési igényt és a terápia során súlyosabb mellékhatások kialakulását. Ahogy a különböző kezelési módokkal kapcsolatos tapasztalatok növekednek, jobban felkészültek leszünk a betegek tanácsadására az optimális, egyénre szabott terápiás lehetőségekről.
ALLERGEN-SPECIFIKUS IMMUNOTERÁPIA
Fokozottan melegített tejet és tojást tartalmazó étrend
Számos tanulmány kimutatta, hogy az átmeneti tojás- és tejallergiában szenvedő gyermekek elsősorban konformációs-IgE-kötő epitópok ellen irányulnak IgE antitesteket, amelyek tágabb hőkezelés vagy élelmiszer-feldolgozás során elpusztulnak. 16, 17 E megfigyelések alapján feltételeztük, hogy az átmeneti tej- és tojásallergiában szenvedő gyermekek, amelyek a tej- és tojásallergiás gyermekek 80% -át teszik ki, tolerálják a tejet és a tojást tartalmazó sütőipari termékeket. Két klinikai vizsgálatban vizsgálták az erősen melegített (más termékekbe sütve) tej és tojás toleranciáját tej- és tojásallergiás gyermekeknél. 25, 26 Mindkét vizsgálatban a gyermekek körülbelül 80% -a tolerálta az erősen melegített tejet és tojástermékeket egy kezdeti orvos által felügyelt orális beadás során. Az adrenalin-kezelést igénylő súlyos reakciók csak azoknál a gyermekeknél fordultak elő, akik reagáltak az erősen melegített tejtermékekre, de nem olyan gyermekeknél, akik tolerálták az erősen melegített tejet és reagáltak a fűtetlen tejre. Ezzel szemben nem volt ilyen megkülönböztetés azoknál a gyermekeknél, akik reagáltak az erősen melegített vagy fűtetlen tojástermékekre.
Az élelmiszer-specifikus IgE-szintek és a szúró bőrtesztek nem voltak megbízható markerek az erősen melegített tejet vagy tojást toleráns gyermekek azonosításához, és szájon át történő táplálékkal kapcsolatos kihívásokra volt szükség. Azonban a túlmelegített tejre reagáló gyermekek többségének tejspecifikus IgE antitestszintje meghaladta a 35 kUA/L értéket (UniCAP, Phadia). Egy másik betegpopuláción végzett vizsgálatban a hőkezelt tojással szembeni reaktivitás pozitív döntési pontja 10,8 kUA/l, a negatív döntési pont pedig 1,2 kUA/l volt (UniCAP, Phadia). 27.
Azok a gyermekek, akik reagáltak az erősen meleg tejre, szignifikánsan magasabb bazofil reaktivitást mutattak a kazeinnel történő stimulációra, mint az erősen melegített tej-toleráns gyermekek. 28 szignifikánsan magasabb medián százalékos arány (25% és 75%), 16,9% (7,1-31,7) volt a proliferáló kazein-specifikus CD25 (+) CD27 (+) T-sejtekben, 18 extenzíven melegített tej-toleráns kazein által indukált PBMC tenyészetekből az alanyok összehasonlítva 8 alanygal, akik reaktívak a melegített tejre; 4,9% (2,6-7,5); P 29 A csoportok között nem volt szignifikáns különbség a poliklonális T-sejtek vagy a kazein-specifikus T effektor sejtek gyakoriságában. A kazein-specifikus T szabályozó sejtek FoxP3 (+) CD25 (hi) CD27 (+), CTLA 4 (+), CD45RO (+) CD127 (-) voltak. A CD25 (hi) sejtek in vitro tenyésztés előtti kimerülése jelentősen fokozta a kazein-specifikus T effektor sejtek terjeszkedését, megerősítve a nagyobb T szabályozó aktivitás jelenlétét. A kazein-specifikus T szabályozó sejtek nagyobb gyakorisága korrelált az enyhe, átmeneti tejallergia és a kedvező prognózis fenotípusával.
A tej vagy tojás pékáruk kerültek a toleráns gyermekek étrendjébe, akiket 3-6 havonta követtek nyomon. Nem tapasztaltak növekedést az akut allergiás reakciókban vagy az alapvető atópiás betegségek, például asztma, atópiás dermatitis vagy ekcéma súlyosságában. Az étrend során az első évben nem nőtt a bélpermeabilitás (amelyet a laktulóz és a mannit vizeletürítésének mérésével határoztak meg), és a növekedésre sem volt negatív hatás. A tejjel és tojással ellátott pékáruk étrendbe történő bevitelét követően megfigyelt immunológiai változások közé tartozott az élelmiszer-specifikus IgG4 antitestek növekedése, a bőrszúrás tesztjeiből származó búzaméret csökkenése és az élelmiszer-specifikus IgE antitestek csökkenésének tendenciája; az orális immunterápia során megfigyeltekhez hasonló eredmények. Az előzetes eredmények azt sugallják, hogy a pékárukon elhelyezett gyermekek közül sokan gyorsabban tolerálják a toleranciát, és folyamatban van egy nagy tanulmány annak megállapítására, hogy az immunterápia egyik formájaként a sütőtermékeket hogyan lehet bevinni a toleráns gyermekek étrendjébe.
Szubkután mogyoró immunterápia
A szubkután immunterápiát több mint 100 éve alkalmazzák a környezeti allergiák kezelésére. A mogyoró vizes kivonatát használó vizsgálatban három aktívan kezelt alany 67% - 100% -os csökkenést mutatott a kettős-vak, placebokontrollált ételkihívások során, és a végpont bőrében 2-5 log log csökkent. szúrópróba reaktivitás a mogyoróra a kezelés végén, míg egy placebóval kezelt alany nem változott ezekben a paraméterekben. 30 Egy gyógyszertári hiba következtében egy placebóval kezelt alany anafilaxiában halt meg egy adag mogyorókivonat beadását követően, ami a vizsgálat befejezését eredményezte. Ez a tragikus esemény rávilágított a mogyoró immunterápia súlyos kockázataira.
Egy utólagos vizsgálatban 6 alanyot 0,5 ml fenntartó dózissal kezeltek 1: 100 tömeg/térfogat mogyorókivonatban, és 6 beteget megfigyelés alatt kezeletlen kontrollcsoportként követtek 12 hónapig. A 12. hónap végén mind a 6 kezelt alany tolerálta a megnövekedett mogyoróküszöb dózist az orális étkezési kihívások során, és csökkent érzékenysége volt a titrált földimogyoró bőrszúrás tesztjén, míg a kezeletlen kontrollok nem tapasztaltak javulást ezekben a paraméterekben. Azonban a légzési érintettséggel járó anafilaxiát a rohanás fázisában átlagosan 7,7-szer váltották ki (a dózisok 23% -a), földimogyoró immunterápiával kezelt alanyonként átlagosan 9,8 epinefrin injekcióval. A 6 beteg közül csak 3 tudta elérni a tervezett fenntartó dózist a gyakori mellékhatások miatt. A fenntartó szakaszban a szisztémás reakciók aránya 39% volt, alanyonként átlagosan 12,6 epinefrin injekcióval. Míg ez a tanulmány bizonyítékot szolgáltatott arra vonatkozóan, hogy az injektált ételallergén deszenzitizációt indukálhat, a kiszámíthatatlan, súlyos mellékhatások magas aránya elbátortalanította a terápia ezen formájának további értékelését.
A keresztreaktív élelmiszerek virágporával végzett immunterápia
A keresztimmunoterápia fogalmát a pollen-étel allergia szindrómára (PFAS, más néven orális allergiás szindróma) alkalmazták. Számos tanulmány változó jótékony hatást mutatott az orális tünetekre és a bőrteszt reaktivitására bizonyos növényi táplálékkal szemben a pollen szubkután vagy szublingvális immunterápiával kezelt személyeknél. 32 - 35 36 Nyírfa szubkután immunterápia nyílt vizsgálata nyír allergiás náthában és almával kapcsolatos PFAS-ban szenvedő 49 felnőttnél a kezelt alanyok 84% -ánál az alma okozta orális tünetek szignifikáns csökkenését (50-95%) vagy teljes megszűnését mutatta, szemben előny a kontrollokban (P 32 Egy utólagos vizsgálatban az alanyok több mint 50% -a tolerálta az almát a 30 hónapos látogatáskor (18 hónappal a nyír immunterápia leállítása után); a többség pozitív bőrszúró tesztre tért vissza. mely alma és más nyers ételek szájon át szedett allergiás tüneteit diagnosztizálták DBPCFC-kkel, alátámasztják a nyír szubkután immunterápia jótékony hatását az alcsoportok egy részében. 34, 37 35 Nyírfa pollenkivonattal ellátott szublingvális immunterápia (SLIT) nyír allergiás náthában szenvedő felnőtteknél nem szignifikánsan csökkentse az alma okozta PFAS tüneteket
A PFAS-ra gyakorolt jótékony hatásokról döntően a nyírfa virágporára egyérzékeny és felnőtteknek nagy dózisú pollen immunterápiával kezelt felnőttek számoltak be. A nyírfa virágporára adott T-sejt immunreakciói keresztreaktív főbb élelmiszerallergénekre, például alma Mal d 1-re, mogyoró Cor a 1-re és sárgarépa Dau c 1-re, részben Bet v 1-függetlenek. Ezért a módosított, rekombináns ételallergéneken alapuló vakcinák kiváló megközelítést jelenthetnek a PFAS kezelésében.
ÉLELMISZER ORÁLIS IMUNOTERÁPIA
A petesejtek által kiváltott anafilaxiában szenvedő fiúk sikeres orális immunterápiájáról (OIT) először 1908-ban számoltak be. 11 Jelenleg az ételek orális immunterápiája (OIT) az egyik legaktívabban vizsgált terápiás megközelítés az ételallergia szempontjából, bár kevés vizsgálat igazolt betegeket reaktivitás a terápia előtt és/vagy tartalmazott egy placebo kontrollt. Továbbá, bár a vizsgálatok azt sugallják, hogy az ételallergiás betegek többsége deszenzitizálhatatlan OIT-vel, egyetlen tanulmány sem mutatta be a tolerancia kialakulását. Ezenkívül gyakoriak a terápiás mellékhatások, azaz a dózisok 25% -a jár a káros tünetekkel, bár a legtöbb enyhe. (II. Táblázat)
II. TÁBLÁZAT
Élelmiszer-orális immunterápia
Az orális tolerancia kontra deszenzitizálás
Az ételallergia-terápia végső célja a tartós orális tolerancia, amely akkor jön létre, amikor az ételt allergiás tünetek nélkül lehet elfogyasztani, annak elhúzódása ellenére is. Az állandó orális tolerancia mechanizmusa valószínűleg magában foglalja a szabályozó T-sejtek kezdeti kialakulását és az immunallergia eltérést a proallergiás Th2-választól, majd a későbbi szakaszokban anergiát követ. Ezzel szemben „deszenzitizálatlan állapotban” a védelem az ételallergén rendszeres bevitelétől függ; ha az adagolást megszakítják vagy abbahagyják, a védőhatás elveszhet vagy jelentősen csökkenhet. Az orális deszenzitizációt kísérő immunológiai változások közé tartozik a hízósejtek és a bazofilek csökkent reaktivitása, az élelmiszer-specifikus IgG4 antitestek növekedése és végül az élelmiszer-specifikus IgE antitestek csökkenése. A védelem tartóssága tesztelhető az adagolás szándékos megszakításával legalább 4 - 12 hétig, amelyet felügyelt szájon át történő étkeztetés követ. 40, 41
Az adagolás ütemezése
Az OIT során az ételt járműben keverik (biztonságos élelmiszer), és fokozatosan növekvő adagokban fogyasztják. A dózisemelés általában ellenőrzött körülmények között történik, és a tolerált dózisok napi rendszeres bevitele a felépítési és fenntartási szakaszban otthon történik. A korai, ellenőrizetlen tanulmányok bizonyítékot szolgáltattak arra vonatkozóan, hogy az ételallergiás alanyok egy részének „érzéketlenné válhat” különféle élelmiszerek, köztük tej, tojás, hal, gyümölcs, földimogyoró és zeller. 42 - 45 Néhány alany, aki tolerálta a fenntartó dózist, még jelentős ideig is, újból kialakította az allergiás tüneteket, ha az ételt nem fogyasztották be rendszeresen, és felhívta a figyelmet arra, hogy a tartós tolerancia nem valósult meg. 40
Tej OIT
Az étkezés orális immunterápiájára adott válaszminták
Az OIT-re adott válasz különféle mintái derülnek ki a publikált tanulmányokból. 40, 41, 46, 49, 51 (2. ábra) A betegek körülbelül 10-20% -a nem sikerül a kezdeti rohanás/eszkaláció fázisában (deszenzitizációs hiba), és jelentős mellékhatások miatt kivonul a protokollokból; 10-20% nem éri el a teljes tervezett fenntartó dózist (részleges deszenzitizálás). Összességében körülbelül 50-75% éri el és tolerálja a fenntartó dózist. A gyermekek többsége 5 g-nál kevesebb allergiás ételt tolerál terápia közben, de még azt kell meghatározni, hogy a részben szenzitizálatlan alanyok toleránssá válhatnak-e hosszabb időtartamú OIT mellett. Az sem világos, hogy a deszenzitizálás sikertelensége társul-e a legsúlyosabb és legvalószínűbb tartós ételallergia fenotípussal szemben a sikeres deszenzitizációval és tolerancia indukcióval, amely átmeneti klinikai fenotípussal és az ételallergia spontán feloldódásának nagyobb esélyeivel társulhat.
- Az IgE ételallergiák különbsége; IgG ételallergia • ImuPro
- A jövőnket fogyasztó fosszilis élelmiszerek
- Félelem nélküli étkezés ételallergiák esetén
- Az ekcémás gyermekek esetében az élelmiszerallergiák közötti kapcsolat nem egyértelmű
- Macskás pattanások és ételallergiák megoldása Purrrfectly Holistic Purrrfectly Holistic; egy butik a