Az intranazális csepegtetés hatása Escherichia coli étrend okozta elhízott egerekben a lépsejtek apoptózisán
Tárgyak
Absztrakt
A diéta indukálta-elhízott (DIO) egerekben a splenikus immunfunkció fokozódott Escherichia coli. Az apoptózis során a lép működésében bekövetkezett változások még mindig nem ismertek. Kétszáz egér Lean csoportokban-E. coli és a DIO-E. coli intranazális beültetés volt E. coli. A Lean-PBS és a DIO-PBS csoportokban további kétszáz egérnek foszfáttal pufferolt sóoldatot (PBS) adtak. Ezt követően a lép szövettanját elemeztük. Ezután a lépsejtek (SC) apoptózisának sebességét, valamint a Bcl-2, Bax, kaszpáz-3 és kaszpáz-9 génjeinek és fehérjéinek expresszióját minden csoportban 0 óra (nem fertőzött), 12 óra, 24 óra után számszerűsítettük. és 72 óra utáni fertőzés. A DIO SC apoptózis aránya-E. coli csoportok alacsonyabbak voltak, mint a DIO-PBS csoportoké, 12, 24 és 72 órával (o
Bevezetés
Az elhízás egy összetett anyagcsere-állapot, amely számos fiziológiai rendszert befolyásol, beleértve az immunfunkciókat is. Ezen fiziológiai rendszerek egyikében bekövetkező változások önmagukban vagy kombinációban drámai módon befolyásolhatják a tüdő gyulladásos ingerekre adott válaszát 1. Az elhízás növeli az emberek fogékonyságát a baktériumok által okozott tüdőkárosodás okozta bakteriális fertőzésekre, súlyos betegségekre és halálra 2,3 .
Érdekes módon a legújabb tanulmányok kimutatták, hogy az elhízás védő szerepet játszott a tüdőgyulladásban 4,5. A Gu előzetes tanulmánya szerint az elhízás enyhítheti az egerek lépének oxidatív károsodását és gyulladását nem halálos kimenetelű akut tüdőgyulladás esetén, amelyet Escherichia coli 6. Ezek az eredmények arra utalnak, hogy az elhízás fokozhatja az egerek lépjének immunválaszát a tüdőfertőzés ellen.
Az apoptózis fontos folyamat a gazdasejtek homeosztázisának normális fejlődésében és fenntartásában a többsejtű organizmusokban 7,8. Különböző környezeti ingerek, valamint fiziológiai és kóros állapotok (pl. Oxidatív stressz) indíthatják vagy gátolhatják 9. Az apoptózis befolyásolja az immunrendszer stabilitását keresztül gén expresszió és/vagy fehérje aktivitás szabályozása 9. Az elhízás és a fertőzés a lépsejtek (SC) apoptózisát indukálhatja. Például Wang et al. 10 beszámolt arról, hogy a magas zsírtartalmú étrenddel (HFD) táplált egereknél a lépben a T-szabályozó sejtek megnövekedett apoptózisa volt a kontroll egerekhez viszonyítva, a B-sejtes lymphoma-2-asszociált X fehérje (Bax) és a kaszpáz-3 a B-sejtes lymphoma (Bcl) -2 expressziója csökkent az étrend által kiváltott elhízás (DIO) csoportban. Ezenkívül az SC-k fokozott apoptózisát találták lipopoliszacharid (LPS) -nel kezelt patkányokban, és hogy a Bcl-2 expresszió csökkent és a Bax expresszió növekedett 11 .
A lép az emberek legnagyobb immunszerve. A limfociták előállításában, érésében és tárolásában játszott szerepe révén részt vesz a humorális és sejtes immunválaszokban 12. Az SC apoptózisának változásai befolyásolhatják a bakteriális fertőzésben szenvedő elhízott emberek immunválaszát.
Eddig nagyon kevés információ állt rendelkezésre az elhízott és normális egerek közötti SC apoptózisról E. coli fertőzés. Ennek az ismerethiánynak a kitöltésére megfigyeltük a lép patológiás szövettanát, és megmértük az apoptózis sebességét, valamint az apoptózissal kapcsolatos gének és fehérjék (Bcl-2, Bax, kaszpáz-3, kaszpáz-9) expresszióját egerekben E. coli fertőzés. Eredményeink új kísérleti bizonyítékokkal szolgálhatnak a lépsejtek apoptózisának megértésére étrend által kiváltott-elhízott egerekben nem halálos kimenetelű akut tüdőgyulladásban. E. coli fertőzés.
Anyagok és metódusok
A vizsgálati protokoll etikai jóváhagyása
Az állatok gondozásáról és vizsgálatáról szóló jegyzőkönyveket az EGSZB jóváhagyta Iránymutatások a laboratóriumi állatok gondozásához és használatához (National Institutes of Health, Bethesda, MD, USA), illetve a Szecsuáni Agráregyetem (Chengdu, Kína) Etikai Bizottsága. Valamennyi módszert a vonatkozó irányelveknek és előírásoknak megfelelően hajtottuk végre.
Kísérleti állatok kezelése
Négyszáz hím kunmingi egeret (3 hét) vásároltunk a Dashuo Animals-től (Chengdu, Kína), és specifikus kórokozóktól mentes körülmények között helyeztük el őket. A kísérlet során az egerek hozzáférhettek ad libitum a Dashuo Animal Center (Chengdu, Kína) 8 héten át tartó steril kereskedelmi étrendjéhez 4,13. A környezeti hőmérsékletet 22–24 ° C-on tartottuk, és az egereket 12 órás világos-sötét ciklusnak vetettük alá. 1 hét környezeti akklimatizáció után az egereket véletlenszerűen két csoportra osztottuk: Lean (n = 200) és DIO (n = 200). Az egerek testtömegét minden táplálkozási csoportban hetente mértük, amellyel DIO egerek nyerhetők ki 8 hét után 4 .
E. coli
E. coli a szecsuáni Agráregyetem (Chengdu, Kína) Állatorvosi Orvosi Laboratóriumából szereztük be. Korábban kimutattuk, hogy a fertőzött egerek E. coli (4 × 109 CFU/ml) keresztül az intranazális úton tipikus tüdőgyulladás volt, de nem halt meg. E. coli 20 órán át 37 ° C-on tenyésztettük lizogén tenyész táptalajban, hogy bakteriális folyadékot kapjunk. Ez utóbbit centrifugáltuk és PBS-ben szuszpendáltuk inokula előállításához.
Intranazális fertőzés
Az egereket további négy csoportra osztottuk: Lean-PBS (n = 100), Lean-E. coli (n = 100), DIO-PBS (n = 100) és DIO-E. coli (n = 100). Egerek a Lean-ból-E. coli és a DIO-E. coli csoportokat intranazálisan csepegtettünk 40 μL szuszpenzióval
10 9 CFU E. coli. A Lean-PBS és a DIO-PBS csoportból származó egereknek azonos dózisú PBS 4,5-t adtak. Két egeret eltávolítottunk, amelyek 6 órán belül elhaltak az intranazális beültetés után.
Szövettan és festés
0 (nem fertőzött), 12, 24 és 72 órával a fertőzés után minden csoportból nyolc egeret feláldoztunk, a lép szöveteit elemeztük és lefényképeztük. A lép szöveteit 4% paraformaldehidben rögzítettük és rutinszerűen paraffinban dolgoztuk fel. Ezután dehidratáltuk, paraffinba ágyazottuk, metszettük (vastagsága 4 mm)
Splenocita előállítás
0 órakor (fertőzés előtti), 12, 24 és 72 órában (fertőzés utáni) a kivágott lépekből sejthomogenátumokat készítettünk, és 1000 × g 5 percig 4 ° C-on, hogy kicsapódjanak. A sejtkoncentrációkat beállítottuk
106/ml PBS-sel, és 4 ° C-on tároltuk. Ezután 5 µl annek-sein-V-fluoreszcein-izotiocianátot (V-FITC; 51-66121E; BD Pharmingen, San Jose, Kalifornia, USA) és propídium-jodidot (PI; 5 µl) adtunk 100 ul sejtszuszpenzióhoz. Ezt követően a lépsejt-szuszpenziókat 15 percig inkubáltuk 22 ° C-on, sötétben. 400 ul kötőpuffert (BD Pharmingen, USA, 559763) adunk a sejtszuszpenziókhoz. Ezután a sejtszuszpenziókat Vortex oszcillációval összekevertük.
Az apoptózis mértékének meghatározása áramlási citometriával
0 (nem fertőzött), 12, 24 és 72 órával a fertőzés után minden csoportból nyolc egeret feláldoztunk, a lép szöveteit elemeztük. A lépben az apoptózis mértékét áramlási citometriával vizsgáltuk BD FACSCalibur ™ (BD Biosciences, San Diego, CA, USA) alkalmazásával 1 órán belül. A fluoreszcenciával aktivált sejtek szétválogatását 10 000 sejtmintával végeztük el, előre és oldalra történő szórás alapján. Az adatokat a Flowjo (BD Biosciences) segítségével tároltuk és dolgoztuk fel.
Kvantitatív valós idejű polimeráz láncreakció (qRT-PCR)
0 (nem fertőzött), 12, 24 és 72 órával a fertőzés után minden csoportból nyolc egeret feláldoztunk, a lép szöveteit elemeztük. A lépszövetekben a génexpressziót qRT-PCR alkalmazásával mértük. Az összes RNS-t a lépből izoláltuk RNAiso Plus (9108/9109; Takara Bio, Tokió, Japán) alkalmazásával. Komplement (c) DNS-t szintetizáltunk a lép teljes RNS-jéből egy PrimeScript ™ RT reagenskészlettel (RR047A; Takara Bio) a gyártó utasításainak megfelelően. Ezután a cDNS-t alkalmaztuk templátként a qRT-PCR elemzéshez. A qRT-PCR reakciókhoz 10 μL keveréket készítettünk SYBR® Premix Ex Taq ™ II (DRR820A, Takara Bio) alkalmazásával, amely 5 μl Tli RNaseH Plus-ot, 0,4 μl előre és 0,4 μl fordított primert, 3,4 μL RNAáz-mentes anyagot tartalmaz. víz és 0,8 μl cDNS. A Bax, Bcl-2, Caspase-3 és Caspase-9 génexpresszióit számszerűsítettük, belső standardként β-aktint (Sangon Biotech, Shanghai, Kína) használtunk.
A következő egér-primereket (előre, illetve hátra) használtuk: Bcl-2 AGCCTGAGAGCAACCCAAT és AGAGGATGACCACCACAAAG; Bax, ATGCGTCCACCAAGAAGC és CAGTTGAAGTTGCCATCAGC; kaszpáz-3, ACATGGGAGCAAGTCAGTGG és CGTCCACATCCGTACCAGAG; kaszpáz-9, GAGGTGAAGAACGACCTGAC és AGAGGATGACCACCACAAAG; β-aktin, TGCTGTGTTCCCATCTATCG és TTGGTGACAATACCGTGTTCA.
Ezeket a génprimereket a Primer 5 tervezte és a Sangon Biotech cégtől szerezte be. A kerékpározás körülményei a következők voltak: 95 ° C 3 percig, majd 44 ciklus 10 másodpercig 95 ° C-on, 30 másodpercig 60 ° C-on és 10 másodpercig 72 ° C-on. A kerékpározás a LightCycler® 480 Real-Time PCR rendszer (Roche, Basel, Svájc) segítségével történt. Az átiratokat a 2 -ΔΔCt módszerrel számszerűsítettük.
Western blottolás
12 órával a fertőzés után minden csoportból három egeret feláldoztunk, a lép szöveteit megfigyeltük. A lép szöveteit lizáltuk, és a fehérjéket RIPA lízis pufferrel extraháltuk. Ezután a lép teljes lizátumait nátrium-dodecil-szulfát-poliakrilamid gélelektroforézissel elválasztottuk 12% -os gélek felhasználásával, majd elektroforetikus transzfer cellákban 30 percig nitrocellulóz membránokra helyeztük. Ezt követően ezeket a nitrocellulóz membránokat 2% zsírmentes száraz tejben 1 órán át blokkoltuk, és egy éjszakán át 4 ° C-on inkubáltuk a primer Bax (ab32503), Bcl-2 (ab182858), kaszpáz-3 (ab184787) és kaszpáz- antitestekkel. 9 (ab202068), amelyek mind Abcam-ból (Cambridge, Egyesült Királyság) származnak. A nitrocellulóz membránokat háromszor (egyenként 15 percig) TBS-Tween-rel (TBST) mostuk, és szekunder antitestekkel (7074; Cell Signaling Technology, Danvers, MA, USA) inkubáltuk 1,5 órán át, és háromszor mostuk (mindegyik 15 percig). a TBST-vel. A blotokat ECL TM Chemiluminescence reagenssel (Beyotime technológia, P0018A) tettük láthatóvá és röntgenfilmre rögzítettük. A fehérje expressziót Image-Pro ® Plus 6.0 (Media Cybernetics, Rockville, MD, USA) alkalmazásával dolgoztuk fel.
statisztikai elemzések
Két csoport közötti különbség jelentőségét a független minták elemezték t tesztet, míg a 72 órán belüli négy csoport közötti szignifikáns különbségeket varianciaanalízissel (LSD vagy Dunnett's T3) elemeztük. Az eredményeket átlag ± szórásként fejeztük ki. Az elemzéseket a Windows SPSS 17.0 szoftverével (IBM Corp, Armonk, NY, USA) végeztük. A statisztikai szignifikanciát a o
Eredmények
Lép hisztopatológia
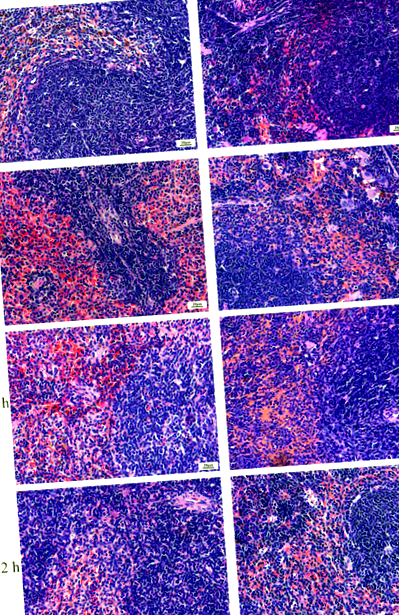
Lean lépek-E. coli csoportok és a DIO-E. coli a csoportok normál szövettanúak voltak, tiszta fehér és vörös péppel 0 óra múlva, de a vörös pép enyhe hiperémiáját a DIO-ban-E. coli csoportok (1. ábra). 12 órakor a Lean vörös velőterületei-E. coli csoportok torlódtak. A területeken megnőtt a többmagú óriássejtek száma, a fehérvelő limfociták elrendeződése laza volt, a lépcsomók üresek voltak. Míg a DIO vörös velős területei-E. coli csoportok zsúfoltak voltak, és makrofágok és többmagú óriássejtek voltak a területeken. A 24. órában kis mennyiségű plazmasejtet, neutrofileket, makrofágokat, megakariocitákat és vakuolákat találtak a Lean lép peremterületén.-E. coli csoportok. Vakuumokat találtak a lép orrmelléküregében. 72 óra múlva a Lean lépe-E. coli csoportok és a DIO-E. coli csoportok vörös pulpa hiperémiát mutattak.
Az egér lépek szövettani szerkezetének változásai. A lép felépítését fénymikroszkóppal figyeltük meg a lép architektúrájának vizsgálatára. N = 8 egér csoportonként. Méretarány = 20 μm.
Az SC-k apoptózisának mértéke áramlási citometriával
Az SC apoptózis mértékét a korai (Annexin-V- és PI-negatív) és a késői (Annexin-V-pozitív és PI-pozitív) apoptotikus sejtek összes százalékának kimutatásával áramlási citometriával vizsgáltuk. Az SC apoptózis aránya a DIO-PBS csoportokban minden idõpontban szignifikánsan magasabb volt, mint a Lean-PBS csoportokban (o 2. ábra
Az SC-k apoptózisa TUNEL-vizsgálattal
Amint a 3. ábrán látható, a lépben barnával festett magokkal rendelkező apoptotikus sejteket találtunk a TUNEL-vizsgálattal. Az apoptotikus sejtek pedig nukleáris kondenzációt és szabálytalan alakot mutattak.
Az SC-k szövettana a TUNEL assay segítségével. Barnafoltos sejtekkel rendelkező apoptotikus sejteket találtunk az egér lépében a TUNEL assay-vel, nukleáris kondenzációval és szabálytalan alakúakkal. A képek 400-nál készültek× nagyítás. N = 8 egér csoportonként. Méretarány = 20 μm.
A bcl-2, bax, kaszpáz-3 és kaszpáz-9 mRNS expressziója qRT-PCR-rel
A qRT-PCR szerint a DIO-csoportok pro-apoptotikus Bax génjének expressziója magasabb volt, mint a Lean-csoportoké 0 óra alatt (o 4. ábra
A bcl-2, bax, kaszpáz-3 és kaszpáz-9 fehérjéinek expressziója Western-blottolással
Amint az 5. ábra mutatja, 12 óra múlva a Lean Bcl-2 fehérjéjének expressziói-E. coli csoportok alacsonyabbak voltak, mint a Lean-PBS csoportoké, és a DIO Bcl-2 fehérjéjének expressziója-E. coli csoportok magasabbak voltak, mint a DIO-PBS csoportoké (o 5. ábra
Vita
Az elhízás krónikus, alacsony fokú gyulladásos reakció, amely befolyásolja a humorális és a sejtek által közvetített mechanizmusok által közvetített nem specifikus és specifikus immunválaszokat 15. A lép, mint az emberek és a rágcsálók legnagyobb perifériás nyirokszerve, központi szerepet játszik az immunválasz hatékony működésében 16, 17. A lép szintetizálhatja antitestjeit fehér pépében, és eltávolíthatja az antitesttel bevont baktériumokat és az antitesttel bevont vérsejteket vér és nyirokcsomó keringések útján. Ezért a lép szerkezetében bekövetkező változások befolyásolják a gazda immunállapotát.
Jelentős kapcsolatot dokumentáltak a HFD bevitel és a lépdezorganizáció között egerekben 18. Yamano et al. 19 megállapította, hogy a HFD-vel táplált egerekben megnövekedett a lép vörös vörös cellulóz és a makrofágok aránya, és az elemi vas főleg a vörös cellulózban rakódott le. A splenomegalia során sok immunsejt szabadul fel, hogy részt vegyen az immunvédelemben, amikor a gazda megfertőződik 11,20. Jelen tanulmányban a lép szerkezete különbségeket mutatott a különböző kezelési csoportok között. A társbetegségek (elhízás és fertőzés) miatti strukturális dezorganizáció megváltoztathatja a lép mikrokörnyezetét, amely a Lean-egerekben és a DIO-egerekben 18 eltérő immunválaszt mutatott. A következő tesztben további ellenőrzést fogunk végezni.
Az adatok elérhetősége
További nem publikált adatok nem állnak rendelkezésre. Minden szerző megosztja a kézirata eredményeinek alapjául szolgáló adatokat. Az adatmegosztás lehetővé teszi a kutatók számára, hogy ellenőrizzék a cikk eredményeit, megismételjék az elemzést és másodlagos elemzéseket végezzenek.
Hivatkozások
Mancuso, P. elhízás és tüdőgyulladás. J. Appl. Physiol. 108., 722–728 (2010).
- Escherichia coli (E
- Dukan-diéta és székrekedés 5 különböző módja ennek a kellemetlen mellékhatásnak a kezelésében; Az én Dukanom
- MEGFONTOLÁSOK A TÁPLÁLKOZÁSI MÓDSZEREK VÁLASZTÁSÁBAN A TÁPLÁLKOZÁS HATÁSÁNAK VIZSGÁLATÁRA
- Escherichia coli által kiváltott granulomatózus vastagbélgyulladás macskában
- A lép fájdalmának okai; News-Medical